INTRODUCCIÓN
Las calcinosis cutáneas (CC) constituyen un grupo muy heterogéneo de enfermedades cuyo común denominador es el depósito de calcio en la piel. Históricamente se las ha dividido en distróficas, metastásicas e idiopáticas1, 2.
La calcificación de la pared de los vasos sanguíneos cutáneos, generalmente incluida en las CC metastásicas, es un hallazgo escasamente descrito en la literatura3. Con frecuencia se utiliza el término calcifilaxia (CFX) para estos casos, especialmente cuando se asocian a in-suficiencia renal crónica e hiperparatiroidismo. Sin embargo, existen numerosos aspectos controvertidos que rodean a su propio concepto4. Para empezar, la propia génesis. Fueron Selye et al5 los primeros en acuñar este término en base a un estudio experimental realizado en ratas a las que provocaban el depósito de calcio en la piel y otros órganos. La asignación del término CFX a pacientes con calcificación vascular y con escaso, por no decir mínimo, paralelismo con los experimentos en animales de Selye constituye un primer desacierto6. En segundo lugar, la falta de unanimidad en su significado y la propia inexactitud del término CFX ha llevado a numerosos autores a emplear múltiples denominaciones para estos pacientes basadas fundamentalmente en criterios clínicos o histológicos7-11. Por último, su carácter frecuentemente fatal y la asociación con enfermedad renal terminal e hiperparatiroidismo secundario se van viendo progresivamente rebatidos por la aparición de un amplio número de pacientes que no se incluyen en dicho contexto.
OBJETIVOS
Dada la actual controversia que refleja la literatura en torno al concepto de CFX, decidimos revisar todos aquellos casos de calcificación vascular cutánea (CVC) presentes en nuestros archivos con el fin de: a) determinar las enfermedades asociadas, cutáneas y extracutáneas, con especial atención a la insuficiencia renal; b) evaluar detalladamente las manifestaciones clínicas e histopatológicas de las lesiones en las que se encontraba presente la calcificación; c) establecer grupos con una determinada correlación clínico-patológica, y d) proponer una nueva clasificación de las calcinosis cutáneas.
PACIENTES Y MÉTODO
Se revisaron de forma retrospectiva todos aquellos casos de CVC presentes en los archivos de los Servicios de Dermatología y Anatomía Patológica del Hospital Universitario de La Princesa durante el período comprendido entre octubre 1988 y julio 2000. Se define CVC como la «presencia de depósitos de calcio en la pared de los vasos a nivel cutáneo», independientemente del diagnóstico de la enfermedad subyacente, el tipo de lesión u otros factores clínicos e histológicos. Siguiendo este criterio se seleccionaron 17 biopsias cutáneas correspondientes a 17 pacientes. Aquellos casos con biopsias artefactadas, material histológico insuficiente o datos clínicos marcadamente incompletos fueron excluidos.
Se revisaron los siguienttes parámetros clínicos: historia médica previa y simultánea al hallazgo de CVC; administración de medicamentos durante el mes previo a la obtención de la biopsia cutánea; tipo, localización, sintomatología y tiempo de evolución de las lesiones cutáneas; tratamiento realizado y evolución de las lesiones.
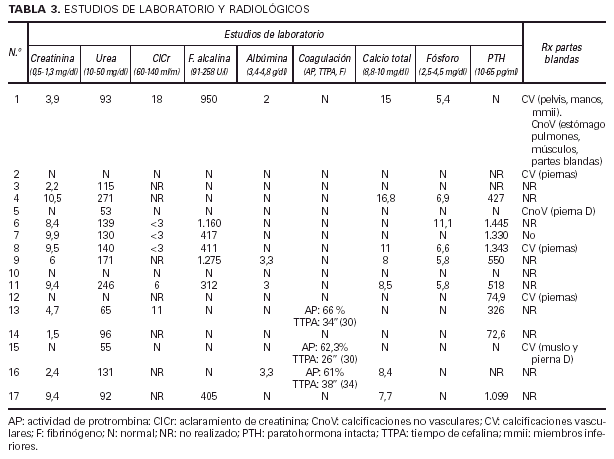
Se evaluaron las siguientes pruebas complementarias: determinación en sangre de creatinina, urea, fosfatasa alcalina, albúmina, estudio de coagulación (actividad de protrombina, tiempo de cefalina, fibrinógeno, plaquetas), calcio total, fósforo inorgánico, hormona paratiroidea intacta; estudio radiológico de partes blandas en extremidades.
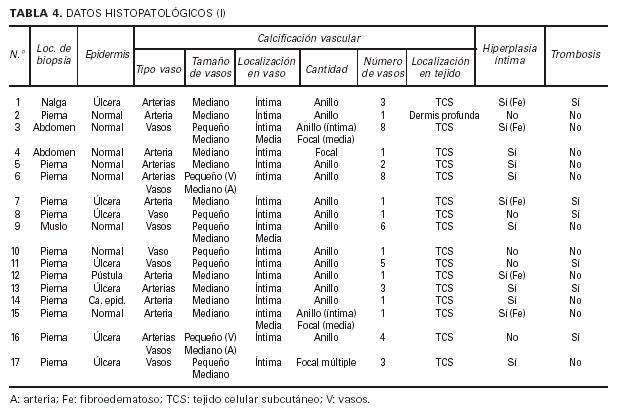
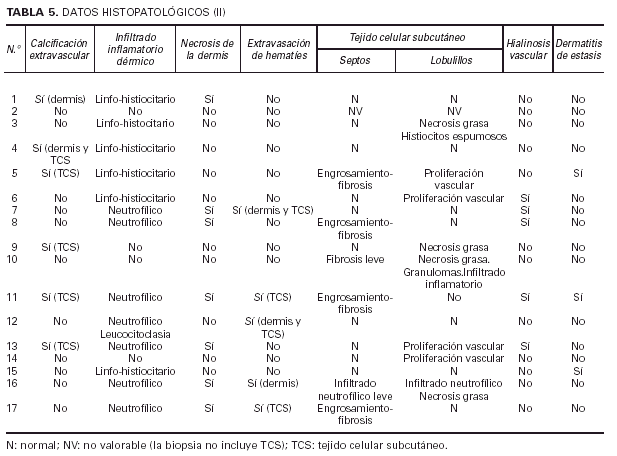
El estudio histológico se llevó a cabo en biopsias incluidas en parafina, mediante la tinción con hematoxilina-eosina, realizando numerosos cortes de las piezas. Se valoraron las siguientes variables: número, tamaño y localización de los vasos calcificados; distribución de la calcificación dentro de los vasos; alteraciones en la capa íntima vascular; presencia/ausencia de trombosis, calcificación estravascular, infiltrado inflamatorio, necrosis dérmica y extravasación de hematíes; alteraciones en la epidermis y tejido celular subcutáneo; presencia/ausencia de hialinosis vascular y hallazgos de dermatitis de estasis. En ocasiones se utilizó la tinción de Von Kossa para confirmar la naturaleza cálcica de los depósitos y tinción de Van Gieson para facilitar la identificación de la naturaleza de los vasos calcificados.
RESULTADOS (tablas 1-5)
Se incluyen 17 pacientes (12 mujeres y 5 hombres) con edades comprendidas entre los 33 y los 90 años (media: 70, 1 años), lo que refleja un grupo de población de edad avanzada.
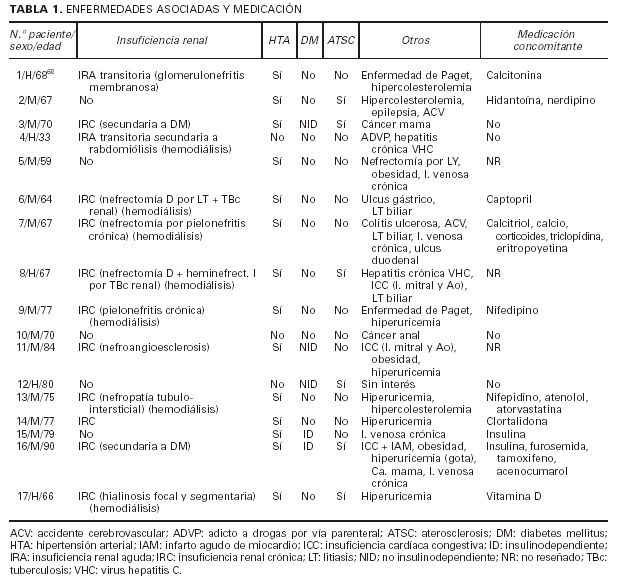
Enfermedades asociadas y medicación concomitante
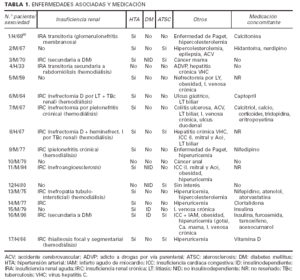
Una de las enfermedades asociadas más frecuentes fue, sin duda, la insuficiencia renal (IR). Estaba presente en doce de los pacientes, predominando las formas crónicas sobre las agudas y transitorias (dos pacientes). Las causas eran muy variadas, así como la severidad, desde insuficiencias leves hasta situaciones terminales. Siete de ellos se encontraban en programas de hemodiálisis cuando se realizó el diagnóstico de CVC, la mayor parte desde hacía varios años (tabla 1). Catorce pa-cientes estaban diagnosticados de hipertensión arterial (HTA), entre los que se incluyen once asociados a insu-ficiencia renal, sin que se pueda determinar claramente si la HTA era causa o efecto de la IR. Cinco pacientes padecían una diabetes mellitus (DM) de larga evolución, frecuentemente con complicaciones de la microcirculación como retinopatía o neuropatía. En dos de ellos la DM era el origen de la insuficiencia renal. Seis pacientes de la serie presentaban signos y/o síntomas inequívocos de aterosclerosis (ATSC) como claudicación intermitente u obstrucción de troncos arteriales con técnicas arteriográficas o ecográficas. El resto de las enfermedades asociadas era muy diverso patogénicamente. De la misma manera, la medicación concomitante al diagnóstico de CVC que estaban recibiendo los pacientes era muy variada, sin que destacasen de forma particular aquellos fármacos relacionados de alguna manera con el desencadenamiento de fenómenos de CFX.
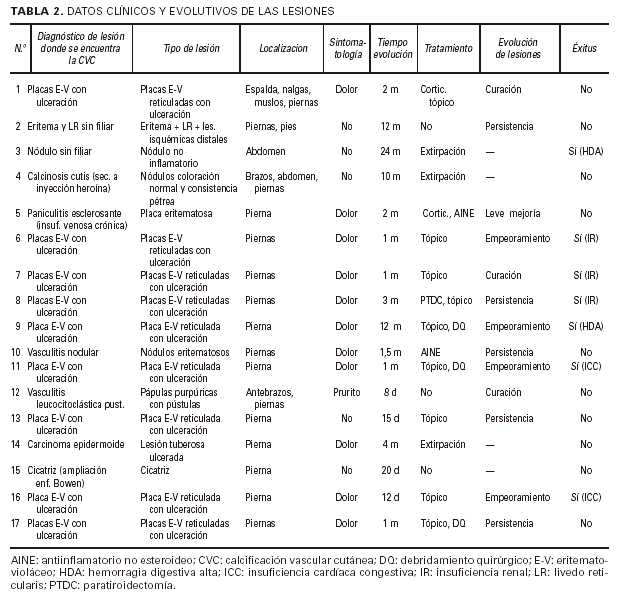
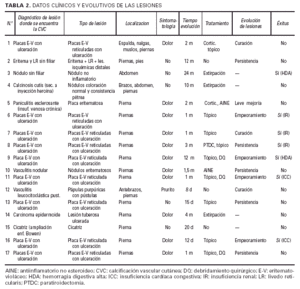
Datos clínicos y evolutivos de las lesiones(tabla 2 y figs. 1-5)
Teniendo en cuenta el diagnóstico de las lesiones en las que se encontró la CVC, los pacientes podrían incluirse básicamente en dos grupos. Aquellos que presentaban una enfermedad de diagnóstico bien definido (calcinosis cutis secundaria a inyecciones, paniculitis esclerosante en el contexto de una insufiencia venosa crónica, vasculitis nodular, vasculitis leucocitoclástica, carcinoma epidermoide y cicatriz), en los que la CVC pudiera interpretarse como un hallazgo incidental, un epifenómeno; y un amplio número de pacientes (nueve) con placas eritemato-violáceas ulceradas, todos ellos asociados a IR aguda o crónica, que clásicamente se han incluido en la clínica relativamente característica de la denominada CFX. A estos dos gruposprincipales habría que añadir dos pacientes (casos 2 y 3) con lesiones no claramente filiadas en las que la CVC también parece un fenómeno circunstancial (tabla 2).
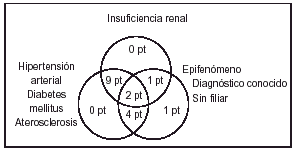
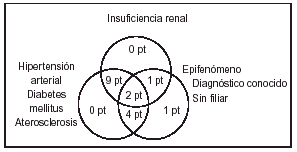
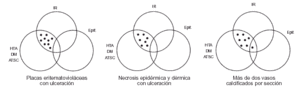
Basándonos en las enfermedades asociadas y el diagnóstico de las lesiones en las que aparece la CVC podríamos hacer un diagrama que viene a demostrar la imbricación de los diferentes parámetros y que sugeriría una patogenia multifactorial en la aparición de la mayoría de los fenómenos de calcificación parietal vascular cutánea (fig. 1).
FIG. 1.--Diagrama que refleja la patogenia multifactorial de la mayoría de los fenómenos de calcificación vascular cutánea.
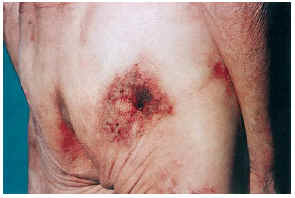
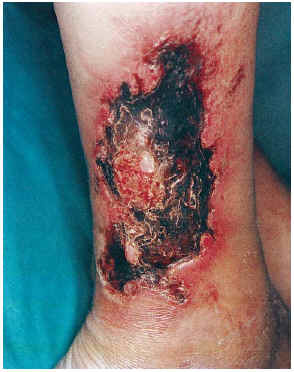
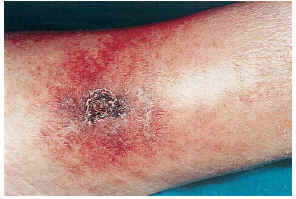
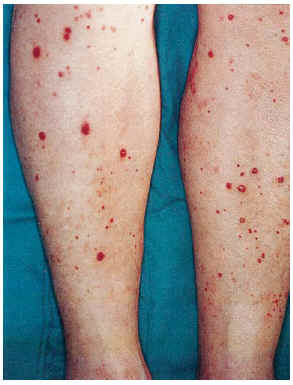
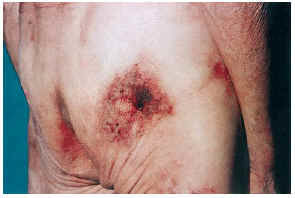
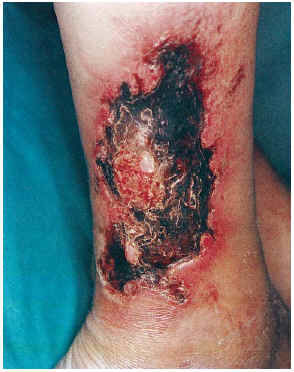
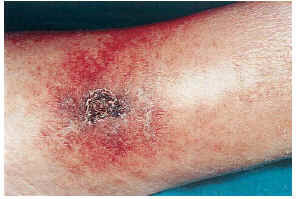
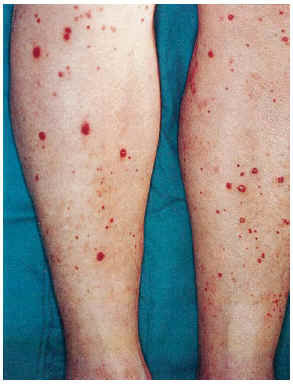
El cuadro clínico de las lesiones en las cuales se detectó la CVC era dependiente de los grupos anteriormente citados (figs. 2, 3, 4 y 5). En aquellos casos en los que el diagnóstico era conocido, la clínica obedecía a la enfermedad correspondiente, por ejemplo, nódulos eritematosos en piernas en la vasculitis nodular (caso 10), lesiones papulosas purpúricas con pústula central en la vasculitis leucocitoclástica pustulosa (caso 12) o lesión tubero-costrosa en el caso de un carcinoma epidermoide (caso 14), con la particularidad de que la mayoría se localizaban en piernas. En el segundo grupo, relacionados con IR, se trataba de placas o nódulos eritematosos que rápidamente adquirían un tinte violáceo, purpúrico, de aspecto reticulado, que evolucionaban hacia la necrosis central, dejando úlceras persistentes con poca tendencia a la curación, en su gran mayoría bastante o muy dolorosas (fig. 6). Se localizaban de forma claramente predominante en las piernas, especialmente en el tercio distal, aunque en ocasiones podían llegar a ser diseminadas (caso 1). Eran lesiones únicas o múltiples y uni o bilaterales.
FIG. 2.--Paciente con insuficiencia renal aguda, hipertensión arterial y enfermedad de Paget. Placas eritomato-violáceas de aspecto reticulado con necrosis (caso 1).
FIG. 3.--Paciente con insuficiencia renal crónica en hemodiálisis, hipertensión arterial y aterosclerosis. Úlcera necrótica en tercio inferior de pierna (caso 8).
FIG. 4.--Paciente con insuficiencia renal crónica en hemodiálisis e hipertensión arterial. Placa pretibial con eritema reticulado y ulceración (caso 13).
FIG. 5.--Paciente con vasculitis leucocitoclástica pustulosa en extremidades inferiores, diabetes mellitus y aterosclerosis (caso 12).
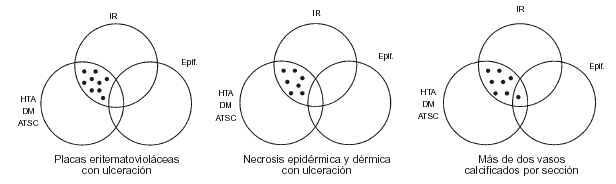
FIG. 6.--IR: insuficiencia renal; Epif: epifenómeno; HTA: hipertensión arterial; DM: diabetes mellitus; ATSC: aterosclerosis.
Los tratamientos realizados eran los correspondientes a la enfermedad de base y generalmente tópicos en el caso de las ulceraciones (antibióticos, debridantes, apósitos hidrocoloides, etc.). Cuando el componente necrótico era muy marcado, se realizó debridamiento quirúrgico. La evolución de las lesiones fue muy variable. Las placas eritemato-violáceas reticuladas con ulceración tendían a la cronicidad, en ocasiones con progresión de las úlceras, pero también tuvo lugar la curación de algunas de ellas (casos 1 y 7). Tras un período de seguimiento variable desde varios días (en caso de éxitus) hasta 9 años y medio (generalmente varios meses) tuvimos constancia del fallecimiento de siete pacientes, seis de ellos con la clínica citada de placas eritemato-violáceas y todos ellos con insufiencia renal crónica. Las causas de la muerte incluían hemorragia digestiva, agravamiento de la insuficiencia cardíaca congestiva y relacionadas de forma directa con la IR.
Datos de laboratorio y radiológicos
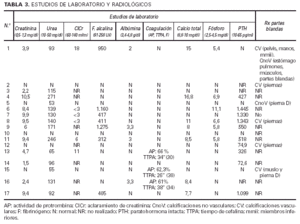
Los resultados de la creatinina (1,5-10,5 mg/dl), urea (53-271 mg/dl) y aclaramiento de creatinina (< 3-18 ml/min) se correlacionan, lógicamente, con los pacientes con insuficiencia renal, pero vienen a reflejar los diferentes grados de severidad. Alteraciones en el metabolismo fosfo-cálcico se demostraron en ocho pacientes (todos ellos diagnosticados de IR aguda o crónica) a través de determinaciones realizadas de forma simultánea al diagnóstico de CVC. Cuatro tenían hipocalcemia, tres hipercalcemia y seis hiperfosfatemia, probablemente directamente relacionadas con la alteración de la función renal. Sin embargo, conviene destacar que cuatro pacientes con IR crónica presentaban cifras normales del calcio y fósforo (es posible que en determinaciones llevadas a cabo en otros momentos tuvieran dichas cifras alteradas, habiéndose compensado con la terapéutica aplicada). Nueve de los diez pacientes con IR a los que se determinó la paratohormona en sangre presentaron un hiperparatiroidismo (cifras muy variables desde 72,6 a 1.445 pg/ml). Tan sólo un paciente con IR (aguda) tenía cifras normales de PTH. Como excepción, reseñar que un paciente con vasculitis leucocitoclástica (caso 12), sin evidencia de IR, mostró una PTH discretamente elevada que no podemos explicar (tabla 3).
Se realizaron estudios radiológicos de partes blandas en siete pacientes, demostrándose calcificaciones vasculares en cinco de ellos, indicadoras de afectación de vasos de grueso calibre muy por encima de los pequeños vasos calcificados encontrados en la piel, especialmente en las extremidades inferiores. De ellos, cuatro tenían HTA, tres aterosclerosis, dos diabetes mellitus y dos insuficiencia renal, factores que bien pudieran justificar los hallazgos radiológicos. En el caso 1 (IR aguda y enfermedad de Paget) también se demostraron calcificaciones viscerales (tabla 3).
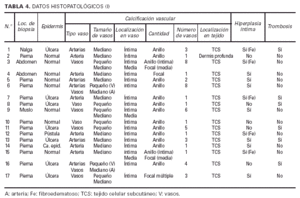
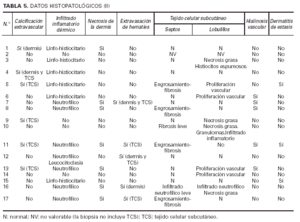
Datos histopatológicos (tablas 4 y 5 y figs. 7-10)
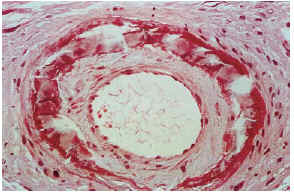
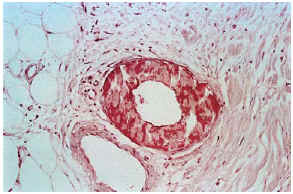
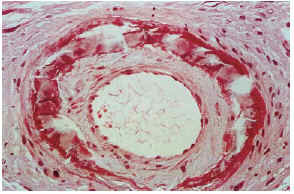
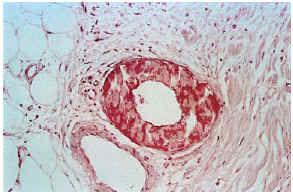
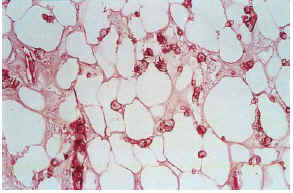
Las biopsias cutáneas que permitieron el hallazgo de calcificaciones vasculares se obtuvieron mayoritariamente de miembros inferiores, sobre todo de piernas. La calcificación en la pared vascular se observó generalmente en arterias de mediano calibre localiza-das en la porción más superficial del tejido celular subcutáneo. En ocasiones se veían afectados vasos cuya desestructuración, consecuencia de la calcificación, impedía determinar su naturaleza arterial o venosa. La calcificación se localizaba principalmente en la capa íntima. La mayor parte de las veces se trataba de un depósito concéntrico que rodeaba completamente la circunferencia del vaso, como un anillo. En algunos casos este anillo se localizaba en la porción de íntima más próxima a la capa media (subintimal); en otros ocupaba completamente todo el espesor de la íntima junto a una media bien definida y por último, en otros, junto a la calcificación completa de la íntima se veía una mínima capa media, prácticamente ausente (figs. 7, 8 y 9). Estos hallazgos sugieren una evolución cronológica en el sentido de la descripción previa. La capa media se encontraba calcificada en tres casos, generalmente de forma focal, siempre asociada a la calcificación intimal. Tras la seriación de las piezas el número medio de vasos calcificados por sección era muy variable, desde uno hasta ocho. Mientras que el tipo de vaso calcificado, tamaño del vaso, localización de la calcificación en la pared vascular, distribución de la calcificación y localización del vaso calcificado en el tejido no se corrrelacionaban con las enfermedades asociadas ni con el diagnóstico y clínica de las lesiones, sí existía una correspondencia con el número de vasos afectados, de tal manera que los ocho casos con más de dos vasos calcificados por sección tenían insuficiencia renal junto a HTA y/o DM y/o ATSC (fig. 6). Además siete de los ocho representaban placas eritemato-violáceas livedoides con necrosis y ulceración como expresión clínica de las lesiones. Con frecuencia se observaba hiperplasia de la íntima, en ocasiones de aspecto laxo, fibroedematoso, con grados variables de obliteración, nunca completa (tabla 4).
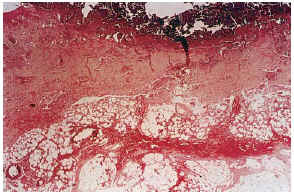
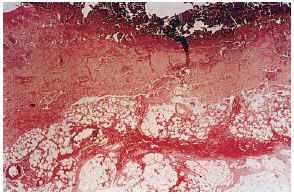
FIG. 7.--Úlcera superficial con hemorragia en el tejido celular subcutáneo. Vasos calcificados en el ángulo inferior izquierdo (caso 17).
FIG. 8.--Arteria con engrosamiento fibroedematoso intimal, calcificación concéntrica y capa media adelgazada (caso 15).
FIG. 9.--Calcificación vascular en anillo que ocupa la mayor parte del espesor parietal (caso 3).
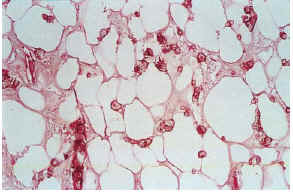
La epidermis reflejaba los datos apreciados en la clínica (necrosis y ulceración en los casos ulcerados, pústula intraepidérmica en la vasculitis pustulosa, carcinoma epidermoide, etc.). Los casos ulcerados se acompañaban de necrosis dérmica. Fenómenos de trombosis (seis casos) y la presencia de un infiltrado inflamatorio en la dermis, agudo (predominio neutrofílico) o crónico (predominio linfo-histiocitario) se observaban en las proximidades de la úlcera y necrosis dérmica. Ninguno de los vasos calcificados se asociaba con trombosis en su luz ni con infiltrado en la pared o alrededor. En el paciente con la vasculitis (caso 12), los vasos con necrosis fibrinoide y leucocitoclasia se localizaban en la dermis, lejos del único vaso calcificado en el panículo, lo que sugiere una presencia incidental (fig. 10). En seis pacientes se observaron focos de calcificación extravascular en la dermis y/o tejido celular subcutáneo. Excepto el paciente con CC secundaria a inyecciones (caso 4) y la paciente con paniculitis esclerosante (caso 5), el resto se correspondía con placas eritemato-violáceas ulceradas, no existiendo una correlación clara con alteraciones del metabolismo fosfo-cálcico.
FIG. 10.--Múltiples calcificaciones extravasculares en el tejido celular subcutáneo (caso 9).
El tejido celular subcutáneo, donde se asentaban los vasos calcificados, se veía frecuentemente afectado, pero de manera muy leve. Se podían observar fenómenos de fibrosis con ensanchamiento de los septos, necrosis grasa o proliferación vascular de tipo capilar en los lobulillos. Sin embargo, excepto en las pacientes con paniculitis esclerosante (caso 5) y vasculitis nodular (caso 10) no existía una correlación clínico-histológica evidente. Los fenómenos de hialinosis en la pared vascular aparecían en pacientes con HTA y/o DM, pero no coincidían con los vasos que presentaban calcificación vascular (tabla 5).
DISCUSION
La calcificación de la pared de los vasos cutáneos es un hecho poco descrito en la literatura. Generalmente se trata de casos aislados o series relativamente cortas8, 10, 12-18. Quizá ésta sea la causa de que exista una evidente ambigüedad sobre lo que significa y cómo interpretar este hallazgo. La falta de unanimidad en la concepción nosológica de estos pacientes ha llevado a la asignación de numerosas denominaciones, generalmente descriptivas, que definen correctamente a determinados subgrupos de pacientes, pero que excluyen a otros cuya semejanza con los anteriores es bien manifiesta. Es el caso de términos como «enfermedad urémica de pequeñas arterias»19, «paniculitis calcificante», «púrpura reticulada y necrótica», «síndrome de gangrena urémico»9, «síndrome de la necrosis cutánea-calcificación vascular»7, «enfermedad urémica de pequeñas arterias con calcificación medial e hiperplasia intimal»8, 20, «arteriolopatía calcificada urémica»10, 21, «arteriolas subcutáneas calcificadas con infartos en el tejido subcutáneo y piel»11, o el más extendido «calcifilaxia». Por ello nosotros preferimos emplear el término más genérico: «calcificación vascular cutánea» para describir un hallazgo histológico perfectamente definido que se acompaña de un amplio polimorfismo clínico.
La presencia de depósitos de calcio en la pared de los vasos, habitualmente identificada como calcifilaxia, y así denominaremos cuando hagamos referencia a la literatura, se ha relacionado de forma categórica con la insuficiencia renal terminal en pacientes generalmente sometidos a hemodiálisis22. Sin embargo, en los últimos años se han ido publicando casos con IR leve o moderada23, e incluso pacientes con diferentes patologías sin afectación de la función renal13, 24-28, viniendo a demostrar que la IR no es requisito indispensable para la aparición de este fenómeno29. También se han citado esporádicamente una mayor prevalencia de DM y ATSC14, 23, 30. El mecanismo por el cual se produciría la calcificación vascular, especialmente en los enfermos renales, correría a cargo de un hiperparatiroidismo secundario, y en ocasiones terciario, con alteraciones del metabolismo fosfo-cálcico8, 12, 31-35. Sin embargo, también recientemente se ha ido describiendo un número creciente de pacientes sin modificaciones en la PTH o el producto calcio/fósforo10, 15, 23, 26, 28. Por otra parte, la descripción de CVC como hecho incidental, acompañando a otras patologías, tan sólo ha sido referido de forma excepcional3. En nuestra serie, la más amplia de la literatura hasta la actualidad, son evidentes una serie de hechos: a) la enfermedad más frecuentemente asociada a CVC es la IR, tanto aguda transitoria como crónica, con diferentes grados de severidad; b)un número muy amplio de pacientes presenta HTA y/o DM y/o enfermedad ateromatosa; c) en un considerable número de pacientes, la CVC representa tan sólo un epifenómeno que acompaña a diferentes patologías de diagnóstico conocido. Sin embargo, ninguno de nuestros pacientes presenta una IR de forma exclusiva, sin combinar con los otros factores, y tan sólo en una paciente (con vasculitis nodular) la CVC aparece como un epifenómeno exclusivo. Todo ello nos lleva a pensar que probablemente se trate de un mecanismo multifactorial en el que la IR, junto a un trastorno del metabolismo fosfo-cálcico, precise de un sustrato previo de alteración en la microcirculación como la que tiene lugar en la HTA, DM y ATSC, que conllevaría el depósito de sales de calcio en la pared vascular. Igualmente, para que sea posible el hallazgo de CVC como epifenómeno en lesiones de diagnóstico conocido probablemente sea necesaria la combinación de otros factores (IR, HTA, DM, ATSC).
Otras variables como la edad (las alteraciones en la íntima relacionadas con la edad parecen ser independientes de la ATSC), obesidad, insuficiencia venosa crónica o la enfermedad de Paget, que presentaban algunos de nuestros pacientes, quizá también pudieran contribuir a los depósitos cálcicos.
La posibilidad de que estados de hipercoagulabilidad local o sistémica, asociados a deficiencias cuantitativas o funcionales de proteína C o S36-40, pudieran explicar fenómenos trombóticos en la CFX (en última instancia responsables de la isquemia y necrosis) se encuentra muy debatida, ya que los hallazgos iniciales de Mehta et al36 no han sido confirmados en algunos estudios posteriores41, 42. La mayoría de nuestros pacientes presentaban un estudio de coagulación normal, si bien no se determinó la proteína C o S. Además no hemos encontrado trombosis asociada a la calcificación vascular en los cortes histológicos. Probablemente el fenómeno obstructivo tenga lugar a un nivel más alto que el correspondiente a la circulación cutánea. La presencia de calcificaciones vasculares en los estudios radiológicos confirma el daño vascular en vasos de mayor calibre.
Desde el punto de vista clínico, el hecho más relevante en nuestra serie era la presencia de placas eritematosas que posteriormente adoptaban un tinte violáceo, purpúrico, de aspecto reticulado como paso previo a la necrosis y formación de úlceras dolorosas de evolución crónica en nueve de los pacientes. Se localizaban de forma preferente en el tercio distal de piernas. Esta expresión clínica, bien reflejada en la literatura29, 43-46, sólo se observó en pacientes con IR combinada a otros factores (HTA, DM, ATSC), lo que sugiere una cierta correlación entre este grupo de pacientes y una clínica relativamente bien definida. Además de las extremidades inferiores, otras zonas ocasionalmente afectadas son el abdomen y antebrazos. Hafner et al47 incluso afirman que la distribución tiene un valor pronóstico. Áreas inusuales incluyen las mamas y genitales19, 22, 46, 48. En el resto de nuestros pacientes la expresión clínica de las lesiones se correspondía con el diagnóstico etiológico (vasculitis leucocitoclástica, carcinoma epidermoide, etc.).
Histológicamente, en nuestra serie, los vasos calcificados eran sobre todo arterias de mediano tamaño localizadas en la porción más superficial del tejido celular subcutáneo (TCS). La calcificación se situaba en la íntima formando, en la mayoría de los pacientes, un anillo concéntrico (con diferentes patrones de depóstito) que, junto a la hiperplasia intimal, obliteraba en mayor o menor grado la luz vascular. Sin embargo, estos hallazgos, junto a la calcificación extravascular o los cambios septales o lobulillares del TCS eran comunes a los diferentes tipos clínicos. Tan sólo el número de vasos afectados, más de dos, y la necrosis epidérmica y dérmica con sus fenómenos asociados (trombosis e infiltración inflamatoria en la vecindad) mostraban una correlación evidente con el grupo de pacientes asociados a IR y clínica de placas eritemato-violáceas con ulceración. Una buena parte de nuestros hallazgos se corresponden con la literatura como la ausencia de relación entre el tamaño y densidad de los depósitos cálcicos y la clínica de las lesiones17, el tamaño de los vasos afectados o los fenómenos de hiperplasia intimal entre otros. No obstante, en determinadas publicaciones se hace referencia insistente a la localización predominante de la calcificación en la media, a la trombosis asociada a la calcificación y a la marcada paniculitis que acompaña a los vasos afectados17, 36, 39, 49, fenómenos escasamente representados en nuestra serie. Excepcionalmente se ha descrito la calcificación de la epidermis y los folículos pilosos50.
El análisis detallado de los datos clínicos e histopatológicos en nuestra serie nos permite, por tanto, afirmar que la separación de los pacientes en dos grandes grupos (aquéllos en los cuales la CVC representa simplemente un epifenómeno y aquéllos asociados a IR con/sin HTA/DM/ATSC) (fig. 1) se sustenta en un sustrato clínico-patológico (fig. 6).
Por otra parte, las características de nuestros pacientes hacen difícil su inclusión en las actuales clasificaciones de las CC. Entendiendo por CC el depósito de calcio en la piel, no existe en la literatura un criterio unánime a la hora de distinguir los diferentes tipos. Para un grupo de autores las CC se dividirían en distróficas, metastásicas e idiopáticas1, 51, 52. Otros, a estas tres formas principales añaden la CC yatrogé-nica53, 54, el nódulo calcificado subepidérmico55, 56 o la calcifilaxia57 como cuartas variedades. Además existen otras clasificaciones más peculiares como la de Farmer, que distingue CC localizadas y sistémicas (dividiendo esta última en CC metastásica asimétrica de tejidos blandos y CC de la media de pequeñas arterias)58, o de Weedon, que realiza una modificación de la clasificación histórica añadiéndole un sinnúmero de variantes poco frecuentes59. No obstante, existe unanimidad al considerar las CC distróficas como aquéllas secundarias a un tejido previamente dañado o degenerado (por ejemplo, cicatrices, pilomatrixoma, dermatomiositis, CREST), las CC metastásicas como aquéllas en las cuales el depósito de calcio se produce en un tejido normal de forma secundaria a un defecto subyacente del metabolismo del calcio y/o fósforo (por ejemplo, hiperparatiroidismo, sarcoidosis, insuficiencia renal crónica), y CC idiopáticas cuando no se conoce una enfermedad subyacente que justifique estos depósitos (por ejemplo, calcinosis tumoral, nódulo calcificado subepidérmico). En estas tres formas clínicas principales, los depósitos cutáneos se producen básicamente en el intersticio de la dermis y TCS. Algunos autores realizan pequeños apuntes para incluir, entre otras muchas enfermedades, algunos casos con calcificación vascular (que con frecuencia denominan calcifilaxia) en el grupo de las CC metastásicas1, 52-56. Por otra parte, McKee y Black et al distinguen dentro de las CC metastásicas formas hipercalcémicas y normocalcémicas, considerando que estas últimas son secundarias a hiperfosfatemia1, 51. Siguiendo esta forma de clasificación de las CC, el grupo al que nuestros pacientes quedarían más próximos sería el de la CC metastásica. Sin embargo, en este grupo el criterio fundamental es la existencia de una alteración metabólica del calcio y/o fósforo (al menos no demostrada en nueve de nuestros pacientes), y además el depósito se produce principalmente a nivel intersticial (presente en tan sólo seis de ellos). Por tanto, proponemos una nueva clasificación de las CC que incluiría:
--CC vascular. Definida por el depósito de calcio en la pared de los vasos cutáneos. Incluiría aquellos casos en los que la calcificación representa un epifenómeno y los asociados a IR con/sin alteraciones del metabolismo fosfo-cálcico.
--CC extravascular. Definida por el depósito de calcio a nivel extravascular, generalmente intersticial (excepcionalmente epitelial) de la que se distinguirían tres formas: a) distrófica (secundaria a un tejido previamente dañado);b) metastásica (secundaria a alteraciones fosfo-cálcicas), y c) idiopática (causa no conocida).
Consideramos que esta nueva clasificación da cabida a todos los pacientes con cualquier tipo de calcificación, independientemente de la causa.
CONCLUSIONES
En base al estudio de 17 pacientes con calcificación de los vasos a nivel cutáneo podemos concluir:
--Diferencias clínico-patológicas permiten distinguir dos grupos principales de pacientes: uno en el que la CVC representa un epifenómeno a diferentes enfermedades de diagnóstico conocido, y otro asociado a insuficiencia renal.
--El mecanismo por el cual se produce la CVC es probablemente multifactorial, pudiendo participar la insuficiencia renal (verosímilmente a través de una alteración en el metabolismo fosfo-cálcico) y diferentes enfermedades cutáneas a nivel local, precisando, generalmente, un sustrato previo de alteración en la microcirculación como la que tiene lugar en la hipertensión arterial, diabetes mellitus y aterosclerosis.
--Proponemos una nueva clasificación de las calcinosis cutis que permite la inclusión adecuada de todos los pacientes con depósitos de calcio a nivel cutáneo. Incluye la CC vascular y la CC extravascular (con tres formas: distrófica, metastásica e idiopática).
* Este trabajo obtuvo el accésit del Premio Ernest Schering 2001.