El carcinoma basocelular supone el cáncer de piel más frecuente en la población. Hay una gran variabilidad en su manejo y las diferentes guías extranjeras que existen son difícilmente aplicables en nuestro medio. El objetivo de la presente guía es servir de referencia a los dermatólogos españoles para mejorar el manejo de este tumor basándose en la evidencia actual.
Materiales y métodosSe escogió a miembros del Grupo Español de Dermato-Oncología y Cirugía (GEDOC) con experiencia en el tratamiento de estos tumores y con interés en participar en la elaboración de la guía. Se hizo una adaptación de las guías de práctica clínica existentes mediante el método ADAPTE, se resumió el proceso de atención, y se elaboraron las preguntas clínicas relevantes. Se seleccionaron las guías mejor puntuadas mediante el instrumento AGREEII, realizando la búsqueda de las respuestas en dichas guías y elaborando posteriormente las recomendaciones. Finalmente se sometió la guía a revisión externa.
ResultadosLas guías con mejor puntuación fueron las de la British Association of Dermatologits (BAD), del National Comprehensive Cancer Network (NCCN), del European Dermatology Forum (EDF) y de la European Academy of Dermatology and Venereology (EADV). Se obtuvieron en total 11 preguntas clínicas, contestadas a partir de estas guías.
ConclusionesEsta guía responde a preguntas habituales sobre el manejo del carcinoma basocelular en la práctica clínica diaria y sirve a los dermatólogos como referencia en la toma de decisiones, siempre teniendo en cuenta los recursos y las preferencias del paciente.
Basal cell carcinoma (BCC) is the most common skin cancer in the general population. BCC is managed in a variety of ways, and available international guidelines are difficult to put into practice in Spain. This guideline aims to improve the management of BCC based on current evidence and provide a point of reference for Spanish dermatologists.
Material and methodsMembers of the Spanish Oncologic Dermatology and Surgery Group (GEDOC) with experience treating BCC were invited to participate in drafting this guideline. The drafters used the ADAPTE collaboration process to develop the new guideline based on existing ones, first summarizing the care pathway and posing relevant clinical questions. They then searched for guidelines, assessed them with the AGREEII (Appraisal of Guidelines for Research and Evaluation) tool, and searched the selected guidelines for answers to the clinical questions. Finally, the recommendations were drafted and submitted for external review.
ResultsThe highest-scoring guidelines were from the Association of Dermatologists, the National Comprehensive Cancer Network, the European Dermatology Forum, and the European Academy of Dermatology and Venereology. A total of 11 clinical questions were answered.
ConclusionsThis new guideline answers the working group's clinical questions about the routine management of BCC in Spain. It provides dermatologists with a tool they can use for decision-making while taking into consideration the resources available and patient preferences.
Los tumores cutáneos son muy frecuentes en nuestro medio. La incidencia del carcinoma basocelular es de 253,23 tumores (IC95%: 273,01-69,45)/100.000 personas-año y es posible que esté aumentando1. El carcinoma basocelular constituye el 80-90% de todos los cánceres cutáneos y es el tumor más frecuente en humanos. Ocasiona importante repercusión en la calidad de vida, con morbilidad funcional y estética, y supone una importante carga de trabajo para los dermatólogos y el sistema de salud2. Existen numerosas alternativas terapéuticas para el carcinoma basocelular, algunas de ellas nuevas, con variabilidad en la práctica clínica y con grandes diferencias de coste según el tratamiento aplicado. Estos factores hacen más compleja la toma de decisiones clínicas.
Existen guías de práctica clínica (GPC) para el cuidado del carcinoma basocelular, pero en contextos diferentes y con una cobertura parcial de los problemas que los dermatólogos han identificado como principales.
Por ello, la Fundación Piel Sana de la Academia Española de Dermatología y Venereología (AEDV) ha impulsado la adaptación de GPC sobre los principales tumores cutáneos, formando parte del proyecto Libro Blanco del Cáncer Cutáneo.
El objetivo de esta guía es adaptar a nuestro medio un conjunto de recomendaciones, basadas en la mejor evidencia posible, que ayuden en la toma de decisiones en el manejo de los pacientes con carcinoma basocelular.
Material y métodosAl existir GPC previas, se optó por adaptarlas, empleando el método ADAPTE. El resumen de los pasos empleados está disponible como material suplementario3,4 (material suplementario, apartado 1).
Los paneles se seleccionaron atendiendo a la experiencia en el tratamiento de estos tumores y en el interés en participar en la GPC entre los miembros del Grupo Español de Dermato-Oncología y Cirugía (GEDOC) de la AEDV. Todos los panelistas declararon sus conflictos de intereses antes de iniciar su participación.
En el documento de alcance y objetivos se estableció como objetivo de la guía aportar indicaciones sobre aspectos controvertidos del diagnóstico, los tratamientos médicos y quirúrgicos y el seguimiento de estos pacientes (material suplementario, apartado 2). El ámbito asistencial de la GPC es la asistencia dermatológica en España, siendo los usuarios diana los dermatólogos. Se excluyeron del ámbito de la GPC la prevención del carcinoma basocelular y los pacientes con síndromes de tumores múltiples.
En los pasos siguientes, y siguiendo el método ADAPTE, se resumió el proceso de atención y se formularon preguntas clínicas relevantes para cada uno de los pasos del algoritmo (material suplementario, apartado 3). Las preguntas más relevantes se seleccionaron mediante consenso en una reunión presencial en la sede de la AEDV en octubre de 2016. Paralelamente las guías fueron buscadas en páginas web o en fuentes u organizaciones específicas y en las que se dedican a recopilarlas, elaborarlas o difundirlas, además de las principales academias de dermatología o cáncer (p.ej., National Guidelines Clearinghouse, Guidelines International Network, Guiasalud, Institute for Clinical Systems Improvement, NICE, New Zealand Guidelines Group, Scottish Guidelines Network, Cochrane Library, British Academy of Dermatology, American Academy of Dermatology, European Academy of Dermatology, National Comprehensive Cancer Network). Las guías fueron posteriormente revisadas y evaluadas por su calidad metodológica empleando el instrumento AGREEII5. Se seleccionaron para su consulta las GPC con mejores resultados.
A partir de esta información se generaron las recomendaciones. En ellas se mantuvo la referencia a la fuente original. Las extracciones, el nivel de evidencia y el grado de fuerza de la recomendación empleando los niveles del Centro de Medicina Basada en la Evidencia de Oxford se realizaron siempre por pares6.
Una vez finalizado el borrador, las recomendaciones se publicaron en la web de la AEDV (https://aedv.es/revision-de-las-recomendaciones-de-la-gpc-basocelular/) y se sometieron a revisión externa, siendo solicitada la revisión a todos los miembros de la AEDV, miembros del GEDOC, oncólogos e industria farmacéutica con interés en el tema. Las objeciones de los revisores fueron consideradas por los panelistas y, si se consideraron adecuadas, aplicadas a la GPC.
ResultadosLas guías con calidad más alta según las puntuaciones y cuyos objetivos estaban alineados con el alcance y objetivos plateados fueron cuatro: British Association of Dermatologists (BAD), National Comprehensive Cancer Network (NCCN), European Dermatology Forum (EDF) y European Academy of Dermatology and Venereology (EADV). La guía de la Agency for Healthcare Research and Quality (AHRQ) y la del National Institute for Health and Care Excellence (NICE), pese a tener puntuaciones altas de calidad, fueron descartadas por estar dirigidas a atención primaria u otros especialistas y no dar respuesta a las preguntas planteadas.
En los siguientes apartados se describen las preguntas clínicas planteadas y las recomendaciones de la GPC. El documento completo de la GPC, que incluye la discusión de cada pregunta, está disponible como material suplementario (material suplementario, apartado 4).
Apartado 1. Reintervención vs observación en carcinoma basocelular con márgenes afectosPregunta 1. En pacientes con carcinoma basocelular con afectación de bordes quirúrgicos ¿la reintervención quirúrgica comparada con la observación disminuye la probabilidad de recidiva?
Resumen de la evidenciaLa afectación de márgenes de exéresis se asocia a una mayor tasa de recurrencia tras la cirugía, sobre todo en tumores que afectan la región centrofacial, subtipos histológicos de alto riesgo (morfeiforme, micronodular, infiltrante) y cuando el margen afectado es el profundo7-14. Nivel de evidencia: 2a.
RecomendacionesSe recomienda volver a tratar los carcinomas basocelulares extirpados de manera incompleta, sobre todo si existe afectación de la zona media facial, si el margen profundo se encuentra afecto, si se han empleado colgajos locales o injertos en el cierre del defecto quirúrgico, o si el subtipo histológico es de alto riesgo. La modalidad terapéutica de elección es la cirugía convencional o la cirugía micrográfica de Mohs (especialmente indicada si se cumplen los supuestos previamente mencionados). Así mismo, podría valorarse la revisión clínica en tumores pequeños no agresivos localizados en el tronco. Fuerza de la recomendación: B.
Apartado 2. Radioterapia vs. reintervención en carcinoma basocelular con márgenes afectosPregunta 2. En pacientes con carcinoma basocelular con afectación de márgenes quirúrgicos ¿la radioterapia coadyuvante comparada con la reintervención quirúrgica disminuye la probabilidad de recidiva?
Resumen de la evidenciaNo existen estudios que comparen la reintervención con la radioterapia coadyuvante en carcinoma basocelular con afectación de márgenes quirúrgicos. Las guías recomiendan como primera opción la reintervención quirúrgica, reservándose la radioterapia para los pacientes no candidatos a cirugía (contraindicación, problemas quirúrgicos o rechazo por el paciente)15-18. Nivel de evidencia: 4.
RecomendacionesSe recomienda reservar la radioterapia para los pacientes con carcinoma basocelular con afectación de márgenes de exéresis no candidatos a reintervención quirúrgica. Fuerza de la recomendación: C.
Apartado 3. Cirugía vs tratamientos no quirúrgicos en carcinoma basocelular de bajo riesgoPregunta 3. En pacientes con carcinoma basocelular de bajo riesgo ¿los tratamientos no quirúrgicos comparados con la cirugía influyen en la probabilidad de recidiva?
Resumen de la evidenciaLas tasas de recidiva son menores con cirugía convencional frente a los tratamientos no quirúrgicos, por lo que estos tratamientos conservadores deberían reservarse para los casos no subsidiarios de cirugía19-21. La electrocoagulación y curetaje puede ser útil como tratamiento en carcinomas basocelulares de bajo riesgo, con menor porcentaje de persistencia tumoral en los carcinomas localizados en tronco y extremidades (nivel de evidencia: 4)22-26. Igualmente, la criocirugía puede ser una buena opción terapéutica en carcinomas basocelulares de bajo riesgo (nivel de evidencia: 3b)27-33. El tratamiento ablativo con láser CO2 y curetaje estaría especialmente indicado en carcinomas basocelulares de bajo riesgo cuando son de gran tamaño o múltiples (nivel de evidencia: 4)34. Imiquimod es útil en carcinomas basocelulares de bajo riesgo, fundamentalmente los superficiales, y en menor medida los nodulares (nivel de evidencia: 1b)35,36. Asimismo, la terapia fotodinámica resulta útil en carcinomas basocelulares superficiales, presentando mayor tasa de recidiva en carcinomas basocelulares nodulares (nivel de evidencia: 1b)37-42. El tratamiento con 5-fluorouracilo podría ser otra opción terapéutica, si bien no existe suficiente evidencia para apoyar su uso (nivel de evidencia: 4).
RecomendacionesLos tratamientos no quirúrgicos son una buena opción para el manejo del carcinoma basocelular de bajo riesgo cuando la cirugía no es posible (en la tabla 1 se resumen los criterios de riesgo). La electrocoagulación y curetaje es útil en tumores de bajo riesgo, sobre todo localizados en tronco y extremidades (fuerza de la recomendación: C). Igualmente la criocirugía se puede utilizar en carcinomas basocelulares de bajo riesgo (fuerza de la recomendación: B). El tratamiento con láser y curetaje se puede emplear en los casos de gran tamaño o cuando hay múltiples carcinomas (fuerza de la recomendación: C). Imiquimod es una buena opción terapéutica en carcinomas basocelulares superficiales (fuerza de la recomendación: A) y puede ser útil en los nodulares (fuerza de la recomendación: C). La terapia fotodinámica es igualmente útil en el tratamiento del carcinoma basocelular superficial (fuerza de la recomendación: A) y en menor medida en el nodular (fuerza de la recomendación: B). El uso de 5-fluorouracilo también podría ser útil en el tratamiento del carcinoma basocelular de bajo riesgo (fuerza de la recomendación: C).
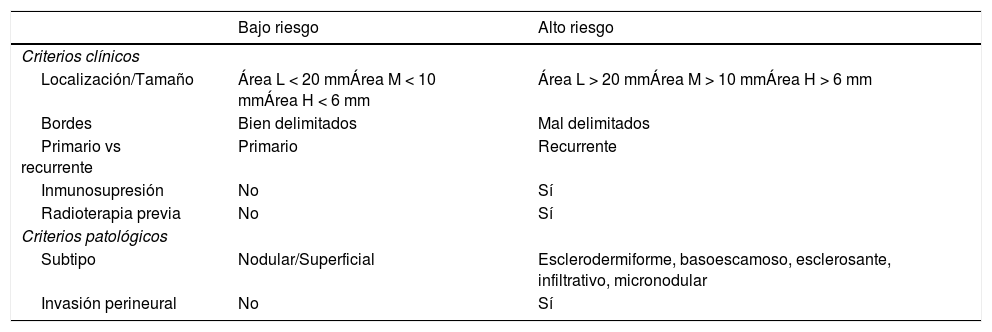
Criterios de riesgo
| Bajo riesgo | Alto riesgo | |
|---|---|---|
| Criterios clínicos | ||
| Localización/Tamaño | Área L < 20 mmÁrea M < 10 mmÁrea H < 6 mm | Área L > 20 mmÁrea M > 10 mmÁrea H > 6 mm |
| Bordes | Bien delimitados | Mal delimitados |
| Primario vs recurrente | Primario | Recurrente |
| Inmunosupresión | No | Sí |
| Radioterapia previa | No | Sí |
| Criterios patológicos | ||
| Subtipo | Nodular/Superficial | Esclerodermiforme, basoescamoso, esclerosante, infiltrativo, micronodular |
| Invasión perineural | No | Sí |
Área H: región centrofacial, párpados, cejas, piel periorbitaria, nariz, labios, mentón, mandibular, preauricular, retroauricular, pabellón auricular, sien, genitales, manos y pies. Área L: tronco y extremidades. Área M: mejillas, frente, cuero cabelludo y cuello.
Pregunta 4. En pacientes con carcinoma basocelular de alto riesgo ¿la cirugía de Mohs en comparación con la cirugía convencional disminuye la probabilidad de recidiva?
Resumen de la evidenciaLa cirugía micrográfica de Mohs tiene tasas de recurrencia menores que la cirugía convencional en tumores recurrentes (1b). Los datos en tumores primarios son más dudosos. La cirugía de Mohs estaría especialmente indicada en tumores de alto riesgo, sobre todo los localizados en región facial43-49. Nivel de evidencia: 1b.
RecomendacionesLa cirugía micrográfica de Mohs es el tratamiento más adecuado en los carcinomas basocelulares de alto riesgo, sobre todo los localizados en la región facial, y recurrentes. Fuerza de la recomendación: A.
Apartado 5. Riesgo asociado a la inmunosupresiónPregunta 5. En pacientes inmunodeprimidos con carcinoma basocelular de bajo riesgo ¿el tratamiento quirúrgico en comparación con el tratamiento no quirúrgico influye en la probabilidad de recidiva?
Resumen de la evidenciaNo existen datos concluyentes que nos permitan afirmar que los carcinomas basocelulares en pacientes inmunodeprimidos sean de mayor riesgo que en inmunocompetentes, ni hay estudios que comparen el tratamiento quirúrgico con el tratamiento conservador en estos pacientes. Sin embargo, en las guías de la British Association of Dermatology y del National Comprehensive Cancer Network la inmunosupresión se considera un factor de mal pronóstico por sí misma50-52. Nivel de evidencia: 5.
RecomendacionesEn pacientes inmunodeprimidos los carcinomas basocelulares podrían tener un carácter más agresivo, por lo que se recomienda como primera opción siempre la cirugía, relegando los tratamientos conservadores a los casos no subsidiarios de tratamiento quirúrgico. Fuerza de la recomendación: D.
Apartado 6. Vismodegib vs. radioterapia en carcinoma basocelular localmente avanzadoPregunta 6. En pacientes con carcinoma basocelular localmente avanzado ¿el tratamiento con vismodegib en comparación con la radioterapia produce alguna mejoría de la supervivencia global o supervivencia libre de enfermedad?
Resumen de la evidenciaNo existen estudios que comparen vismodegib con la radioterapia en el tratamiento del carcinoma basocelular localmente avanzado en cuanto a resultados en supervivencia (global o libre de enfermedad). Los ensayos clínicos de vismodegib recogen a pacientes con carcinoma basocelular que ya han sido tratados previamente con radioterapia o en los que se consideró la radioterapia como contraindicada o inapropiada (hipersensibilidad a radioterapia [p ej., síndrome de Golin], limitaciones por localización tumoral o dosis acumuladas de radioterapia previa)53-57. Nivel de evidencia: 5.
RecomendacionesVismodegib es un tratamiento eficaz en carcinomas basocelulares localmente avanzados o metastásicos. Su uso debe limitarse a aquellos casos en que el paciente no es candidato a cirugía, ya sea por inoperabilidad, por múltiples recurrencias o por morbilidad quirúrgica anticipada (mutilación mayor, defecto funcional y/o cosmético no tolerado por el paciente). Fuerza de la recomendación: D.
Apartado 7. Vismodegib en neoadyuvanciaPregunta 7. En pacientes con carcinoma basocelular localmente avanzado e inoperable por complejidad quirúrgica ¿el tratamiento neoadyuvante con vismodegib en comparación con la radioterapia permite un rescate quirúrgico, o una reducción del escalón de complejidad de la cirugía que haga viable la intervención?
Resumen de la evidenciaNo existen estudios que comparen vismodegib con radioterapia en términos de disminución de complejidad quirúrgica. Algunos estudios sugieren que vismodegib podría ser útil en neoadyuvancia, reduciendo el tamaño tumoral y permitiendo un rescate quirúrgico del tumor58-60. Nivel de evidencia: 4.
RecomendacionesLos casos de carcinoma basocelular localmente avanzado en los que resulte difícil el tratamiento quirúrgico del tumor, el tratamiento con vismodegib durante algunos meses podría disminuir el tamaño tumoral y permitir así un abordaje quirúrgico. Fuerza de la recomendación: C.
Apartado 8. Seguimiento protocolizado o a demanda para diagnóstico precoz de recidivaPregunta 8. En pacientes con carcinoma basocelular de alto riesgo ¿el seguimiento protocolizado en comparación con el seguimiento a demanda del paciente facilita un diagnóstico precoz en caso de recidiva?
Resumen de la evidenciaNo existen estudios que comparen el seguimiento protocolizado frente a las revisiones a demanda en pacientes con carcinoma basocelular de alto grado, ni se ha establecido consenso sobre la frecuencia, la periodicidad ni la duración total del tiempo de seguimiento. Sin embargo, en las diferentes guías se recomienda la vigilancia a largo plazo de estos pacientes (sobre todo en pacientes con lesiones recurrentes, múltiples y de alto riesgo), con revisiones cada 6-12meses durante los primeros 3-5años, pudiéndose espaciar posteriormente si no aparece otro tumor cutáneo en ese periodo. Idealmente, en algunas guías se recomiendan revisiones anuales de por vida61,62. Nivel de evidencia: 5.
RecomendacionesEn los pacientes con carcinoma basocelular de alto riesgo, lesiones recurrentes o múltiples se recomienda el seguimiento cada 6-12meses durante los primeros 3-5años, pudiéndose espaciar posteriormente. Fuerza de la recomendación: D.
Apartado 9. Seguimiento protocolizado vs. alta y seguimiento a demanda en carcinoma basocelular de bajo riesgoPregunta 9. En pacientes con carcinoma basocelular de bajo riesgo ¿el seguimiento protocolizado en comparación con el alta y seguimiento a demanda facilita un diagnóstico precoz en caso de recidiva?
Resumen de la evidenciaNo existen estudios que comparen el seguimiento protocolizado frente a las revisiones a demanda o el control anual en pacientes con carcinoma basocelular de bajo grado. El riesgo de recidiva en pacientes con carcinoma basocelular de bajo riesgo adecuadamente tratado es bajo. Sin embargo, los pacientes con carcinoma basocelular presentan un mayor riesgo de desarrollar nuevos tumores cutáneos, y este riesgo es mayor a corto plazo (nivel de evidencia: 2a). Por este motivo, lo ideal sería el seguimiento periódico de todos los pacientes con carcinoma basocelular al menos una vez al año (nivel de evidencia: 5)61-64.
RecomendacionesSe recomienda establecer al menos una visita de seguimiento para aconsejar al paciente sobre las medidas de fotoprotección, naturaleza del tumor y riesgo de que se desarrollen nuevas lesiones. Si fuera posible, se recomienda la vigilancia periódica anual en los pacientes con carcinoma basocelular de bajo riesgo. Fuerza de la recomendación: D.
Apartado 10. Seguimiento tras técnicas no quirúrgicas en carcinoma basocelular de bajo riesgoPregunta 10. En pacientes con carcinoma basocelular de bajo riesgo tratado con técnicas no quirúrgicas (electrocoagulación y curetaje, criocirugía, láser CO2, imiquimod, terapia fotodinámica o 5-fluorouracilo) ¿el seguimiento protocolizado en comparación con la consulta a demanda del paciente facilita un diagnóstico precoz en caso de recidiva?
Resumen de la evidenciaNo hay estudios que comparen el seguimiento protocolizado con la consulta a demanda del paciente en cuanto al diagnóstico precoz en caso de recidiva. Hay que tener en cuenta que los tratamientos no quirúrgicos se van a emplear fundamentalmente en carcinomas basocelulares de bajo riesgo, si bien estas modalidades terapéuticas presentan tasas de recurrencia mayores que la cirugía convencional65,66. Nivel de evidencia: 5
RecomendacionesAl no existir evidencia suficiente que respalde un protocolo de seguimiento en estos casos, extrapolaríamos las recomendaciones de seguimiento de los carcinomas basocelulares de bajo riesgo. Fuerza de la recomendación: D.
Apartado 11. Seguimiento de pacientes para la detección de nuevos carcinomasPregunta 11. En pacientes con diagnóstico previo de carcinoma basocelular ¿el seguimiento protocolizado en comparación con la consulta a criterio del paciente facilita un diagnóstico precoz en caso de nuevos carcinomas basocelulares?
Resumen de la evidenciaTodos los pacientes con carcinoma basocelular presentan un mayor riesgo de desarrollar nuevos carcinomas basocelulares, carcinomas epidermoides y melanoma, y este riesgo es mayor en los primeros 3-5 años (nivel de evidencia: 2a). El número de basocelulares previos es el mejor predictor de riesgo de nuevos basocelulares (nivel de evidencia: 1b). Por este motivo, algunos expertos recomiendan el seguimiento periódico de todos los pacientes con carcinoma basocelular al menos una vez al año (nivel de evidencia: 5)63,67-80.
RecomendacionesSe recomienda establecer al menos una visita de seguimiento para aconsejar al paciente sobre medidas de fotoprotección, explicar el riesgo de que se desarrollen nuevas lesiones y la importancia de la autovigilancia. Si el sistema de salud lo permite, se recomienda la vigilancia periódica en los pacientes con carcinoma basocelular, con una periodicidad al menos anual. Fuerza de la recomendación: D.
DiscusiónLa GPC adaptada a partir de otras guías recientes nos ofrece una ayuda para la toma de decisiones en el ámbito dermato-oncológico.
Las ventajas principales de este estudio es haber utilizado un método reproducible y estricto, haber aplicado los hallazgos a nuestro entorno y haber sido revisada antes de su publicación por revisores multidisciplinares.
Podría considerarse una limitación el hecho de que los panelistas de la guía sean todos dermatólogos. Lo hemos hecho así porque el documento de objetivos limitaba la GPC al uso dermatológico, las GPC originales son multidisciplinares y los borradores de la GPC se han sometido a revisión externa multidisciplinar.
El mantenimiento de la vigencia de las recomendaciones exige una revisión del contenido en los próximos 3años.
Como en cualquier guía, estas recomendaciones no son de obligado cumplimiento, sino que deben aplicarse de forma flexible, atendiendo a la disponibilidad local de recursos, a la experiencia del médico y a las preferencias del paciente.
FinanciaciónEl libro blanco del cáncer de la AEDV ha sido financiado íntegramente por la Fundación Piel Sana AEDV. En su elaboración no han participado empresas externas ni la industria farmacéutica (salvo en la posibilidad de hacer una revisión externa [Roche Pharma] como otras partes interesadas).
Conflicto de interesesA. Ruiz-de-Casas y P. Redondo-Bellón han impartido charlas remuneradas para laboratorios Roche. I. Palacios-Álvarez ha impartido charlas renumeradas para laboratorios Roche e IFC. El resto de autores declaran no tener ningún conflicto de intereses.
La presente guía forma parte del Libro Blanco del Cáncer Cutáneo de la Fundación Piel Sana de la AEDV.