El carcinoma epidermoide cutáneo, con una incidencia en la población general de aproximadamente un 10% a lo largo de la vida, es la segunda neoplasia más frecuente dentro del grupo del cáncer cutáneo no melanoma.
La mayoría de los carcinomas epidermoides cutáneos muestran un comportamiento benigno y pueden ser completamente erradicados mediante cirugía y otros procedimientos dermatológicos. Sin embargo, existe un subgrupo de esta entidad que se asocia con una mayor capacidad de desarrollar metástasis nodal y, por tanto, con una elevada morbimortalidad.
En el presente artículo se analizan los diferentes factores que definen al carcinoma epidermoide cutáneo de comportamiento agresivo. Proponemos un método de definición del carcinoma epidermoide de alto riesgo basado en el establecimiento de una serie de criterios mayores y menores. Este hecho supondrá una mejor evaluación pronóstica y un manejo personalizado de este grupo de enfermos, que puede resultar en un aumento de la supervivencia global.
With a lifetime incidence of approximately 10% in the general population, cutaneous squamous cell carcinoma (CSCC) is the second most common type of nonmelanoma skin cancer.
Most CSCCs are benign and can be completely eradicated by surgery or other dermatological procedures. There is, however, a subgroup associated with an increased likelihood of lymph node metastases and, therefore, with high morbidity and mortality.
This article analyzes the various factors that define aggressive CSCC. We propose a method for defining high-risk SCC on the basis of a series of major and minor criteria. This method will allow better prognostic evaluation and enable personalized management of patients with high-risk SCC, possibly leading to improved overall survival.
El carcinoma epidermoide cutáneo (CEC), con una incidencia a lo largo de la vida de entre un 7 y un 11%, es la segunda neoplasia más frecuente dentro del grupo del cáncer cutáneo no melanoma (CCNM) representando entre el 20 y el 25% de los casos, solo por detrás del carcinoma basocelular1–5.
La mayoría de los CEC muestran un comportamiento benigno y pueden ser completamente erradicados mediante cirugía y otros procedimientos dermatológicos. Esto se traduce en una supervivencia global a 5 años tras resección del CEC superior al 90%5, y una tasa de mortalidad de aproximadamente el 1%6. Sin embargo, existe un subgrupo de CEC que se asocia con una mayor capacidad de desarrollar metástasis nodal y con una elevada morbimortalidad (figs. 1–6)7–10.
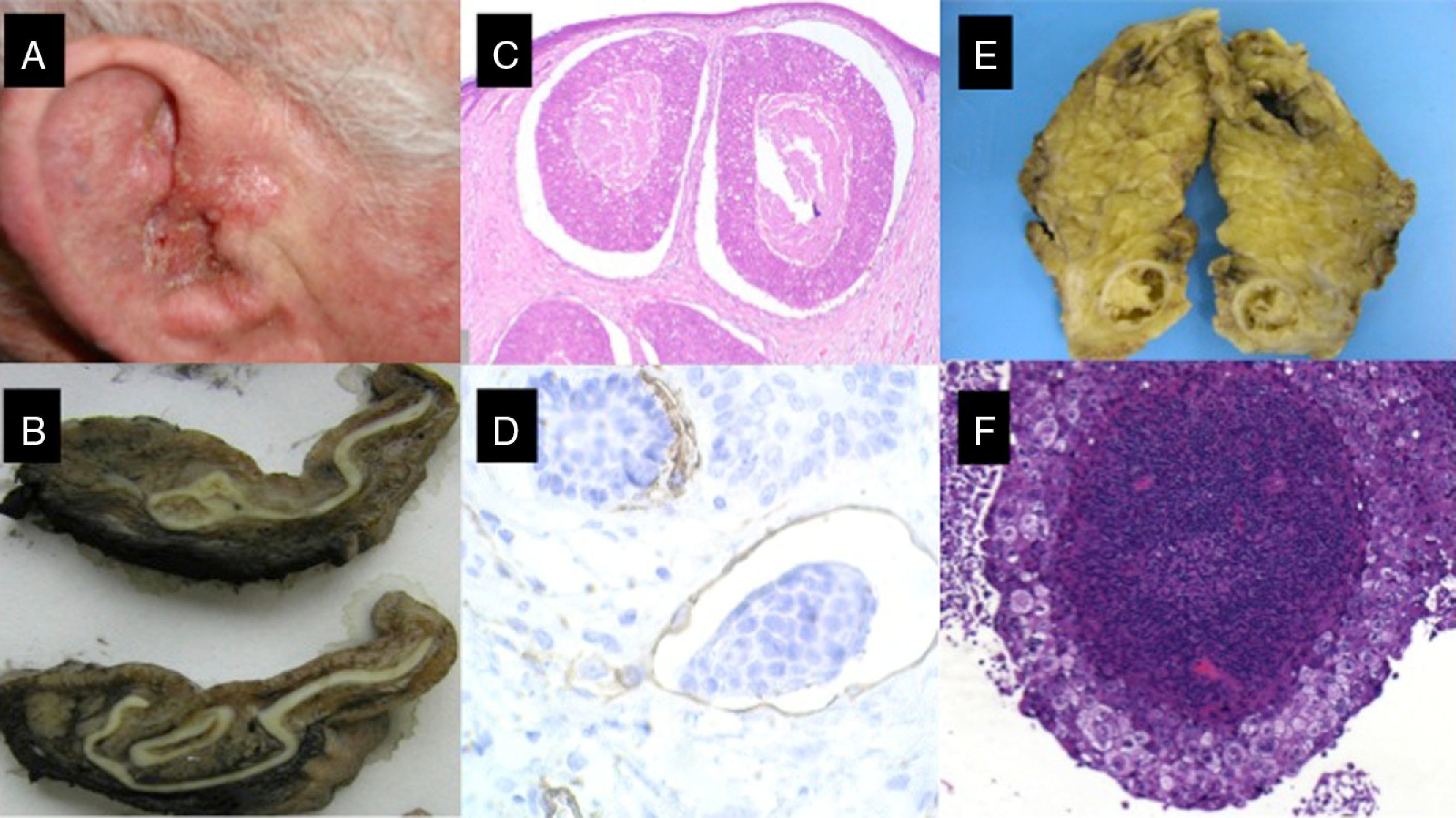
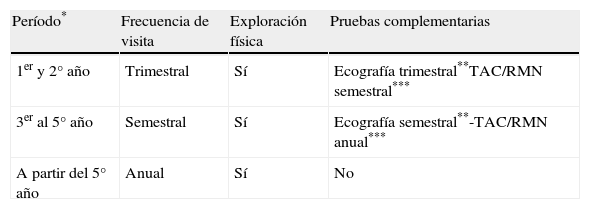
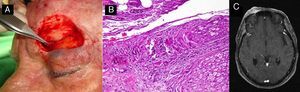
A. Paciente de 70 años con carcinoma epidermoide cutáneo en el pabellón auricular. B. Tumoración carnosa que infiltra el conducto auricular externo. C y D. Histológicamente se caracteriza por una tumoración de células escamosas mal diferenciado con invasión linfovascular (B: hematoxilina-eosina x40; C: Inmunotinción CD31×100) E. Glándula parótida que presenta una tumoración nodular. F. La tumoración parotídea está formada por una proliferación de células escamosas mal diferenciadas, siguiendo un patrón similar a la tumoración primaria (hematoxilina-eosina, x40).
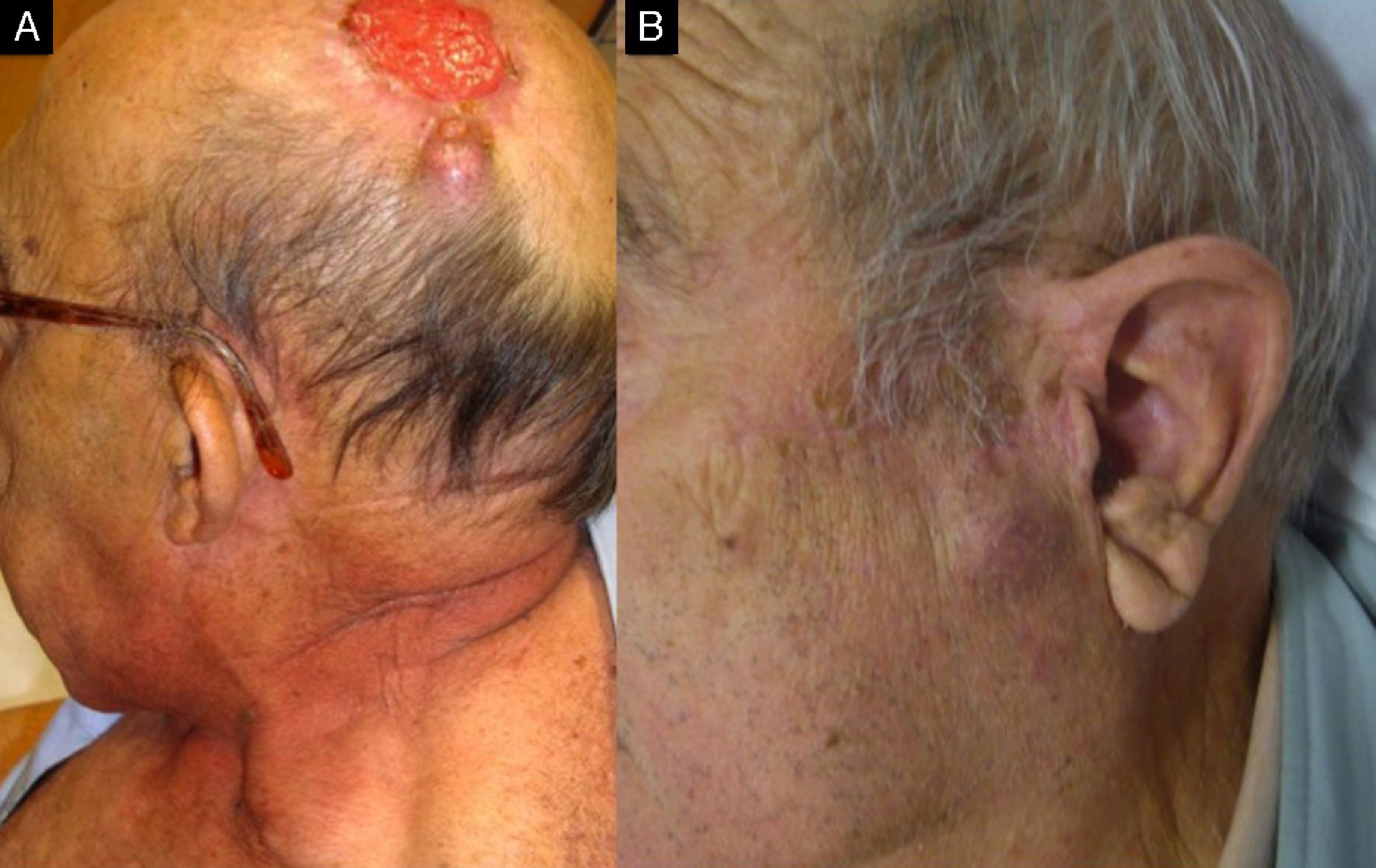
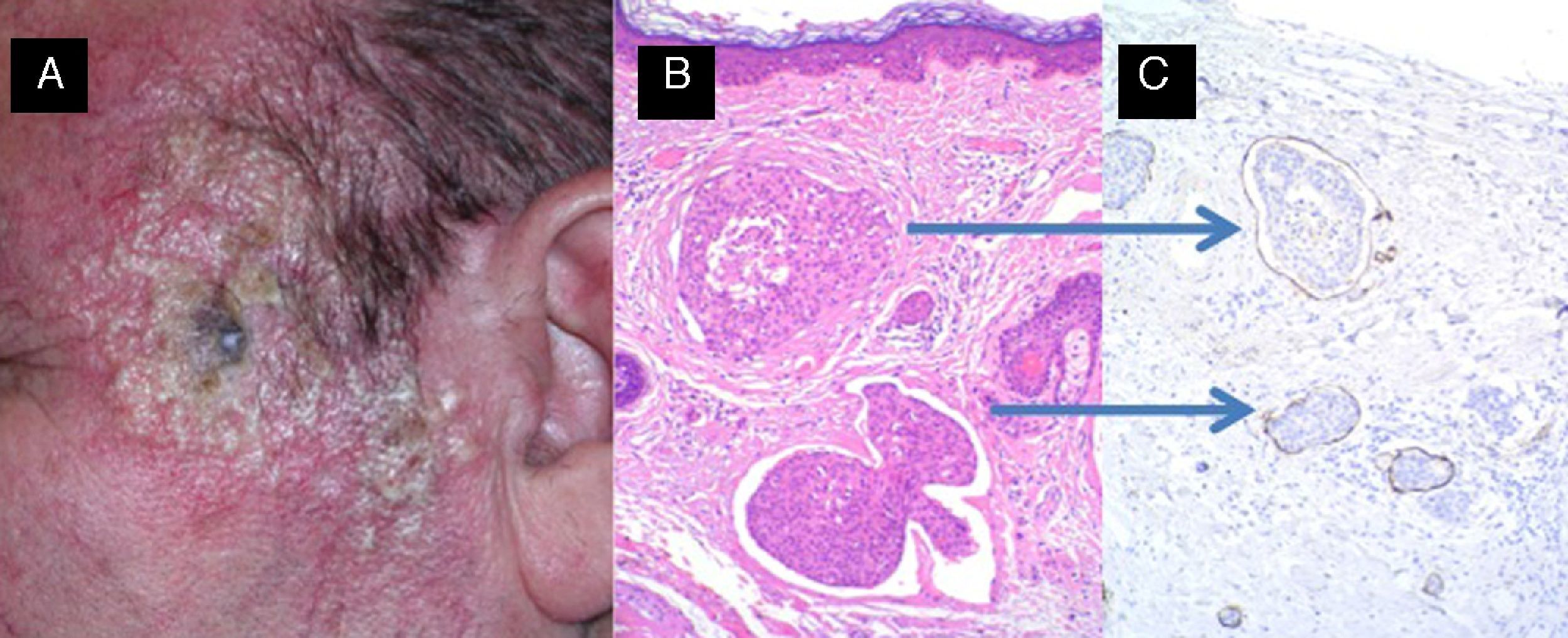
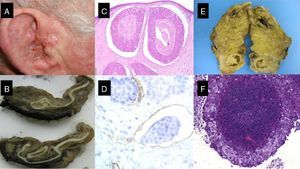
A y B. Dos pacientes, de 67 y 69 años respectivamente, tratados de carcinomas epidermoides cutáneos «de alto riesgo» localizados en el cuero cabelludo (A) y en la sien (B), que en el segundo año de seguimiento desarrollan infiltración adenopática en los ganglios de las cadenas cervicales superiores.
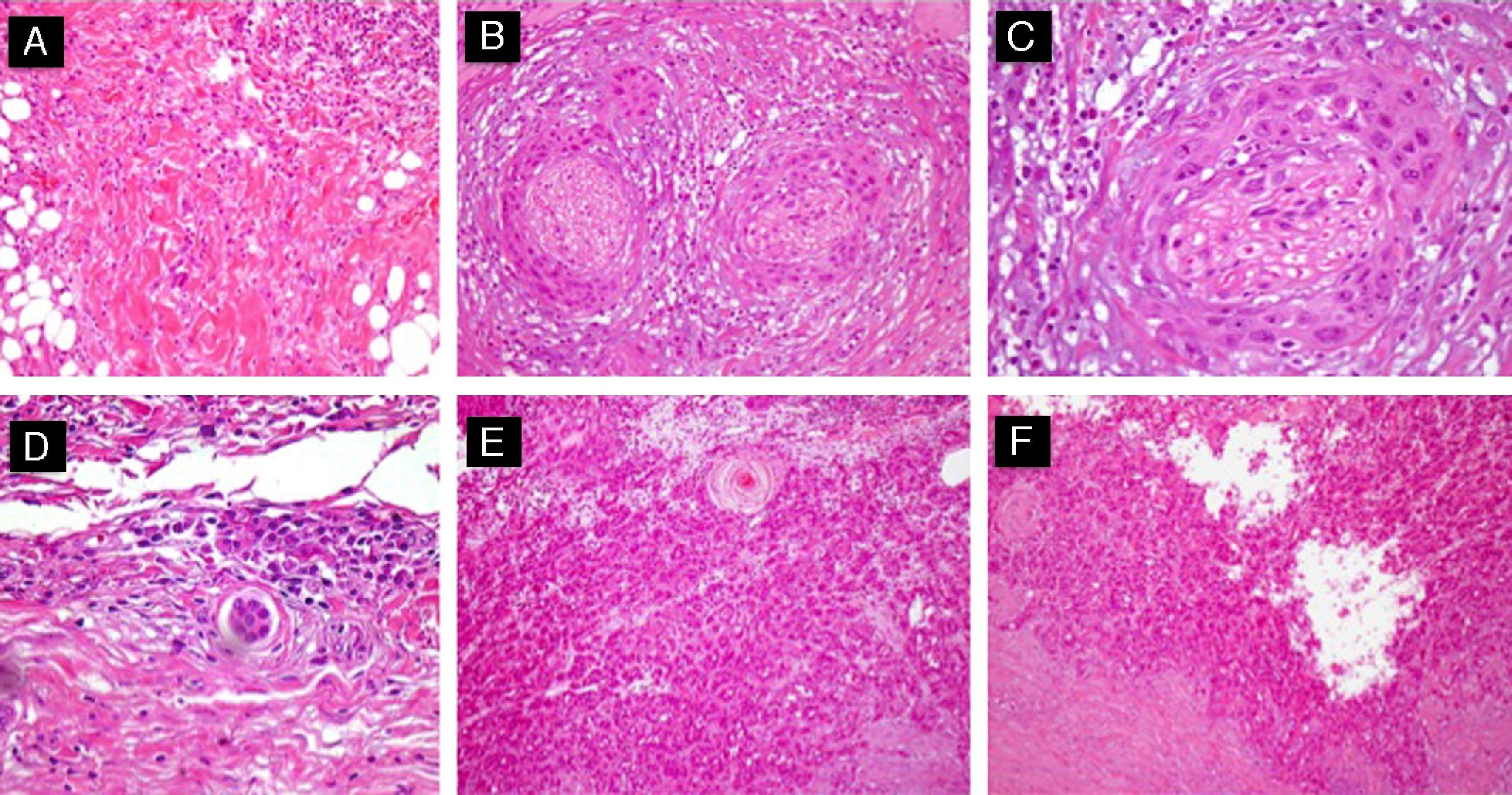
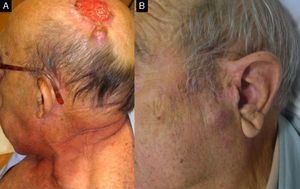
Diferentes variantes histológicas que se asocian al CECAR. A. Patrón de células aisladas (hematoxilina-eosina, x40). B y C.Carcinoma epidermoide con invasión perineural (nervios >0,1mm) (hematoxilina-eosina, B x40; C x100). D. Carcinoma epidermoide con marcada invasión linfovascular (hematoxilina-eosina x100). E. Carcinoma epidermoide adenoide (hematoxilina-eosina x40). F. Carcinoma epidermoide acantolítico (hematoxilina-eosina, x40).
A. Invasión perineural observada de forma incidental durante el acto quirúrgico. B. Histológicamente, las células escamosas atípicas se encuentran invadiendo el tronco nervioso, de diámetro superior a 0,1mm (hematoxilina-eosina, x40). C. La RMN mostró la existencia de invasión intracraneal de la tumoración siguiendo el trayecto nervioso.
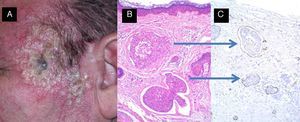
Linfangitis carcinomatosa secundaria a carcinoma epidermoide previamente extirpado de la sien izquierda. A. Desarrollo de múltiples papulo-vesículas en la sien izquierda. B y C. Invasión de vasos linfáticos por células escamosas atípicas (B: hematoxilina-eosina, x40; C: tinción inmunohistoquímica D2-40, x40).
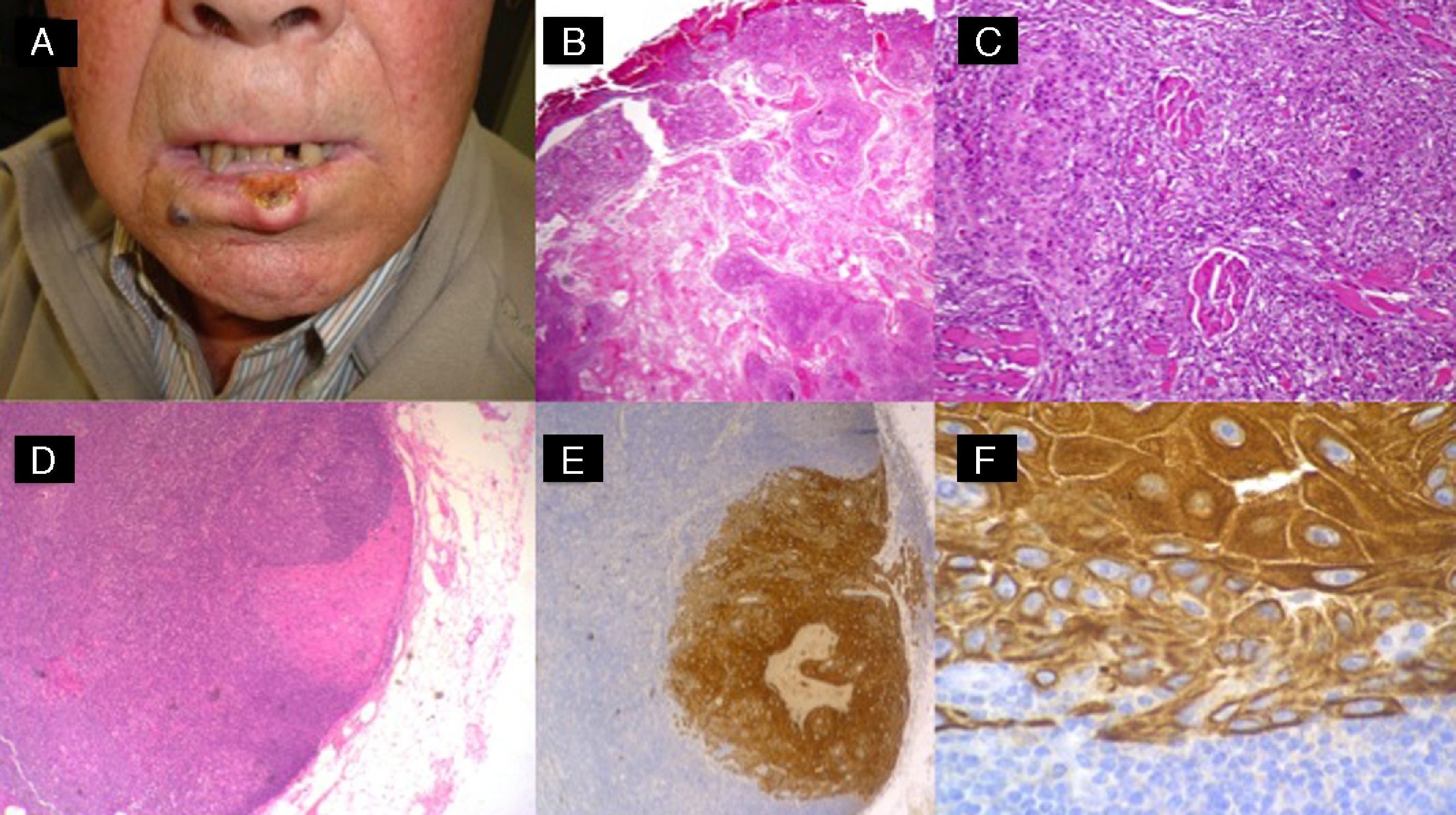
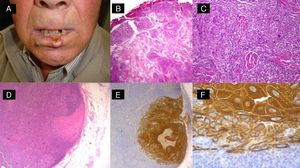
Carcinoma epidermoide de alto riesgo sometido a ganglio centinela. A. Varón de 65 años con carcinoma epidermoide en el labio inferior. B y C. Proliferación escamosa atípica invasiva con acantólisis e invasión perineural. D-F. Invasión del ganglio centinela por células escamosas atípicas (D: hematoxilina-eosina x40; E: hematoxilina-eosina x100; F: inmunotinción con panqueratina x100).
El principal objetivo del presente artículo es definir de forma precisa a esta variante de CEC, conocida como CEC de alto riesgo (CECAR). Esta definición conllevará una mejor evaluación pronóstica y un manejo individualizado de este subgrupo de pacientes.
Definición del término «carcinoma epidermoide cutáneo de alto riesgo»En los últimos años diversos autores han orientado su investigación a analizar las diferencias existentes entre los CEC no metástasicos y los que desarrollan metástasis a distancia. La finalidad última era intentar predecir qué CEC tienen una mayor probabilidad de generar complicaciones locorregionales y/o a distancia, y así poder actuar precozmente sobre este subgrupo de riesgo.
En esta línea, se establece el concepto de CECAR, que se define como toda aquella lesión tumoral de células escamosas que atraviesa la membrana basal y que presenta alto riesgo de metástasis subclínicas, siendo clínicamente N0. De la misma forma, todos aquellos CEC que no pertenezcan a este grupo se englobarán dentro del CEC de bajo riesgo (CECBR).
Parámetros que definen al carcinoma epidermoide cutáneo de alto riesgoLos parámetros que definen al CECAR se pueden dividir en 3 subgrupos, que incluyen datos clínicos, histológicos y moleculares.
Parámetros clínicosAntecedentes personalesTrastornos genéticosLos trastornos genéticos que aumentan el riesgo de desarrollar CEC presentan habitualmente tumoraciones de alto riesgo de malignización. Estas enfermedades incluyen: el xeroderma pigmentoso, la epidermodisplasia verruciforme, el albinismo oculocutáneo, la disqueratosis congénita y la epidermólisis ampollosa distrófica recesiva, siendo en esta última patología la principal causa de mortalidad, con tasas del 80% de fallecimiento en los primeros 5 años tras el diagnóstico de un CEC4,11–13.
Desarrollo del carcinoma epidermiode cutáneo sobre una lesión preexistenteLos CEC que asientan sobre procesos cutáneos crónicos, grupo en el que se incluyen cicatrices, úlceras de evolución tórpida, áreas de quemadura y de radiodermitis recalcitrante, presentan un mayor riesgo de diseminación metastásica. Este hecho parece relacionado con una disminución de la E-cadherina, que favorece la diseminación de queratinocitos atípicos a través de la epidermis y su posterior invasión dérmica14.
Inmunosupresión y trasplanteEl estado del sistema inmune es un factor predictor del pronóstico de una larga lista de procesos oncológicos. En el caso de procesos cutáneos, como el carcinoma de Merkel, las alteraciones en el sistema inmune desempeñan un papel importante en su desarrollo15.
En el caso de los pacientes sometidos a trasplante de órgano sólido (TOS), el CEC aparece con una incidencia 65 veces mayor con respecto a la población general, y representa el CCNM más frecuente, con una incidencia de 3:1 en comparación con el carcinoma basocelular16.
Las tasas de recurrencia, metástasis locorregional y de supervivencia relacionadas con el CEC difieren según el tipo de trasplante. Así, dentro del grupo de los pacientes sometidos al TOS, el trasplante cardíaco es considerado el de mayor riesgo para el desarrollo de CEC y CECAR16. De forma decreciente en riesgo le seguirían el trasplante de pulmón, riñón e hígado. En cuanto a pacientes que presentan un proceso hematológico, aquellos que tienen mayor tendencia a desarrollar CEC y CECAR son el grupo formado por sujetos con leucemia linfática crónica y casos con linfoma linfocítico de célula pequeña17.
La incidencia acumulada de desarrollar un CEC se incrementa de forma progresiva con la duración de la inmunosupresión (incidencia del 7% tras un año de inmunosupresión frente a un 45% a los 11 años y un 70% a los 20 años). De la misma forma, hasta un 66% de los pacientes desarrollarán un segundo CEC en los primeros 5 años tras el desarrollo del primer tumor escamoso maligno18.
La tasa de recurrencia del CEC es mayor en pacientes inmunodeprimidos (39% en 5 años de seguimiento) que en inmunocompetentes (15% en 5 años de seguimiento)19, y la tasa de mortalidad en pacientes sometidos a trasplantes alcanza el 5% comparado con una incidencia menor del 1% en pacientes inmunocompetentes20. Cuando estos datos se analizan en términos de supervivencia, los pacientes trasplantados de órganos con CEC metastásico muestran tasas del 56% en 3 años de seguimiento, similar a la supervivencia de pacientes con carcinoma epidermoide no cutáneo de cabeza y cuello20.
El hecho de que los CEC metastásicos en pacientes inmunodeprimidos presenten en muchos casos unas características clínicas (menor de 2 cm de diámetro horizontal y menor de 2 mm de espesor vertical histológico) que en un paciente inmunocompetente evolucionaría por lo general favorablemente sugiere la existencia de alteraciones moleculares todavía desconocidas que justificarían este potencial de malignidad elevado.
Infección por el virus de la inmunodeficiencia humanaLa infección por el virus de la inmunodeficiencia humana (VIH), independientemente del grado de la enfermedad y de su estado inmunitario, parece representar un factor de mal pronóstico en la evolución del CEC. Así lo indican Nguyen et al. en un estudio retrospectivo de 10 pacientes consecutivos positivos para el VIH, de edades comprendidas entre 31 y 54, que presentaban un CEC de alto riesgo. Cinco de los pacientes murieron durante los 7 años tras el establecimiento del diagnóstico inicial21. La incidencia de recurrencia local, de metástasis y de supervivencia no se correlacionó con el número de infecciones oportunistas ni con el recuento de células T CD4.
Caracteristicas clínicas del carcinoma epidermoide cutáneoTamaño de la lesiónEl tamaño de la lesión primaria ha sido descrito en múltiples estudios como un importante factor predictor para el desarrollo de metástasis nodales12,22–25.
Los resultados obtenidos en el primer estudio prospectivo de una serie de más de 1.000 pacientes con CEC establece que el tamaño tumoral horizontal es un parámetro independiente de riesgo de metástasis en el CEC. De esta forma, el riesgo de metástasis en lesiones menores o iguales a 2cm es del 0,01%. En contraste, los tumores de más de 2cm desarrollan metástasis en un 10% de casos. De ellos, los que se encuentran entre 2 y 5cm desarrollan metástasis en el 7% de los casos, mientras que los que superan los 5cm de tamaño desarrollan metástasis hasta en un 20% de casos26–29.
Basado en nuestra experiencia y en lo publicado previamente, se establece como punto de corte 2cm de tamaño horizontal, a partir del cual existe un incremento de riesgo de desarrollo de metástasis ganglionar. Por el contrario, el espesor tumoral horizontal<2cm actuaría como factor protector, de forma que CEC con tamaños inferiores a este, en un paciente inmunocompetente, descartarían una posible diseminación a distancia.
LocalizaciónLas áreas que muestran una mayor incidencia de CEC metastásicos son el pabellón auricular (fig. 1) y el área no mucosa de los labios (fig. 6), con valores que oscilan entre el 20 y el 30%19,30.
Otras localizaciones, que se podrían considerar de riesgo intermedio, incluirían el cuero cabelludo (principalmente la sien), el área perineal y genital y las partes acras (manos y pies)6,31. Por otra parte, de forma proporcional, es importante tener en cuenta que las áreas no fotoexpuestas como el periné, la región sacra y las plantas presentan mayor tasa de metástasis que las zonas de fotoexposición crónica32.
RecurrenciaLa recurrencia tumoral suele ir asociada a un mal pronóstico en los procesos neoplásicos cutáneos.
De esta forma, estudios comparativos en CEC recurrente frente a no recurrente basado en la tasa de metástasis linfática a los 5 años de seguimiento (15% [CEC recurrente] vs 2% [CEC no recurrente]; p<0,0001) concluyen que esta variable es un importante factor de riesgo en el CEC33.
Clayman observó que la recurrencia se relacionaba con el tamaño tumoral, de forma que tumoraciones de mayores dimensiones se asociaban con una mayor tasa de recidivas (2,4cm vs 1,5cm, p<0,0001)6. A su vez, presentaban con mayor frecuencia invasión perineural (24% vs 10%), invasión linfovascular (17% vs 8%) e invasión del tejido celular subcutáneo (30% vs 10%), comparado con lesiones no recurrentes6.
Por otro lado, la recurrencia se asocia de forma relevante con la exéresis de un CEC con márgenes posquirúrgicos afectos. De esta forma, hasta el 50% de los pacientes con margen positivo recurrirá, con el consecuente riesgo incrementado de desarrollo de metástasis33.
Infección por papilomavirusLos virus del papiloma humano (VPH) implicados en la mayoría de los CEC son los VPH-β. Existen múltiples estudios que demuestran la relación entre estos VPH-β y el CEC, sobre todo en pacientes inmunodeprimidos, aunque posiblemente también tengan su papel en pacientes inmunocompetentes actuando como cofactor de las radiaciones UV. Sin embargo, estos VPH-β estarían implicados en la etiopatogenia del CEC, no en su diseminación, por lo que no constituirían un factor pronóstico.
Los VPH-α, asociados a CEC en la región genital, en la cabeza y el cuello y en regiones acras sí que podrían asociarse a un mayor riesgo, ya que alteran mecanismos reguladores como la p53 o el gen retinoblastoma/p16. Igualmente, la mayoría de estudios sobre p16 relacionan la pérdida de p16 con la evolución de CEC in situ a CEC invasor, pero no con un mayor riesgo de diseminación metastásica. Solamente los casos de CEC en que la positividad para p16 implique la existencia de VPH tipo alfa se asociarían a un mayor riesgo por lo anteriormente comentado34–39.
Características histológicas del carcinoma epidermoide cutáneoEspesor tumoral y nivel de ClarkEspesor tumoralActualmente se considera el factor predictor independiente de metástasis más importante, de forma que incrementos en el espesor tumoral se asocian con mayor riesgo de metástasis26,32.
El análisis obtenido a partir de la mayor serie prospectiva de CEC publicada por Brantsch, revela la existencia de 3 grupos de riesgo en function del espesor tumoral: el grupo de bajo riesgo sería aquel formado por los pacientes cuyas tumoraciones presentasen un espesor tumoral menor o igual a 2mm. Esta población presentaría un riesgo prácticamente nulo de desarrollar metástasis a distancia. En segundo lugar estaría el grupo de riesgo intermedio, compuesto por aquellos pacientes con CEC de espesor tumoral de entre 2 y 6mm. Este subgrupo presentaría una incidencia de desarrollo de diseminación tumoral de un 4% a lo largo los siguientes 5 años de seguimiento. Finalmente, el grupo de alto riesgo sería el formado por todo aquel paciente que presente un CEC cuyo espesor tumoral sea igual o superior a 6mm. Esta población desarrollaría metástasis hasta en un 16% de los casos26.
Tras el análisis de posteriores estudios, y basándonos en nuestra propia experiencia, consideramos un espesor de 4mm como punto de corte más sensible para separar al CEC de bajo riesgo y al CEC de alto riesgo de diseminación sistémica. Por otro lado, los CEC con espesor tumoral menor de 2mm presentan un riesgo prácticamente nulo para el desarrollo de enfermedad a distancia.
Grado de diferenciación tumoralEl grado de diferenciación tumoral es un hallazgo que en el CEC, y de forma común con el resto de procesos oncológicos, presenta un valor importante en el establecimiento del pronóstico de un proceso neoplásico maligno.
En un estudio de 571 pacientes con CEC existió una diferencia significativa en la tasa de metástasis para lesiones de alto grado frente a otros grados (17% vs 4%; p=0,004)22. Otro estudio de un elevado número de pacientes apoya el mayor riesgo de malignización de aquellos CEC de alto grado frente a otros (44% vs 5%; p<0,01)12.
El grado de diferenciación tumoral se asocia a su vez con una mayor frecuencia de recurrencias precoces. Por otra parte, si bien la existencia de una mala diferenciación implica un aumento de riesgo de metástasis a distancia (2,9 veces mayor riesgo de metástasis y de muerte comparado con la forma bien diferenciada), parece que una buena diferenciación tumoral también se puede asociar al desarrollo de enfermedad avanzada12,40.
Si analizamos el patrón arquitectural del CEC determinados subtipos histológicos (CEC acantolítico, adenoide y de células aisladas) son un factor de riesgo adicional a considerar junto al grado de diferenciación tumoral (fig. 3).
Márgenes quirúrgicos histológicamente afectosUna excisión incompleta de la tumoración, y por tanto, la persistencia de enfermedad, supone un factor de mal pronóstico. Hasta el 50% de los pacientes con margen positivo con un CEC reaparecerá por persistencia tumoral, con el riesgo subsecuente incrementado de desarrollo de metástasis33. Ello parece relacionado con un riesgo de progresión tumoral subclínico, que favorecería su diseminación a distancia41.
La decisión de observación en pacientes con CEC inadecuadamente extirpados, es decir, con un informe histológico que revele afectación de uno o más márgenes de la pieza quirúrgica debe de ser evaluado con precaución, dada la elevada tasa de enfermedad nodal en las formas recurrentes. De hecho, en diferentes estudios de CEC diseminado a ganglios linfáticos, entre el 45 y el 51% de los pacientes que desarrollaron metástasis nodales habían presentado recurrencia de la tumoración primaria12,22,42,43.
Por lo tanto, todo CEC debe ser intervenido quirúrgicamente hasta alcanzar márgenes libres de enfermedad44. En caso de que la cirugía no pueda llevarse a cabo otros tratamientos, principalmente la radioterapia, deberían ser planteados.
Invasión perineuralEste fenómeno ocurre en aproximadamente entre el 5 y el 10% de los pacientes con CEC, habitualmente como un hallazgo incidental6,45. Sin embargo, la evidencia histológica de afectación perineural (IPN) parece asociada con un incremento significativo en la tasa de recurrencia y de metástasis a distancia6,45. Este hecho queda reflejado en un estudio realizado en la Clínica Anderson, en Texas, donde encontraron un incremento significativo tanto de metástasis regionales (35% vs 15%; p<0,005) como a distancia (15% vs 3,3%; p<0,005) en pacientes con IPN comparados con aquellos que no la mostraron46.
La importancia de la IPN no solo radica en el riesgo de diseminación locorregional, sino también en la morbilidad secundaria a la diseminación perineural por los nervios craneales, habitualmente el nervio facial y el trigeminal (fig. 4), y en una peor tasa de supervivencia en un seguimiento a 3 años (64% en CEC con IPN frente a un 91% en CEC sin IPN; p=0,002)47–49.
La evaluación del riesgo de una infiltración perineural en el CEC variará en función del grosor de los nervios afectos y de la existencia de manifestaciones clínicas y/o radiológicas. Respecto al tamaño del filete nervioso la infiltración de nervios de diámetro menor de 0,1mm se asociará a un bajo riesgo de desarrollo de complicaciones locales o a distancia. Por el contrario, la presencia de filetes nerviosos infiltrados mayores de 0,1mm muestran mal pronóstico a corto y medio plazo (muerte específica por CEC en IPN<0,1mm=0; muerte específica por CEC en IPN>0,1mm=32%; p=0,003)50.
Respecto a la evaluación clínica de la IPN esta puede mostrarse como un hallazgo histológico incidental, sin síntomas acompañantes, o como una forma sintomática. En este último caso se manifestaría como dolor a la palpación, parestesias regionales, dolor agudo intermitente o dolor lancinante. Estudios obtenidos de datos de la universidad de Florida sugieren que los pacientes con IPN asintomática no visible radiológicamente presentan un mejor pronóstico comparado con pacientes que se presentan con IPN clínica o radiológicamente positivas (control local a los 5 años del 87% frente a un 55% respectivamente; p=0,006)5,481.
Invasión linfovascularRecientes estudios sugieren que la presencia de infiltración linfovascular puede incrementar el riesgo de metástasis. Moore definió la invasión linfovascular como un factor predictor independiente de desarrollo de metástasis nodal en un análisis multivariante (OR 7,54; p<0,00001)43. En este estudio el 40% de los pacientes con metástasis nodal presentaba invasión linfovascular en comparación con el 8% de pacientes sin adenopatías. Otros estudios, sin embargo, ponen en duda su impacto en el pronóstico12,50.
Las consecuencias de CEC en los vasos linfáticos dérmicos, raramente descrito, es desconocido, pero puede incrementar el riesgo de recurrencia y puede explicar el fenómeno de metástasis en tránsito (fig. 5).
Otros factoresLa presencia de queratosis actínica peritumoral37–39, los niveles de Clark37–39, la expresión de Ki67, la desmoplasia26,38 y la existencia de una respuesta inflamatoria tumoral formada principalmente por eosinófilos y células plasmáticas han sido propuestos como factores pronósticos en el CEC. Sin embargo, su valor es controvertido y son necesarios más estudios para definir su relevancia real.
Marcadores moleculares en el carcinoma epidermoide cutáneoEl 70% de pacientes con CEC metastástico presentan una o más de las características establecidas previamente como factores que definen al CECAR. Sin embargo, el 20-30% restante no asocian ningún factor de los anteriormente comentados (CEC de espesor fino y de pequeñas dimensiones), por lo que otras variables todavía no bien conocidas deben tener un papel importante en su patogenia12,51. Dentro de este grupo adquieren importancia determinadas alteraciones moleculares que parecen determinar la existencia de un grupo de CEC con comportamiento más agresivo. De todas ellas, las mutaciones de los genes que expresan el receptor del factor de crecimiento epidérmico (EFGR), y en menor medida mutaciones en p16 y CKS1B se postulan como las principales alteraciones moleculares en el CEC de alto riesgo, con la implicación terapéutica que ello podría conllevar52–56.
Receptor del factor de crecimiento epidérmicoEn un número variable de neoplasias, incluyendo carcinomas de células escamosas mucoso del tracto aerodigestivo, los tumores con sobreexpresión del receptor de crecimiento epidérmico (EGFR) presentan estadios tumorales más avanzados, aumento de riesgo de desarrollo de metástasis nodales, recurrencia temprana y disminución de supervivencia57–62.
Existe actualmente un único estudio con un discreto número de casos en el que se analiza la importancia de mutaciones en EFGR en el pronóstico del CEC. En el análisis que incluyó 15 casos de carcinoma epidermoide metastásico, la sobreexpresión intensa de EFGR se asoció significativamente con el potencial metastásico del CEC de cabeza y cuello (79% vs 36%)62,63. Esta sobreexpresión se mostró independiente de la amplificación génica. Los diferentes mecanismos alternativos que explicarían la sobreexpresión incluirían el aumento de transcripción de ARNm, mutaciones activadoras en el receptor, niveles elevados de ligandos activadores del receptor y un aumento de la expresión de receptores heterólogos como Her-262. Respecto a este último existe un trabajo en el que se analiza la existencia de alteraciones en la expresión o en el gen que codifica Her-2 (cromosoma 17) en pacientes con sobreexpresión de EFRG63. Así, en los 27 casos analizados no se encontró una sobreexpresión de Her-2. Sin embargo, se detectó una polisomia del gen Her-2, que como en el cáncer de mama no se asocia a un aumento de sobreexpresión. La ausencia de sobreexpresión conlleva el fracaso terapéutico de anti Her-2 como el transtuzumab64. A pesar de que el significado de este último hallazgo todavía no está establecido, la detección de polisomia Her-2 puede presentar un impacto en predecir respuesta terapéutica a los inhibidores de tirosín cinasa61,62. No obstante, la sobreexpresión del EFGR no aparece en todo CEC metastásico (65-75% de casos), lo que apoya el origen multifactorial de este tipo de proliferaciones malignas62,63.
p16Algunos estudios apoyan que la sobreexpresión de p16 se correlaciona con el grado de malignidad, sugiriendo que su expresión podría representar un biomarcador de progresión tumoral, de forma similar a lo que ocurre con p5364,65, mientras que otros afirman que la pérdida de expresión de p16 está correlacionada con el CEC de alto riesgo66,67. En este último caso Chang et al.67 detectaron una correlación entre la pérdida de expresión de p16 y el desarrollo de metástasis, sugiriendo que este fenómeno podía ser un factor de mal pronóstico.
La explicación a formas de mal pronóstico con niveles elevados de p16 podría estar relacionado con la coexistencia de infección HPV asociada. No obstante, excepto en la epidermodisplasia verruciforme, en inmunodeprimidos y en CEC localizado en áreas fuera de la cabeza y el cuello, el papel del HPV en el desarrollo del CEC es controvertido.
Otra posible explicación es la fotoinducción de la expresión de p16 por UV. La posibilidad de una p16 mutada, con una vida media larga, pero con pérdida de su potencial antioncogénico, explicaría el aumento de riesgo de malignidad.
CSK1BEl gen CKS1B codifica la subunidad 1 de las ciclinas reguladoras dependientes de quinasas (CKS1B). Esta proteína se une a la subunidad catalítica de las ciclinas dependientes de quinasas y es esencial para llevar a cabo su función biológica. El ARNm de CKS1B parece ser expresado en diferentes patrones a través del ciclo celular en células HeLa, que refleja el papel específico de la proteína codificada. Este péptido ejerce una función reguladora del ciclo celular, interaccionado con otras proteínas, principalmente SKP2 y CDKN1B68,69.
El gen CKS1B parece tener un papel crítico en la progresion tumoral del CEC. En un estudio realizado por Salgado et al. se analizó el estatus genético y proteico de CKS1B por medio de la aplicación de hibridación in situ mediante fluorescencia (FISH) y análisis inmunohistoquímico70. En este estudio, en el que incluyen un total de 43 CEC y 26 queratosis actínicas, concluyen que la polisomía del cromosoma 1 es un evento frecuente en el CEC (30 de 43 casos) y en las queratosis actínicas (13 de 23 casos). La presencia de amplificaciones en el gen CKS1B, que aparecieron en 4 casos (9,3%) se relacionaron en todos los casos con un comportamiento tumoral agresivo, en términos de infiltración perineural, de diseminación nodal y de CEC en pacientes trasplantados70.
En conclusión, las amplificaciones en el gen CKS1B podrían ser consideradas como un marcador del CECAR.
Hacia una nueva clasificación pronóstica del carcinoma epidermoide cutáneoLa mortalidad en el CEC es importante si se tiene en cuenta que estamos ante una de las tumoraciones más prevalentes del mundo.
En este sentido, una correcta diferenciación entre el CECBR y el CECAR parece fundamental para mejorar la supervivencia, ya que ello conllevará una optimización en el manejo en función del riesgo.
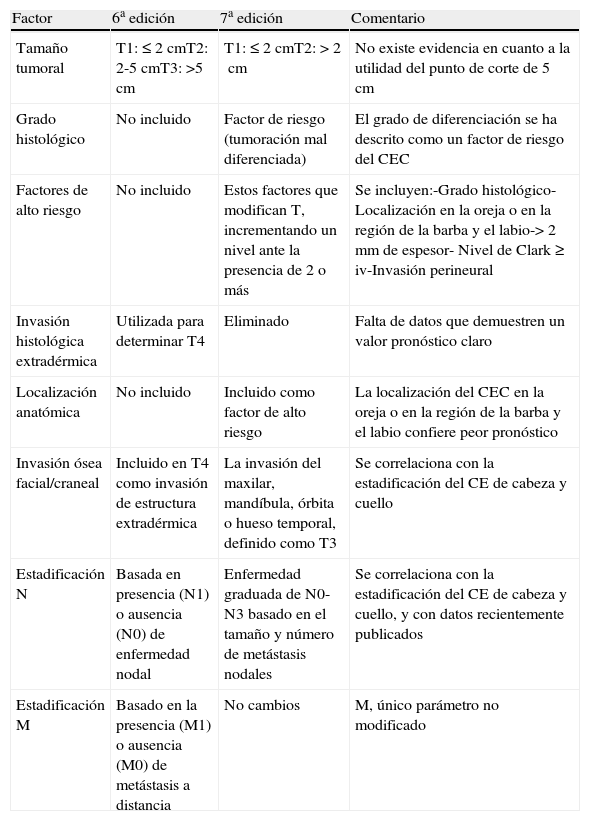
El Comité Americano de Consenso en Patología Oncológica (American Joint Committee on Cancer [AJCC]) ha modificado recientemente el sistema de estadificación del CEC. Los principales cambios respecto a la anterior clasificación se describen en la tabla 171. Dentro de los cambios introducidos en esta guía actualizada, destaca la introducción de una lista de factores clínicos e histológicos «de alto riesgo», que modificarían el valor de la T, independientemente del tamaño tumoral. Esta lista incluye un espesor tumoral mayor de 2mm, un nivel de Clark mayor o igual a iv, la localización en el pabellón auricular o en la región labial, la invasión perineural, la invasión de estructuras óseas y la pobre diferenciación tumoral71. No obstante, en nuestra experiencia, esta lista no es lo suficientemente certera en la definición del CECAR. Si bien es cierto que la localización y la invasión perineural sí son buenos factores predictivos, la diferenciación tumoral y el nivel de Clark son 2 datos discutibles. Mención aparte merece el establecimiento del punto de corte de 2mm para diferenciar lo que es alto riesgo y bajo riesgo. Un porcentaje muy elevado de CEC presenta un espesor tumoral superior a este valor, por lo que se trata de una cifra muy sensible, pero muy poco específica para la definición del riesgo. Por otra parte, no se incluyen factores tan importantes como el estado del sistema inmune, la recurrencia tumoral o la existencia de invasión linfovascular.
Comparación entre la sexta y la séptima edición de la guía de estadificación del cáncer de la American Join Comittee on Cancer (AJCC)
| Factor | 6a edición | 7a edición | Comentario |
| Tamaño tumoral | T1:≤ 2cmT2: 2-5cmT3:>5cm | T1:≤ 2cmT2:>2cm | No existe evidencia en cuanto a la utilidad del punto de corte de 5cm |
| Grado histológico | No incluido | Factor de riesgo (tumoración mal diferenciada) | El grado de diferenciación se ha descrito como un factor de riesgo del CEC |
| Factores de alto riesgo | No incluido | Estos factores que modifican T, incrementando un nivel ante la presencia de 2 o más | Se incluyen:-Grado histológico-Localización en la oreja o en la región de la barba y el labio->2mm de espesor- Nivel de Clark ≥ iv-Invasión perineural |
| Invasión histológica extradérmica | Utilizada para determinar T4 | Eliminado | Falta de datos que demuestren un valor pronóstico claro |
| Localización anatómica | No incluido | Incluido como factor de alto riesgo | La localización del CEC en la oreja o en la región de la barba y el labio confiere peor pronóstico |
| Invasión ósea facial/craneal | Incluido en T4 como invasión de estructura extradérmica | La invasión del maxilar, mandíbula, órbita o hueso temporal, definido como T3 | Se correlaciona con la estadificación del CE de cabeza y cuello |
| Estadificación N | Basada en presencia (N1) o ausencia (N0) de enfermedad nodal | Enfermedad graduada de N0-N3 basado en el tamaño y número de metástasis nodales | Se correlaciona con la estadificación del CE de cabeza y cuello, y con datos recientemente publicados |
| Estadificación M | Basado en la presencia (M1) o ausencia (M0) de metástasis a distancia | No cambios | M, único parámetro no modificado |
Paralelamente, la red nacional de estudio del cáncer (National Comprehensive Cancer Network [NCCN]) propone en su última actualización del año 2010 considerar al CEC como una entidad cuyo tratamiento dependerá de una serie de variables. Así, enumera un listado de factores de riesgo y establece dos supuestos: en primer lugar, todos aquellos CEC con cualquier factor de riesgo incluido en la tabla 2 deben ser tratados con exéresis, con un margen de seguridad de 10mm o mediante cirugía de Mohs. En segundo lugar, cuando un CEC presente 3 o más de estos factores de riesgo el paciente deberá recibir una atención «especial». En nuestra opinión esta clasificación también resulta subóptima. En cuanto al grupo de pacientes incluidos en la primera premisa, un gran porcentaje de CEC presentan alguno de los factores incluidos en la tabla 2, por lo que basar la modificación del tratamiento en este hecho parece demasiado inespecífico. El segundo supuesto es todavía más confuso, ya que el grupo considera que aquel CEC con 3 o más factores de la tabla 2 debe recibir un trato especial, pero sin definir cuál debe ser esa variación en el manejo y/o en el seguimiento.
Supuestos considerados por la National Comprehensive Cancer Network (NCCN) para la definición del riesgo del carcinoma epidermoide cutáneo
| Cualquier factor de riesgo de los siguientes es suficiente para justificar la escisión con un margen de 10mm o estudio completo de márgenes (Mohs): |
| Tamaño≥2cm (o 1cm en cabeza, 6mm en genitales, manos o pies) |
| Espesor tumoral≥4mm |
| Márgenes mal definidos |
| Tumores recurrentes |
| Inmunosupresión |
| Radiación previa |
| Inflamación crónica |
| Rápido crecimiento |
| Invasión perineural o vascular |
| Moderadamente o pobremente diferenciado |
Debe prestarse especial atención al paciente ante la existencia de 3 o más de los factores de riesgo anteriores
El principal problema que consideramos que existe en los diferentes intentos por definir el CECAR radica en que la mayor parte de estudios identifican los factores de riesgo previamente comentados de forma individual. Sin embargo, no se valora el efecto acumulativo o sumatorio que generan dichas variables.
A partir de nuestra experiencia, como centro de Dermatología oncológica, recogida de forma sistemática en una base de datos y, apoyándonos en los estudios publicados previamente en la literatura, identificamos el valor acumulado de cada uno de los factores pronósticos que definen al CECAR. A partir de este análisis dividimos los factores de riesgo del CEC en criterios mayores y menores y establecemos un sistema de puntuación para diferenciar el grupo de CEC de bajo y de alto riesgo (tabla 3). Así, consideramos CECAR a todo aquel carcinoma cutáneo de células escamosas que presente: a) 3 criterios mayores; b) 2 criterios mayores y 2 criterios menores; y c) 1 criterio mayor y 4 criterios menores. Esta propuesta de definición de CECAR, de importante repercusión pronóstica y terapéutica, deberá ser corroborada con estudios prospectivos futuros que analicen de forma global los diferentes factores pronósticos del CEC.
Criterios mayores y menores que definen al carcinoma epidermoide de alto riesgo
| Criterios mayores | Clínicos | Histológicos |
| Antecedente personal de:Epidermólisis ampollosa distrófica recesivaEpidermodisplasia verruciformeDisqueratosis congénitaXeroderma pigmentosoAlbinismo oculocutáneo | Espesor tumoral mayor de 6mm | |
| Inmunodepresión por:Trasplante de órgano sólido (corazón y pulmón)Enfermedad hematológica (leucemia linfática crónica, linfoma linfocítico de célula pequeña) | Invasión perineural (nervios de diámetro ≥0,1mm) | |
| Localización(labio, anogenital, pabellón auricular) | Invasión ósea | |
| Recurrencia tumoral | ||
| Diámetro tumoral mayor de 5cm | ||
| Criterios menores | Clínicos | Histológicos |
| Inmunodepresión por:-Trasplante de órgano sólido (riñón e hígado) | Espesor tumoral de 2 a 6mm | |
| Desarrollo de la lesión sobre lesión preexistente (cicatriz, área de radiodermitis) | Tumoración pobremente diferenciada | |
| Diámetro tumoral de 2 a 5 cm* | Variantes de CEC acantolítico, de células aisladas, basoescamoso | |
| Infección por el virus de la inmunodeficiencia humana | ||
| Infección por papilomavirus de la pieza histológica en paciente inmunodeprimido | ||
| Invasión linfo-vascular | ||
Con el establecimiento de la definición provisional del CECAR la actitud terapéutica irá encaminada a un tratamiento más agresivo, y a un posterior seguimiento más exhaustivo de este grupo de pacientes.
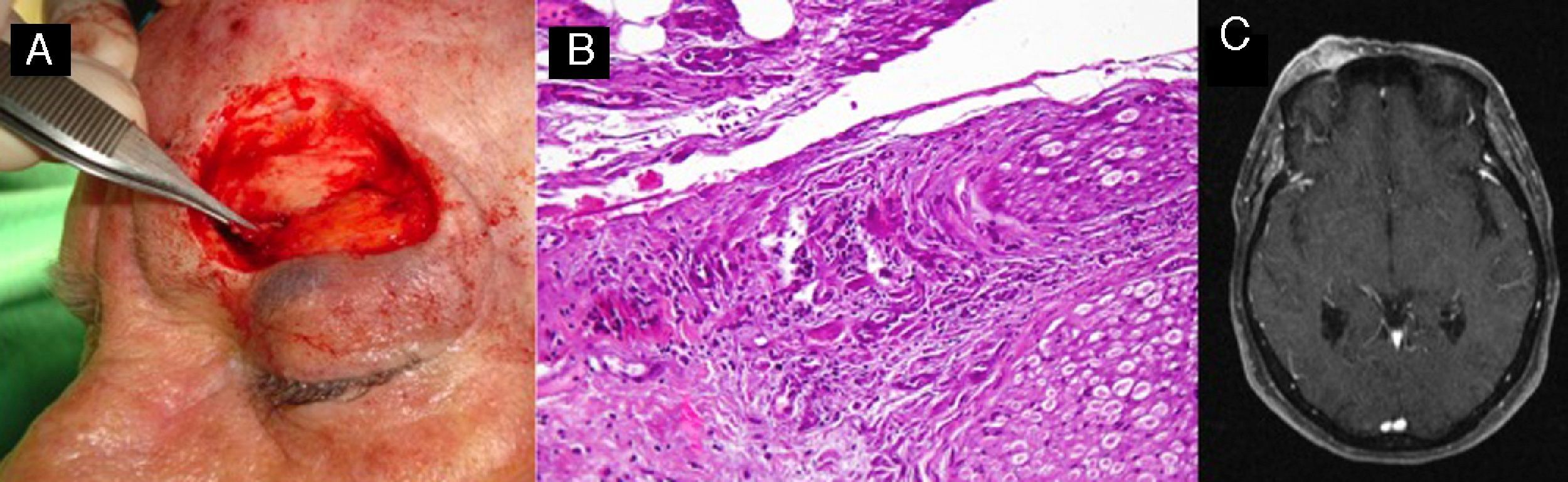
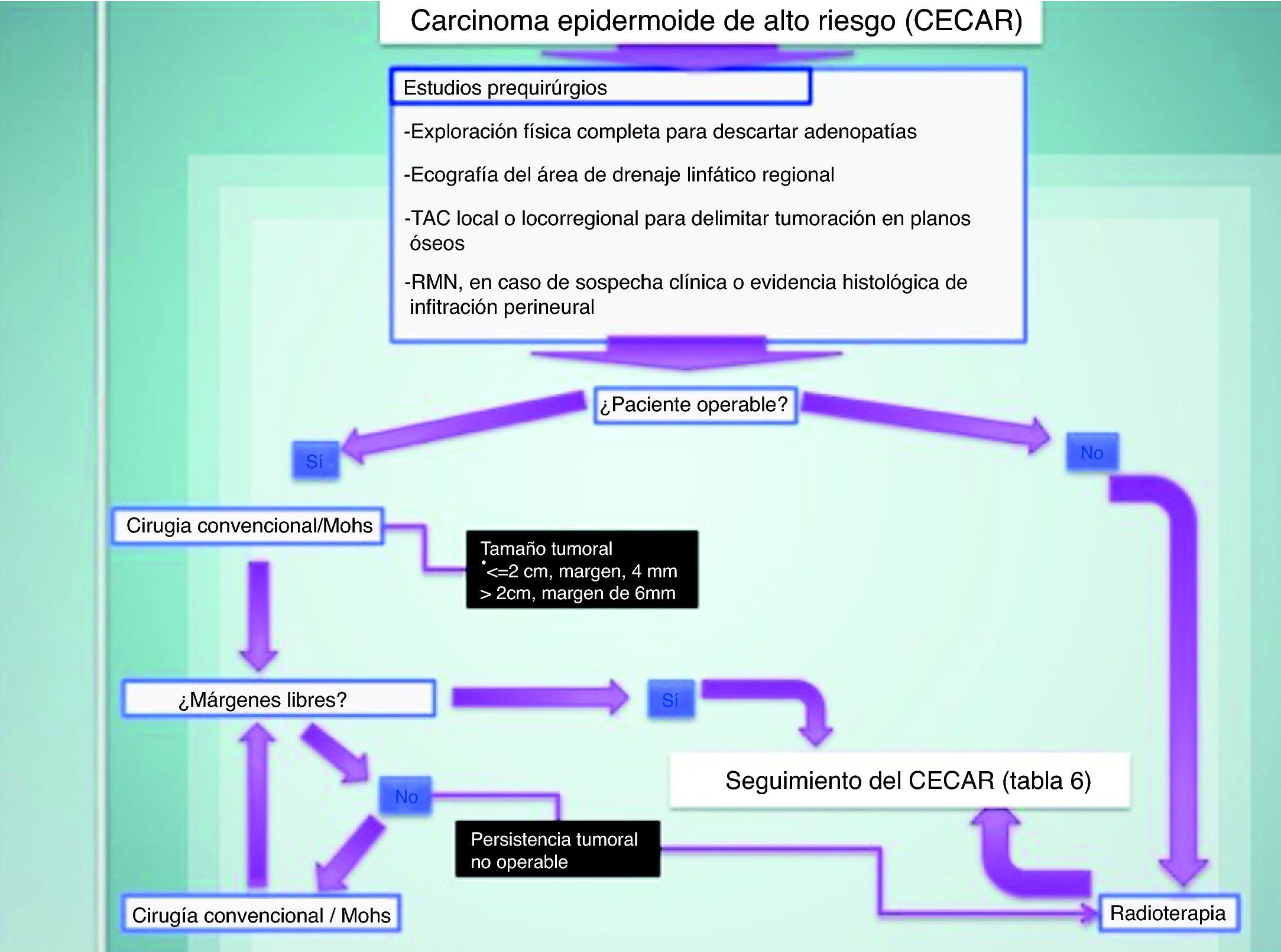
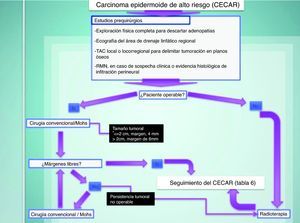
Tratamiento del carcinoma epidermoide de alto riesgoEl tratamiento de elección del CECAR es la exéresis quirúrgica. En caso de una exéresis convencional, los márgenes de seguridad oscilarán entre 4mm en tumoraciones de tamaño menor o igual a 2cm, a 6mm en tumoraciones superiores a 2cm. En casos de compromiso estético-funcional, y en CECAR recurrentes, el tratamiento de elección será la cirugía micrográfica de Mohs (fig. 7)71,42,72–75.
La radioterapia, considerada por algunos autores como un tratamiento de primera línea, alcanza resultados inferiores a la cirugía, presenta un porcentaje importante de recurrencias rápidas y más agresivas, genera importantes costes directos e indirectos, a lo que se suma la carcinogénesis iatrogénica en el área irradiada. Por ello, esta terapia debe er reservada para pacientes inoperables, bien por mal estado general del paciente, bien por imposibilidad de alcanzar márgenes libres de enfermedad en el acto quirúrgico71,42,72,73.
Actitud complementaria en el carcinoma epidermoide de alto riesgoEl CECAR, dado su alto riesgo de invasión nodal y de mortalidad, precisa de una serie de acciones complementarias frente al CECBR.
Realización del ganglio centinelaEn el año 2006 Ross et al. concluyeron que la realización del ganglio centinela (GC) en el CEC permitía diagnosticar con una fiabilidad aceptable y con una baja morbilidad la existencia de invasión locorregional, siempre que fuera llevada a cabo por cirujanos que hubiesen superado la curva de aprendizaje, al igual que sucede en el melanoma cutáneo74.
Esta técnica es incluso más rentable en el caso del CEC frente al MM, puesto que la detección precoz de afectación ganglionar en el primero supone una disminución relevante en la tasa de mortalidad del CECAR.
Por tanto, la realización del GC estaría justificada en aquellos casos clasificados, según la definición previamente comentada, como CECAR (tabla 3 y fig. 6).
Seguimiento en el paciente con antecedente de caracinoma apidermoide de alto riesgoEl CECAR, a diferencia de la variante de bajo riesgo, presenta un mayor riesgo de recurrencia y de metástasis nodal en los primeros 5 años tras el tratamiento. La detección precoz de la recurrencia y de la metástasis ganglionar es de gran importancia. Esta afirmación se corrobora con múltiples estudios, entre los que destaca el de Ebrahimi et al., que desmuestran basándose en un análisis de CEC con afectación nodal, que aquellos CEC con una adenopatía única menor o igual a 3cm de diámetro sin rotura capsular presentan un bajo riesgo de invasión a distancia y de muerte por este cáncer75.
Por tanto, se propone una metodología de seguimiento basado el el riesgo del CEC (tabla 4). El CECAR requerirá un control estricto durante los primeros 5 años tras el tratamiento, especialmente en los 24 primeros meses, período de mayor riesgo de invasión nodal.
Protocolo de seguimiento del carcinoma epidermoide en función del riesgo
| Período* | Frecuencia de visita | Exploración física | Pruebas complementarias |
| 1er y 2° año | Trimestral | Sí | Ecografía trimestral**TAC/RMN semestral*** |
| 3er al 5° año | Semestral | Sí | Ecografía semestral**-TAC/RMN anual*** |
| A partir del 5° año | Anual | Sí | No |
*95% de recurrencias y metástasis en los primeros 5 años; **la ecografía se realizará de los territorios ganglionares correspondientes a la localización tumoral; ***en pacientes inmunodeprimidos o casos con infiltración perineural de tronco principal.
El CEC es una tumoración cuya incidencia está creciendo de forma exponencial en los últimos años. Se trata de la segunda tumoración cutánea no melanocítica más frecuente en la población general, que muestra tasas de mortalidad global similares a las que alcanza el melanoma.
La definición precisa de los factores epidemiológicos, clínicos e histológicos de aquellos CEC que presentan elevadas tasas de diseminación sistémica, denominados CECAR, permitirá tomar una actitud diferente para este grupo de pacientes, que deben incluir una estadificación más exhaustiva en el momento del diagnóstico y un tratamiento más agresivo con la realización de ganglio centinela, y un seguimiento más estrecho. Este manejo individualizado permitirá reducir la mortalidad asociada a esta tumoración maligna.
La caracterización de la biología molecular del CECAR y el análisis de las diferencias genéticas con respecto al CECBR probablemente permitan en un futuro no muy lejano explicar el potencial de malignidad de la variante de alto riesgo, así como optimizar la actuación terapéutica mediante fármacos que actúen sobre dianas moleculares clave en el proceso de carcinonégesis epidérmica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.