El carcinoma escamoso de pene (CEP) es una neoplasia infrecuente en Europa, suponiendo un 0,7% de los tumores en varones. La mala higiene, no estar circuncidado, la infección por el virus del papiloma humano (VPH) y algunas dermatosis inflamatorias crónicas son los principales factores de riesgo. El VPH se detecta en un 70-100% de los CEP in situ y en un 30-60% de las formas invasivas, sobre todo en los tumores basaloides y condilomatosos. Los tumores in situ pueden tratarse de forma conservadora, pero requieren un seguimiento estricto, puesto que del 1 al 30% evolucionan a formas invasivas. En los CEP invasivos el tratamiento de elección es la cirugía. La irradiación profiláctica de los ganglios inguinales está actualmente desaconsejada. Parece que el uso de la biopsia selectiva de ganglio centinela podría ser útil para disminuir la morbilidad asociada a la linfadenectomía inguinal profiláctica. La supervivencia se relaciona directamente con la presencia de metástasis ganglionares. El conocimiento de las alteraciones moleculares y genotípicas subyacentes abrirá nuevas vías terapéuticas.
Penile squamous cell carcinoma (SCC) is uncommon in Europe, where it accounts for approximately 0.7% of all malignant tumors in men. The main risk factors are poor hygiene, lack of circumcision, human papillomavirus (HPV) infection, and certain chronic inflammatory skin diseases. HPV infection is detected in 70% to 100% of all penile in situ SCCs and in 30% to 50% of invasive forms of the disease, mainly basaloid and warty SCCs. In situ tumors can be treated conservatively, but close monitoring is essential as they become invasive in between 1% and 30% of cases. The treatment of choice for penile SCC is surgery. Inguinal lymph node irradiation is no longer recommended as a prophylactic measure, and it appears that selective lymph node biopsy might be useful for reducing the morbidity associated with prophylactic inguinal lymph node dissection. Survival is directly related to lymph node involvement. Improving our knowledge of underlying molecular changes and their associated genotypes will open up new therapeutic pathways.
El cáncer de pene es excepcional en países desarrollados. La mayoría de tumores (98%) corresponden a carcinomas escamosos. Los principales avances sobre el carcinoma escamoso de pene (CEP) en los últimos años se han centrado en la identificación de factores de riesgo, en el conocimiento de las vías moleculares implicadas en su desarrollo y en la actualización de su estadificación. También hay avances en su manejo terapéutico, con tendencia a realizar una cirugía cada vez más conservadora que, minimizando el riesgo de recidiva, preserve la función sexual y urinaria del pene.
En nuestro medio el CEP predomina entre la sexta y la octava décadas de la vida, apareciendo dos tercios de los casos en mayores de 65 años1. La incidencia global oscila entre 0,1 y 0,7 casos por 100.000 varones. Se estima que en todo el mundo se diagnostican unos 4.000 nuevos casos cada año, lo que representa menos del 0,5% de todos los cánceres1. Concretamente, en España, la incidencia anual se sitúa entre el 0,7 y 1,5 casos/100.000 varones, representando aproximadamente un 0,7% de los tumores malignos en hombres. En otras zonas de Europa Occidental la incidencia es similar, pero en países como Uganda y Brasil es hasta 4 veces superior1,2. Estas amplias variaciones de incidencia estarían justificadas por diferencias socioeconómicas y culturales.
Factores de riesgoLos principales factores de riesgo implicados en el desarrollo del CEP serían la mala higiene, no estar circuncidado, la infección por el virus del papiloma humano (VPH) y algunas dermatosis inflamatorias crónicas.
La mala higiene contribuye al desarrollo del CEP a través de la acumulación de esmegma y otros irritantes en el espacio balanoprepucial, así como a una mayor incidencia de infecciones bacterianas y/o candidiásicas3.
La mayoría de CEP aparecen en varones no circuncidados4. La circuncisión neonatal tiene un papel preventivo2,4,5, pero no se ha demostrado que realizada más tardíamente tenga el mismo efecto beneficioso. También es evidente que la fimosis, presente en un 40-85% de estos tumores, impide una higiene correcta del glande, contribuye a la inflamación crónica y favorece su desarrollo6.
Se ha demostrado una relación directa entre la infección por el VPH y el CEP. Ambos se relacionan directamente con el número de parejas sexuales y la edad temprana de las primeras relaciones sexuales2. Sin embargo, mientras que un 95% de los cánceres de cérvix se relacionan con esta infección viral, esto es menos usual en los CEP. Es más frecuente en los carcinomas in situ (70-100% de los casos) que en las formas invasivas (30-60%) y varía de uno a otro subtipo histológico: alcanza el 70-100% en los CEP basaloides y condilomatosos y se sitúa solo en el 30% de los comunes7,8. El serotipo implicado con mayor frecuencia es el VPH 16 (69%)7, si bien se han detectado otros serotipos oncogénicos, con especial relevancia del VPH 189.
La historia de condilomas acuminados, aunque estén causados por VPH de bajo riesgo oncogénico (VPHbr), aumenta la probabilidad de padecer un CEP entre 3 y 5 veces10. A este hecho posiblemente contribuyen las conductas sexuales de riesgo que muchas veces coexisten, con posibilidad de reinfectarse por otros VPH.
El tumor de Buschke-Löwestein, o condiloma gigante, a pesar de que en la literatura se ha clasificado como un carcinoma verrucoso, es mejor considerarlo una entidad separada. Las principales razones para ello son que tiene características clínico-patológicas distintivas, simulando clínica e histológicamente un condiloma, se relaciona con VPHbr (6 y 11), aparece a edades relativamente tempranas y prácticamente no tiene capacidad metastásica2,11.
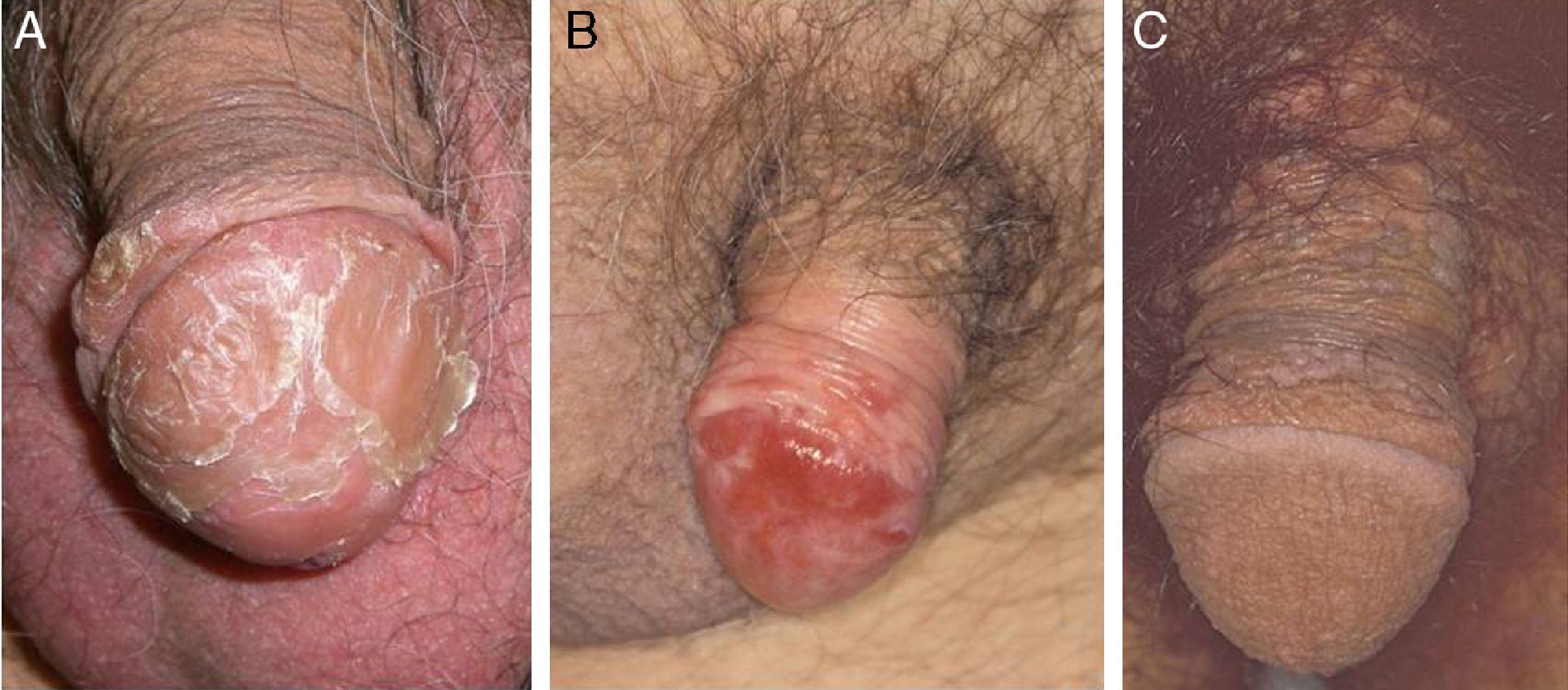
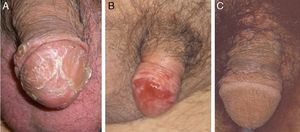
Otro proceso excepcional es la balanitis queratósica, micácea y pseudoepiteliomatosa de Lortat-Jacob. Afecta el glande de varones de edad avanzada no circuncidados. Al igual que el tumor de Buschke-Löwestein, se considera una lesión premaligna o de bajo grado de malignidad. No se ha relacionado con la infección por el VPH. Se inicia como una placa cubierta de escamas micáceas, plateadas, con un aspecto psoriasiforme, que puede hacerse francamente queratósica (fig. 1A). Histológicamente se observa desde una simple hiperplasia epitelial hiperqueratósica con mínima atipia celular hasta una lesión que simula un verdadero carcinoma verrugoso.
Otros factores de riesgo a tener en cuenta son las enfermedades inflamatorias crónicas del pene. Destacan el liquen escleroso (LE) y su forma más avanzada, la balanitis xerótica obliterans, caracterizada por una fibrosis constrictiva que afecta toda la circunferencia del prepucio, impidiendo su retracción. Un 6% de los LE de pene pueden desarrollar un CEP y, al revisar piezas quirúrgicas, hasta una tercera parte de los CEP asientan sobre un LE12,13. Por tanto, los pacientes con LE del pene deben seguir controles periódicos.
Como en otros carcinomas cutáneos, la inmunosupresión mantenida que sufren los pacientes trasplantados o los infectados por el virus de la inmunodeficiencia humana desempeña un papel fundamental en el aumento del riesgo y empeoramiento del pronóstico del CEP. Finalmente, existen estudios que han relacionado esta neoplasia con el hábito tabáquico, al igual que ocurre con el cáncer de vejiga y de cavidad oral2,10,14.
Clínica e histologíaDesde el punto de vista clínico-patológico hay dos situaciones bien diferenciadas, con implicaciones pronósticas y terapéuticas: el carcinoma in situ y el carcinoma infiltrante.
Carcinoma escamoso de pene in situEl CEP se origina a partir de la progresión de una lesión precursora que puede subclasificarse según la intensidad y extensión de la atipia citológica y la presencia o no de VPH5. El aspecto clínico de estos carcinomas in situ puede ser muy variable, oscilando desde lesiones inaparentes que solo se desenmascaran si se aplica ácido acético hasta lesiones rojizas (eritroplasia de Queyrat [EQ] y enfermedad de Bowen genital [EBG]), blancas (leucoplasias) o marronáceas (papulosis bowenoide [PB]).
Las lesiones subclínicas se visualizan mediante penescopia tras aplicar ácido acético15. Se denominan lesiones planas del pene o lesiones «acetoblancas» y están relacionadas con la infección por VPH de alto riesgo oncogénico (VPHar). Son muy frecuentes, pues están presentes hasta en el 50-70% de las parejas sexuales masculinas de mujeres con neoplasia intraepitelial cervical (CIN) y en un 10-20% de los varones cuyas parejas no tienen CIN. Contienen grandes cantidades de virus y son muy contagiosas. La histología suele mostrar una hiperplasia epitelial o displasia variable. La mayoría se curan espontáneamente o con tratamiento en uno o dos años, y solo un pequeño porcentaje persiste e incluso pueden progresar hacia un carcinoma invasor16.
La EQ se manifiesta en forma de una placa eritematosa, única o múltiple, en la mucosa del glande o en la cara interna del prepucio (fig. 1B). La EBG se presenta como una placa única y escamosa, localizada en la piel queratinizante, generalmente en el tercio distal del pene17. La PB aparece en varones más jóvenes, entre la tercera y cuarta década de la vida. Clínicamente se trata de pápulas verrucosas, múltiples, pequeñas y bien delimitadas, de color marrón, localizadas en el pene, el glande, el prepucio o el pubis (fig. 1C). Están producidas por el VPH 16 y son muy contagiosas, lo que implica un elevado riesgo de tener una CIN para la pareja sexual.
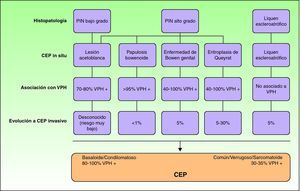
En todas estas lesiones es imprescindible realizar un estudio histológico para confirmar su verdadera naturaleza. Las alteraciones observadas se engloban bajo la denominación de neoplasia intraepitelial de pene (PIN), por analogía con la neoplasia intraepitelial vulvar (VIN) o cervical (CIN). Estas mismas alteraciones a menudo continúan presentes en el epitelio adyacente de los carcinomas. Se distinguen la PIN diferenciada y la PIN indiferenciada18.
La PIN diferenciada, común o de bajo grado, es aquella en la que se observa atipia citológica en las capas basal y suprabasal de la epidermis, crestas elongadas y una arquitectura conservada en las capas superiores19. Suele asociarse a la presencia de LE o hiperplasia epidérmica. Puede evolucionar a un CEP común, verrugoso o, con menor frecuencia, basaloide o condilomatoso18–21.
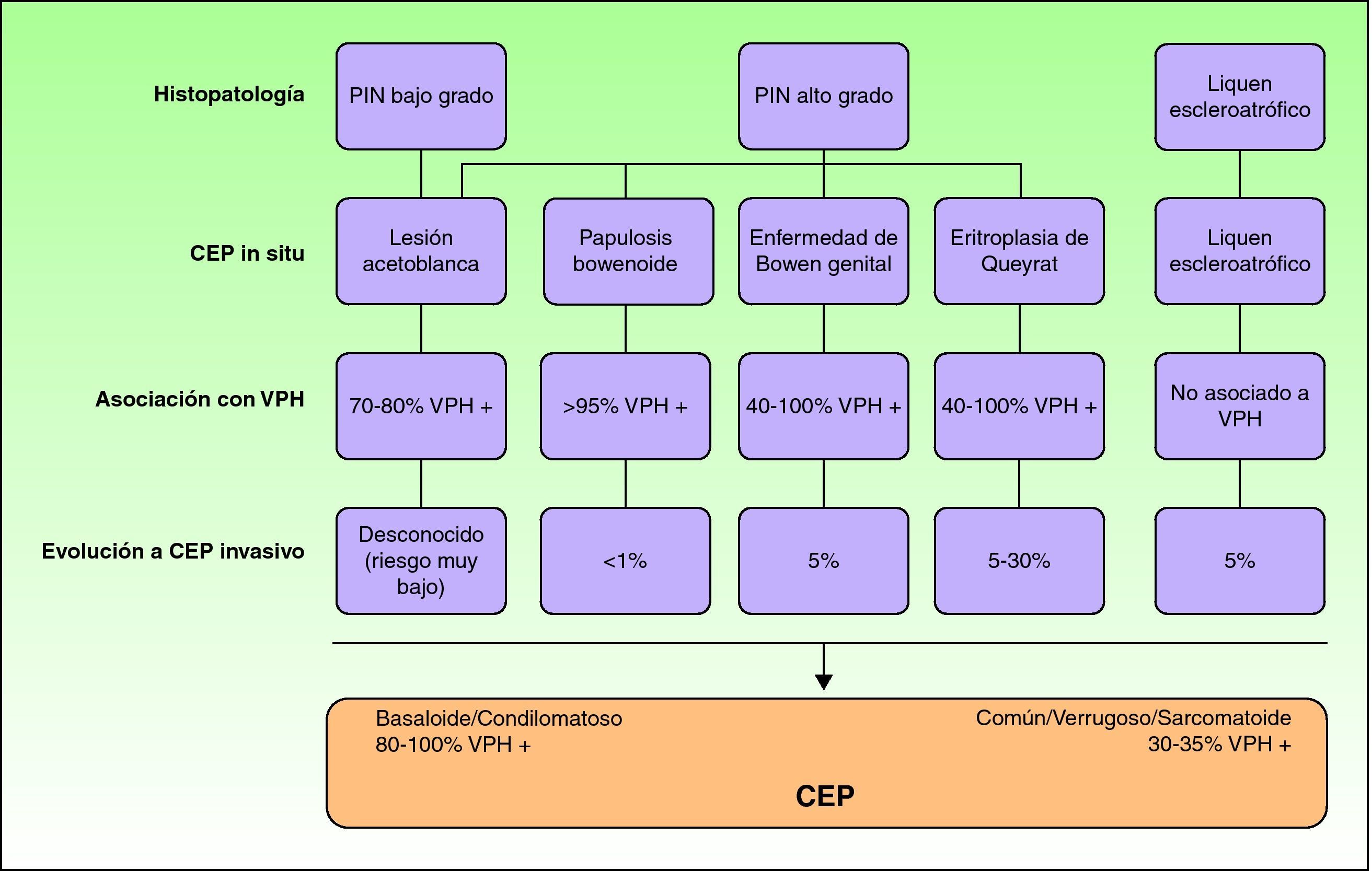
La PIN indiferenciada, bowenoide o de alto grado, tiene atipia citológica que afecta a más de los dos tercios inferiores del epitelio, células de aspecto basaloide, abundantes mitosis y se correlaciona con la infección por el VPH18–21. Suele evolucionar a un CEP basaloide o condilomatoso, con menos frecuencia hacia un CEP común, y casi nunca hacia un carcinoma verrugoso18. La EQ, la EBG y PB son manifestaciones clínicas de la PIN indiferenciada, con un riesgo decreciente de evolucionar hacia un CEP invasivo (10-30%, 5-10% y menor al 1%, respectivamente)22 (fig. 2).
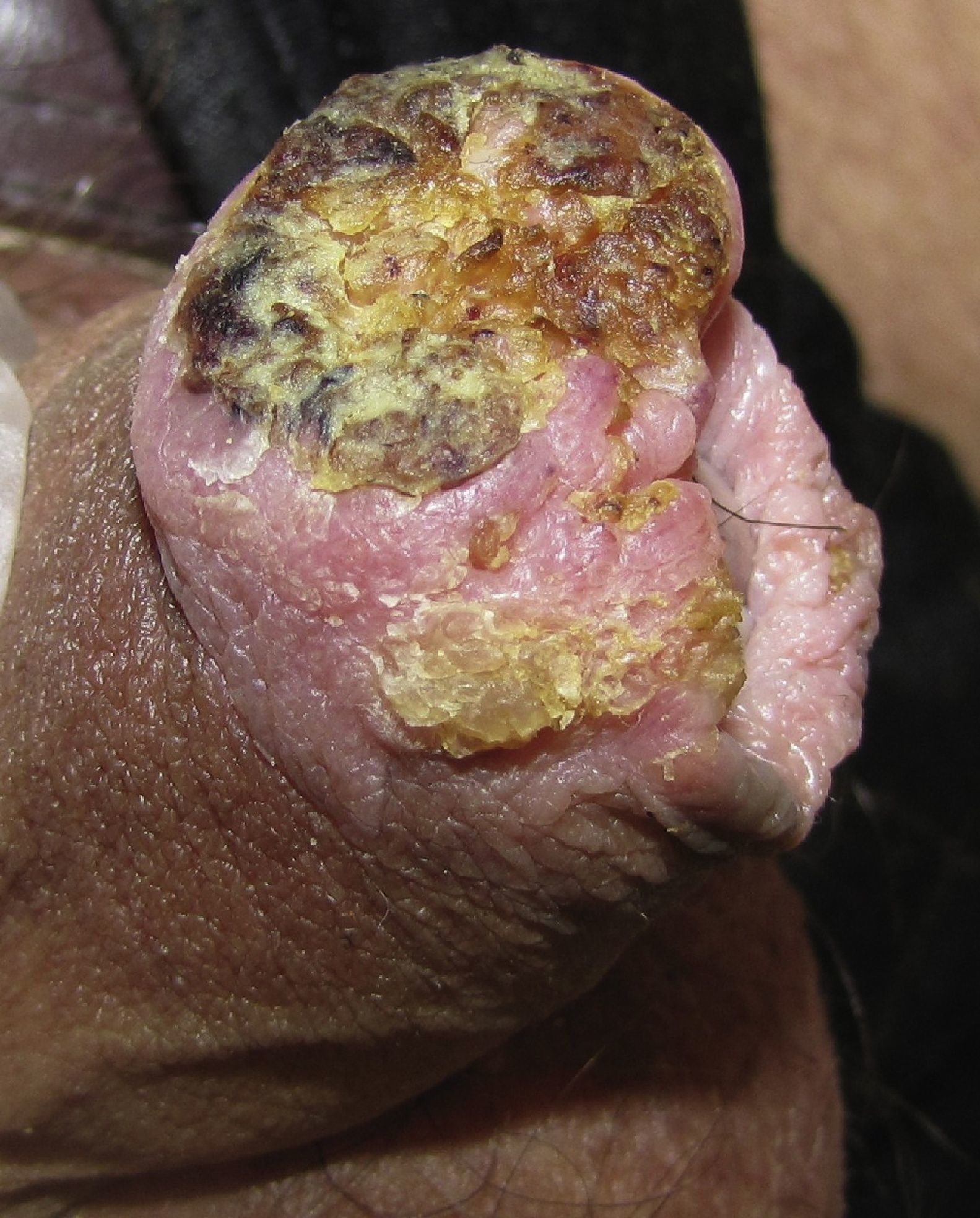
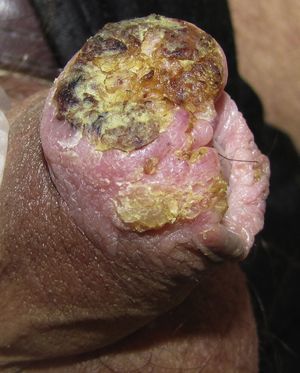
Carcinoma escamoso de pene invasivoEl aspecto clínico del CEP invasivo puede ser muy variable, incluyendo una placa eritematosa, una úlcera o un verdadero tumor exofítico o de aspecto verrugoso. Las lesiones pueden ser pétreas o friables, sangrantes y alcanzar varios centímetros de diámetro (fig. 3). Suelen ser únicas y ubicarse en cualquier parte del pene, si bien lo más frecuente es que estén en el tercio anterior (glande, surco balano-prepucial y/o prepucio). Menos del 5% se originan en el cuerpo del pene. En el momento de la valoración clínica es fundamental recoger la siguiente información: diámetro máximo, número, morfología y color de la lesión, relación con otras estructuras (invasión del meato uretral, del cuerpo esponjoso o del cavernoso) y medir el tamaño del pene para tener una valoración aproximada de la longitud residual tras la penectomía en caso de ser necesaria10.
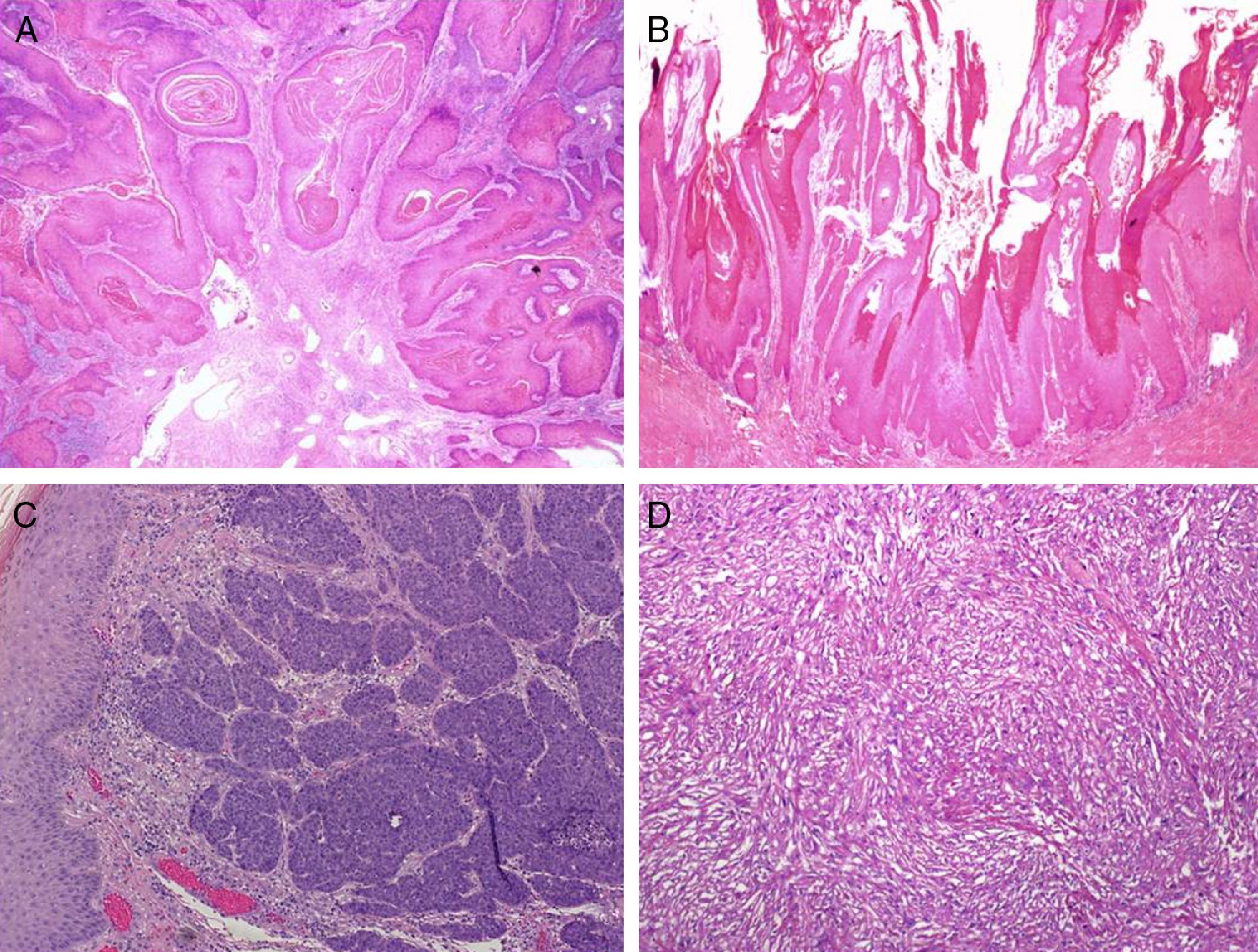
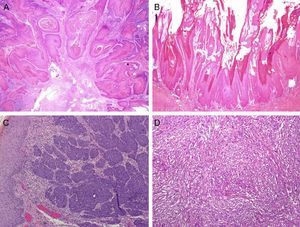
Según las características arquitecturales y citológicas se han identificado varios subtipos histológicos de CEP invasivo. El tipo común o queratinizante es el más frecuente, representa un 50-60% de los casos y habitualmente tiene un crecimiento infiltrante, con marcada hiperqueratosis, pudiendo estar bien o mal diferenciado (fig. 4A). El CEP verrugoso (8-10%) tiene una arquitectura que simula una verruga y un crecimiento expansivo (fig. 4B). El CEP basaloide (4-6%) se caracteriza por la presencia de nidos infiltrantes de células claramente basaloides con una empalizada periférica23 (fig. 4C), y el tipo condilomatoso (6-10%) simula un condiloma, tiene cambios citopáticos fácilmente identificables y células de mayor tamaño24. Según nuestra experiencia algunos tumores con una arquitectura de tipo común tienen una citología llamativamente basaloide; son mucho más frecuentes que el basaloide puro y también están relacionados con la infección por VPHar. El CEP sarcomatoide (1%) está muy mal diferenciado, y para demostrar la verdadera naturaleza de las células fusiformes es necesario realizar tinciones inmunohistoquímicas específicas para citoqueratinas (fig. 4D). Por último, existen formas mixtas (10-15%)25.
Los subtipos histológicos del CEP también pueden estratificarse según su pronóstico, siendo el verrugoso y condilomatoso los de mejor pronóstico, al igual que la subvariedad cuniculatum de CEP común. Esta variedad de carcinoma tiene una arquitectura verrugosa con invaginaciones tumorales que característicamente penetran en profundidad remedando las «madrigueras de los conejos». Los tumores con alto riesgo de diseminación son el basaloide, el sarcomatoide y los comunes indiferenciados. La mayoría de ellos están mal diferenciados e invaden la dermis profunda. La categoría intermedia estaría constituida por los CEP comunes y algunas formas mixtas, así como las variantes pleomórficas del CEP condilomatoso25.
EstadificaciónEn 2009 la American Joint Committee on Cancer (AJCC) propuso una nueva estadificación TNM que da gran importancia al compromiso ganglionar como factor pronóstico de supervivencia26 (tabla 1). Respecto a la T, se ha subdividido en T1a cuando el tumor está bien diferenciado y no hay invasión linfovascular, y en T1b cuando no se da alguna de estas dos circunstancias. Además, en el T3 se ha eliminado la próstata, puesto que su invasión solo ocurre excepcionalmente, cuando ya están afectadas otras muchas estructuras. La definición de la categoría T2 todavía no se ha modificado, pero algunos estudios han señalado que el pronóstico es mucho peor cuando el tumor invade el cuerpo cavernoso que si solo afecta el cuerpo esponjoso26.
Clasificación TNM en el carcinoma escamoso de pene según la European Association of Urologists penile cancer guidelines 2009
| T: tumor primario |
| TX: el tumor primario no puede ser evaluado |
| T0: no hay evidencia de tumor primario |
| Tis: carcinoma in situ |
| Ta: carcinoma verrucoso no invasivo |
| T1: el tumor invade el tejido conectivo subepitelial |
| T1a: el tumor no tiene invasión linfovascular y es bien diferenciado o moderadamente diferenciado (T1-G1/G2) |
| T1b: el tumor tiene invasión linfovascular, es pobremente diferenciado o es indiferenciado (T1-G3/G4) |
| T2: el tumor invade el cuerpo esponjoso o los cuerpos cavernosos |
| T3: el tumor invade la uretra |
| T4: el tumor invade otras estructuras adyacentes |
| N: ganglios linfáticos regionales (p: estadio patológico) |
| NX: los ganglios linfáticos regionales no pueden evaluarse |
| N0: ganglios linfáticos inguinales no palpables ni aumentados de tamaño |
| N1: una metástasis ganglionar inguinal unilateral, palpable y móvil |
| N2: múltiples metástasis ganglionares inguinales uni o bilaterales, palpables y móviles |
| N3: metástasis ganglionar inguinal fija o linfadenopatía pélvica unilateral o bilateral |
| M: metástasis a distancia |
| M0: no hay metástasis a distancia |
| M1: metástasis linfáticas fuera de la pelvis o viscerales |
En cuanto a la N se ha especificado que N1 designa únicamente la afectación inguinal unilateral con ganglios móviles, N2 la afectación inguinal bilateral con ganglios móviles y N3 la presencia de uno o más ganglios fijos e inmóviles o la afectación de ganglios pélvicos.
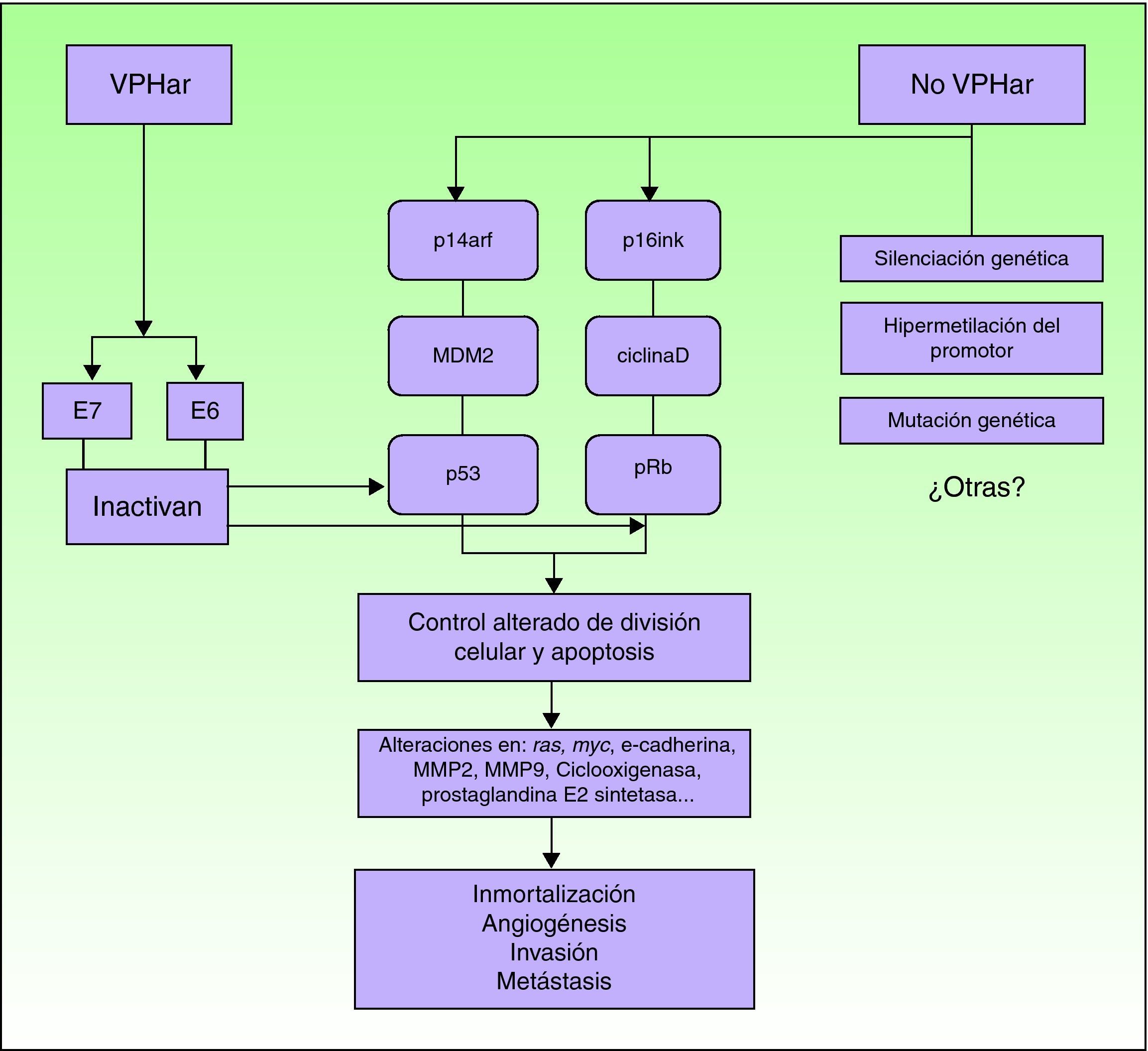
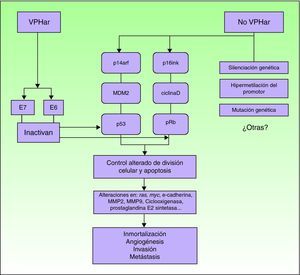
PatogeniaEn relación con la etiopatogenia, parece evidente la alteración de diferentes vías moleculares. Si bien desconocemos el impacto y la interrelación entre cada una de ellas, una parte de los CEP serían atribuibles a la infección por VPHar, mientras que el resto estarían producidos por mecanismos moleculares independientes del VPH6 (fig. 5).
Los CEP producidos por VPHar surgen a partir de una lesión precursora causada por el virus, siendo la vía carcinogénica similar a la implicada en el cáncer de cérvix27. Sin embargo, parece que deben influir mecanismos tisulares u hormonales que hacen que existan diferencias significativas en la incidencia de la enfermedad y en la edad de aparición del CEP respecto al cáncer de cérvix, a pesar de estar ambos producidos por los mismos agentes infecciosos.
El evento inicial es la infección persistente del epitelio escamoso por VPHar, seguida de una serie de alteraciones epigenéticas que confieren características de malignidad a la célula infectada. El VPHar expresa las oncoproteínas E6 y E7, que al unirse a dos genes supresores tumorales (p53 y Rb), los inactivan28–30. Las proteínas E6 y E7 del VPH son fundamentales para inducir y mantener la transformación del fenotipo de la célula infectada. Alterando las vías moleculares p14arf/MDM2/p53 y p16ink/ciclinaD/Rb, los VPH oncogénicos interfieren en el control de la división celular y de la apoptosis. La inactivación funcional de pRb por E7 produce una sobreexpresión de p16inkA4, debido a la falta de feedback negativo. Por eso, la sobreexpresión de p16 puede utilizarse como un marcador de infección por VPH31. Otro marcador que sirve para identificar de forma indirecta la presencia de VPH es el ProxExC, pero todavía no existe experiencia en el CEP32.
En los CEP no relacionados con la infección por el VPH se alteran las mismas vías de señalización. Los mecanismos serían silenciación de genes supresores tumorales, la hipermetilación de genes promotores o la sobreexpresión de oncogenes2,31.
Cuando el CEP ya está más avanzado, parece que los mecanismos moleculares serían equivalentes en ambos grupos (VPH positivos y negativos). Se han identificado alteraciones en la expresión de los genes ras y myc, E-cadherina, metaloproteinasas (MMP) 2 y 9, ciclooxigenasa y prostaglandina E2 sintetasa33–35. Serían procesos tardíos que, por tanto, estarían implicados en la progresión de la enfermedad, tales como la angiogénesis y su capacidad invasiva y metastásica. Algunos de estos factores se consideran predictivos de metástasis ganglionares.
Factores pronósticosLa presencia y el número de adenopatías en la región inguinal son los factores pronósticos de supervivencia más importantes. La supervivencia libre de enfermedad a los 5 años llega a ser del 80% cuando hay afectación de uno o dos ganglios inguinales superficiales y unilaterales (N1), descendiendo al 10-20% cuando la afectación es bilateral o pélvica (N2/3) y a menos del 10% cuando hay afectación extranodal36.
Como parámetros histológicos determinantes del riesgo de metástasis ganglionares y de muerte por el tumor, parece que la invasión perineural, la permeación linfovascular y el grado de diferenciación son los más importantes25,37–40. Otros factores que parecen condicionar el pronóstico son la profundidad, el patrón de crecimiento y el subtipo histológico del tumor, así como la invasión uretral.
La implicación del VPH en el pronóstico es controvertida41,42. Los resultados también son contradictorios en cuanto a la expresión de p53 como predictor independiente de metástasis ganglionares43,44. Sin embargo, sí que parece que en los tumores T1 la expresión intensa de p53 se correlacionaría con un mayor riesgo de metástasis y menor supervivencia44. La elevada expresión de ki67 aumenta el riesgo de metástasis ganglionares, pero no influye en la supervivencia45. En los estudios de Campos y Zhu se vió que la baja expresión de E-cadherina se correlaciona con mayor riesgo de metástasis ganglionares y peor supervivencia33,44. Finalmente Campos et al. demostraron que la sobreexpresión de MMP9 supone un factor de riesgo para la recidiva del tumor33.
TratamientoLa baja incidencia del CEP justifica la falta de protocolos estandarizados para su manejo y la ausencia de ensayos clínicos aleatorizados que realmente ayuden en la toma de decisiones.
Tratamiento del tumor primarioLos CEP in situ pueden tratarse con exéresis simple o cirugía micrográfica de Mohs46; con ambas técnicas la tasa de recidivas es baja y se preserva la función del órgano. La crioterapia, la terapia fotodinámica, el láser (CO2 o Nd:YAG) o la aplicación tópica de 5-fluorouracilo al 5% o imiquimod al 5% son otras opciones terapéuticas eficaces47–51. A pesar del riesgo relativamente bajo de que estos CEP in situ se hagan invasivos, se recomienda un seguimiento clínico tras el tratamiento. La falta de respuesta o la recidiva deben alertar de la posible progresión del tumor.
En los CEP invasivos la cirugía del tumor primario con márgenes de seguridad de 5 a 10mm es la base del tratamiento. El objetivo es realizar una cirugía curativa que preserve, siempre que sea posible, las funciones urinaria y sexual del miembro. La calidad de vida y la salud sexual son aspectos a considerar y que deben discutirse siempre con el paciente en el momento de decidir la opción terapéutica.
Al plantear la estrategia terapéutica a seguir son determinantes el tamaño y grado de infiltración del tumor, la localización del mismo (glande, prepucio o cuerpo del pene) y la experiencia del cirujano. En tumores extensos pero superficiales pueden plantearse opciones terapéuticas como la decorticación del glande y reconstrucción con un injerto de piel parcial o la combinación de exéresis con láser y reconstrucción quirúrgica, dejando la quimioterapia intralesional (vinblastina, bleomicina, metotrexato) o la radioterapia para casos muy excepcionales, pues tiene mayores efectos adversos52,53. Cuando el tumor afecta al prepucio la postectomía ampliada es el tratamiento de elección, y cuando el tumor ya es más infiltrante deben plantearse opciones quirúrgicas más agresivas como la glandectomía o penectomía parcial según el tamaño tumoral54–57, o incluso la penectomía total si es un tumor localizado en el cuerpo del pene o muy mal diferenciado56,57. En tumores T4, muy infrecuentes, la administración de quimioterapia sistémica neoadyuvante seguida de cirugía en pacientes respondedores es el tratamiento de primera línea.
La radioterapia del tumor primario puede ser una alternativa en tumores T1-T2 menores de 4cm de diámetro, con tasas de curación del 70 al 90% a los 5 años58,59. Los mejores resultados se obtienen con braquiterapia o radioterapia con haz de electrones, pero las recurrencias locales son mas frecuentes que si se realiza una penectomía parcial. En estas situaciones la cirugía de rescate puede restaurar el control local del tumor. La estenosis uretral (10-45%), la necrosis del glande (0-23%) o la fibrosis de los cuerpos esponjosos son complicaciones atribuibles a la radioterapia60.
Manejo de los ganglios linfáticosEs fundamental realizar una palpación minuciosa de las zonas inguinales en busca de ganglios linfáticos potencialmente infiltrados por el tumor, ya que es donde se localiza con mayor frecuencia el ganglio centinela. A medida que el tumor progresa puede llegar a invadir la fascia de Buck, permear los cuerpos cavernosos y, por vía linfática, alcanzar secuencialmente los ganglios regionales de los territorios inguinales superficial, profundo y pélvico, para finalmente metastatizar en órganos distales. La utilización de la tomografía por emisión de positrones (PET-TC) ayuda a completar la estadificación gracias a su elevada sensibilidad61. La punción-aspiración con aguja fina (PAAF) guiada por ecografía es un método rápido y fácil para detectar metástasis cuando se palpan ganglios inguinales62. En caso de no detectarse células tumorales tras la punción se puede optar por repetirla, extirpar el ganglio o hacer un nuevo control tras 4 semanas de antibioticoterapia sistémica empírica. En caso de positividad (presencia de células neoplásicas en la PAAF o en la biopsia del ganglio), la linfadenectomía (LDN) es obligatoria.
La LDN es el tratamiento de elección en pacientes con ganglios linfáticos inguinales metastásicos. Sin embargo, es una técnica dificultosa y con un riesgo de complicaciones del 50% (24-87%), entre las que destacan los edemas crónicos en miembros inferiores y escroto, necrosis de los colgajos e infección de la herida quirúrgica, incluyendo una mortalidad del 1-3% de los casos63. Con objeto de disminuir la morbilidad atribuible a la LDN se está probando la utilización de LDN inguinal por vía endoscópica con resultados prometedores64. La realización de LDN bilateral profiláctica conlleva una alta morbilidad siendo en muchos casos innecesaria, ya que no mejora el pronóstico.
Para aquellos pacientes con tumores moderadamente o mal diferenciados o≥T3 sin ganglios palpables, no existe ninguna técnica mínimamente o no invasiva que sea 100% informativa del estado de los ganglios linfáticos65. Algunos estudios han demostrado que la biopsia selectiva de ganglio centinela (BSGC) aumenta la supervivencia respecto a la conducta expectante y reduce la morbilidad comparada con la LDN inguinal profiláctica, teniendo una especificidad del 100% y una sensibilidad del 95%, pero no se realiza en todos los centros66. En su defecto, se han diseñado algoritmos basados en las características histológicas del tumor que predicen el riesgo de metástasis, pero su sensibilidad no supera el 80%13,67–69.
La radioterapia profiláctica en pacientes N0 ya ha quedado descartada porque no previene la aparición de ganglios linfáticos metastásicos, tiene complicaciones y dificulta el seguimiento de los pacientes por la fibrosis residual70. La quimioterapia adyuvante tiene únicamente un papel paliativo en pacientes con metástasis inguinales irresecables o en órganos distales.
SeguimientoLos pacientes deben seguir un control estricto durante al menos 5 años. Si se ha realizado cirugía conservadora se recomiendan controles trimestrales durante los dos primeros años, y luego semestrales. Si la cirugía ha sido más radical son suficientes los controles semestrales71. En tumores T1 o T2, bien diferenciados, sin permeación linfovascular ni adenopatías palpables en el momento del tratamiento es suficiente el seguimiento clínico. En otros casos conviene realizar ecografía inguinal en los controles.
El riesgo de recidiva local global no supera el 5%. La mayoría de recidivas locales con cirugías preservadoras del órgano se producen durante los dos primeros años. La recidiva local suele detectarla el propio paciente, su pareja o el médico habitual, por lo que no suele afectar a la supervivencia.
El riesgo de metástasis ganglionares es mayor (9%) en los pacientes en los que se han valorado los ganglios por palpación que en los estadificados quirúrgicamente (2,3%), ya sea mediante LDN profiláctica o por BSGG. Los pacientes ya tratados por metástasis linfáticas tienen un riesgo de recidiva del 19%10.
PrevenciónEl CEP es una enfermedad prevenible. En todos los pacientes con fimosis, que impida una exploración adecuada y una buena higiene del glande, debería realizarse una postectomía.
Dado que la infección por VPH, sobre todo por VPH 16, desempeña un papel etiológico fundamental en algunos subtipos de CEP, las vacunas antipapilomavirus podrían tener efectos beneficiosos si se administrasen en los varones antes de iniciar sus primeras relaciones sexuales. Hasta la fecha existen dos vacunas para el VPH, una bivalente frente a los genotipos 16 y 18 y una tetravalente frente a VPH 16, 18, 6 y 11. Sin embargo, dado que la incidencia de CEP es mucho menor que la de cáncer de cérvix, es difícil que se recomiende de forma sistemática a todos los niños. Además, es una patología mucho más prevalente en países subdesarrollados, donde las posibilidades de vacunar a grandes colectivos son mínimas. Aunque el uso del preservativo no protege al 100% frente a la infección por el VPH, se ha demostrado que reduce el riesgo de transmisión y acorta el tiempo de curación de las lesiones producidas por el virus72.
ConclusionesLa creación de equipos multidisciplinares con urólogos, dermatólogos, patólogos y biólogos moleculares ayudará a comprender los mecanismos oncogénicos subyacentes del CEP, permitiendo el correcto diagnóstico de las lesiones iniciales, la identificación de factores pronósticos, la implantación de campañas de prevención y la identificación de dianas moleculares que optimizarán su tratamiento, aumento de la supervivencia y reducirán la morbilidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.