El penfigoide anti-p200 es una enfermedad ampollosa subepidérmica autoinmune infrecuente, asociada a la presencia de anticuerpos circulantes de tipo IgG dirigidos frente a la laminina gamma-1, una proteína de 200kDa localizada en la lámina lúcida de la membrana basal. Revisamos las características clínicas, histopatológicas e inmunológicas de los 2 primeros casos descritos en España. El penfigoide anti-p200 comparte hallazgos histopatológicos e inmunopatológicos con la epidermólisis ampollosa adquirida, su principal diagnóstico diferencial. Sin embargo, su manejo sigue las mismas pautas descritas para el penfigoide ampolloso. El diagnóstico se confirma mediante inmunoblot, una técnica compleja y accesible en pocos centros. Proponemos la detección mediante inmunohistoquímica del colágeno iv en el suelo de la ampolla, combinándola con las técnicas habituales de inmunofluorescencia, como alternativa sencilla y disponible, para diferenciarlo de la epidermólisis ampollosa adquirida.
Anti-p200 pemphigoid is a rare autoimmune subepidermal blistering disease characterized by the presence of circulating immunoglobulin G antibodies directed against laminin gamma-1, a 200-kDa protein located in the lamina lucida of the basement membrane. We review the clinical, histopathological and immunological characteristics of the first 2 cases described in Spain. Anti-p200 pemphigoid shares histopathological and immunopathological findings with epidermolysis bullosa acquisita, the main entity in the differential diagnosis. However, its management follows the same guidelines as those used for bullous pemphigoid. The diagnosis is confirmed by immunoblotting, which is a complex technique available in few centers. We propose the immunohistochemical detection of collagen type IV on the floor of the blister, combined with standard immunofluorescence techniques, as a simple, accessible alternative to differentiate anti-p200 pemphigoid from epidermolysis bullosa acquisita.
El penfigoide anti-p200 es una enfermedad ampollosa subepidérmica autoinmune descrita por Zillikens et al. en 19961, a raíz del caso de un varón de 54 años con una erupción ampollosa generalizada, asociada a la presencia de anticuerpos IgG frente a una proteína de 200kDa localizada en la porción inferior de la lámina lúcida. Posteriormente se han publicado 91 casos adicionales, siendo la incidencia real desconocida2.
Presentamos los 2 primeros casos descritos en España.
Casos clínicosCaso 1Se trata de un varón de 65 años, con antecedentes de arteritis de Horton tratada con glucocorticoides orales a dosis bajas y de penfigoide ampolloso (PA) diagnosticado 3 años atrás en otro centro. Acudió a nuestro departamento por un nuevo brote de lesiones pruriginosas. La exploración física evidenció ampollas tensas y placas urticariformes de predominio en las extremidades inferiores, con elementos aislados en el tronco, sin afectación de las mucosas.
La biopsia de piel lesional evidenció una ampolla subepidérmica y un infiltrado inflamatorio compuesto por neutrófilos a lo largo de la membrana basal (MB), con microabscesos papilares de neutrófilos y algún foco de espongiosis eosinofílica. En la inmunofluorescencia (IF) directa se observaron depósitos lineales de C3 e IgG en la MB. En la IF indirecta sobre piel separada con cloruro sódico 1M se detectaron anticuerpos IgG circulantes dirigidos contra la MB en su parte dérmica (fig. 1). La detección de anticuerpos anti-BP180 y anti-colágeno vii por ELISA fue negativa. En el inmunoblot con extractos dérmicos de piel humana, realizado según métodos descritos previamente, se detectaron anticuerpos IgG frente a una proteína de 200kDa (fig. 2)3. Se inició tratamiento con clobetasol tópico según la pauta para el PA moderado-grave4, y se mantuvo la dosis de prednisona (10mg/día) para su arteritis, con buena respuesta. El paciente presentó un nuevo brote de ampollas al disminuir la dosis de corticoides orales a 5mg/día. Se aumentó la prednisona a 20mg/día y se añadió dapsona 50mg/día con mejoría clínica. Finalmente se mantuvo libre de lesiones con dapsona 75mg/día y prednisona 7,5mg/día.
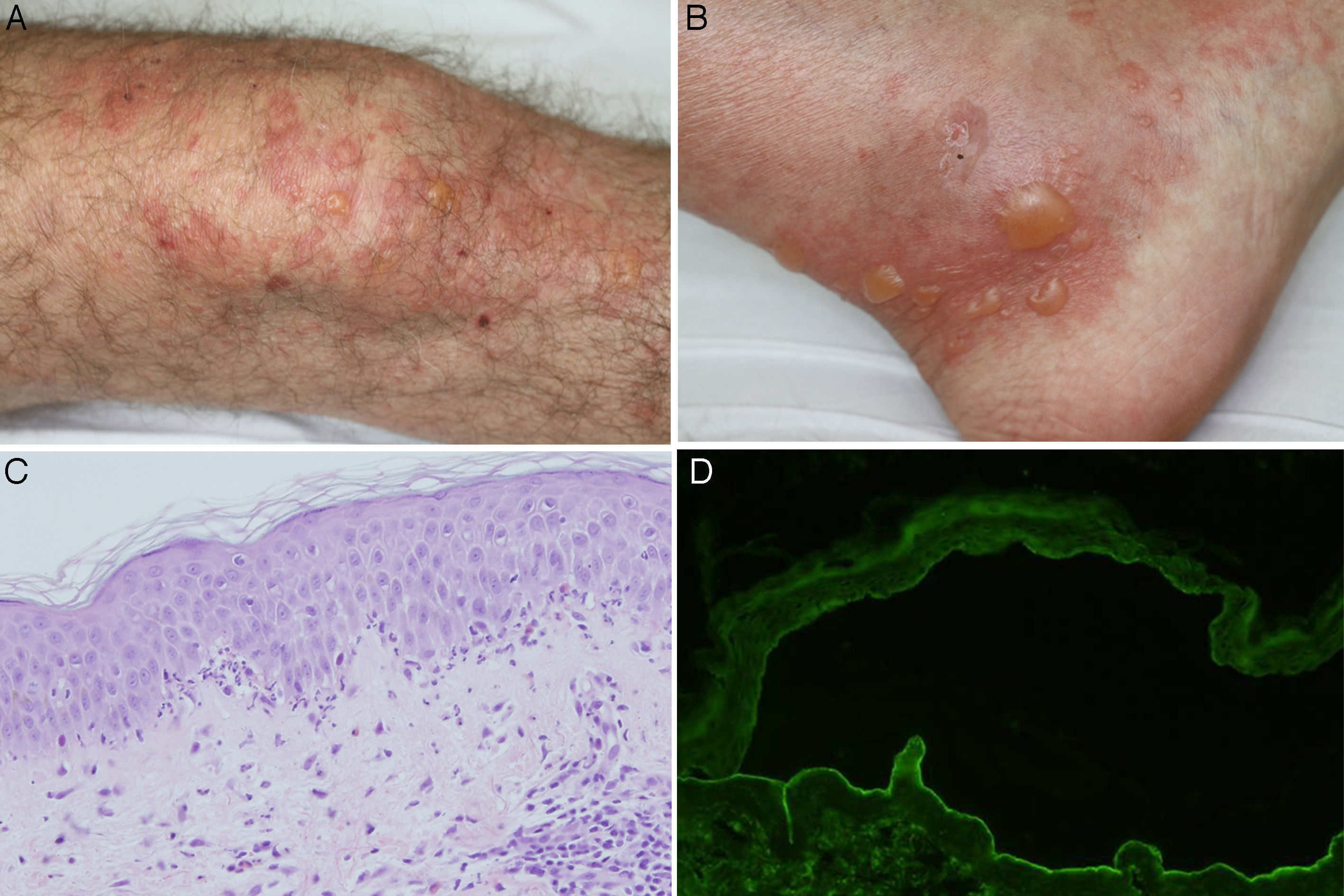
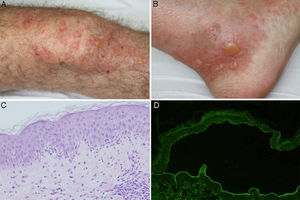
A y B. Ampollas tensas sobre una base urticariforme localizadas en la rodilla y en el tobillo. C. Infiltrado neutrofílico con algunos eosinófilos a lo largo de la membrana basal, con formación de microabscesos papilares (hematoxilina-eosina ×200). D. Presencia de anticuerpos de clase IgG dirigidos contra el lado dérmico de la ampolla en la inmunofluorescencia indirecta sobre piel separada con cloruro sódico 1M (dilución de anticuerpos de 1/40).
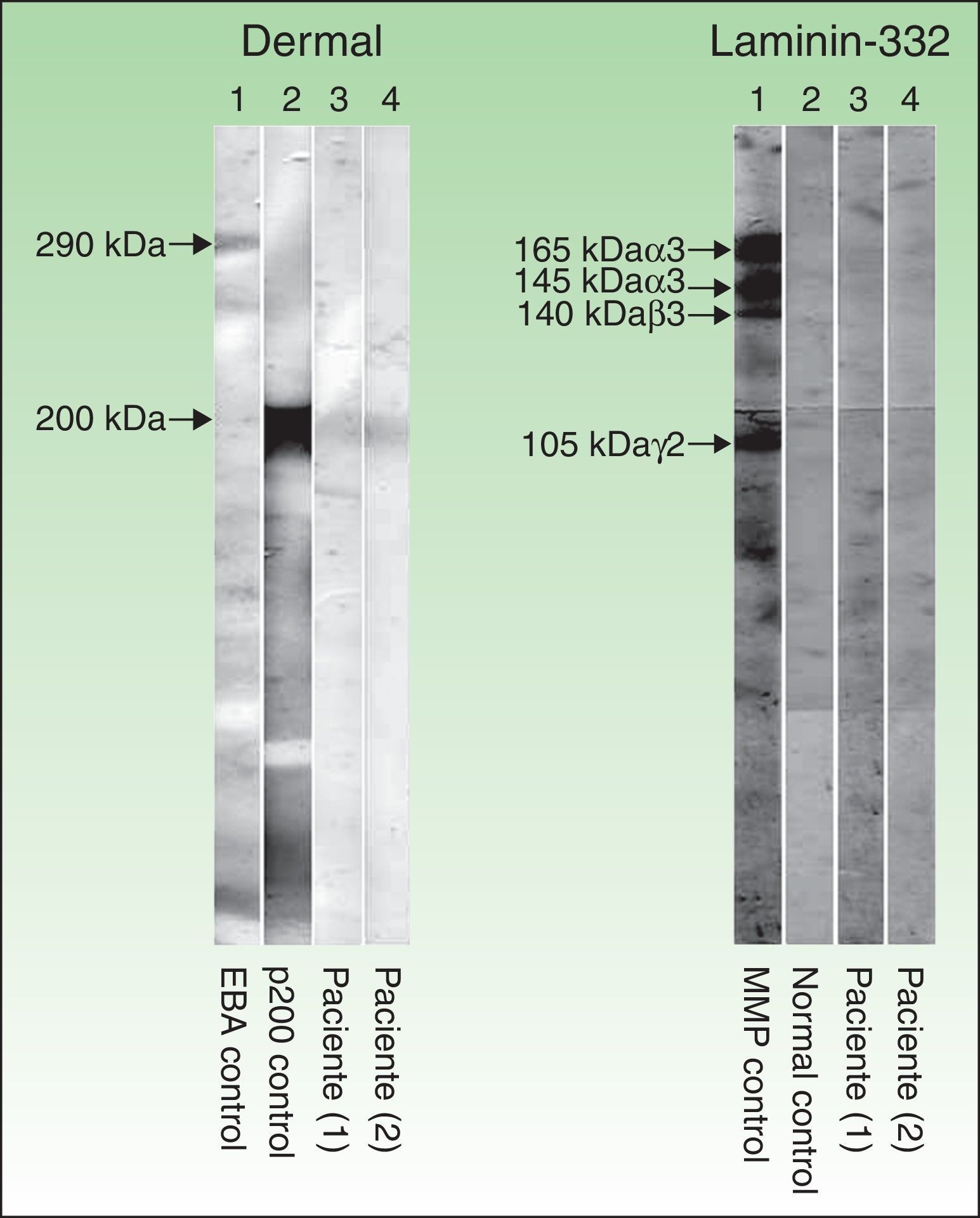
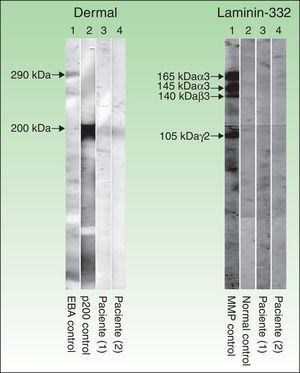
Técnica de inmunoblot realizada con extractos dérmicos de piel humana, obtenidos mediante piel separada con ácido tetracético etilendiamina y sometidos a electroforesis en gel de SDS-poliacrilamida, según el método de Laemmli (izquierda), así como inmunoblot con laminina 332 recombinante (derecha). En la parte izquierda (extractos dérmicos de piel humana) se observa que los sueros de los pacientes 1 y 2 (corresponden a las columnas 3 y 4 respectivamente) reconocen una banda de 200kDa que se corresponde con la misma banda que detecta el suero de otro paciente con penfigoide anti-p200 (columna 2), mientras que el suero de un paciente con epidermólisis ampollosa adquirida (columna 1) no detecta dicha banda, pero sí una de 290kDa, correspondiente al colágeno vii. En la parte derecha (laminina 332 recombinante) se observa que el suero de los pacientes 1 y 2 (columnas 3 y 4), al igual que el suero control sano (columna 2), no detectan la proteína recombinante, mientras que el suero de un paciente con penfigoide anti-laminina 332 (columna 1) detecta varias bandas de 165, 145, 140 y 105kDa, que corresponden a las cadenas α3, β3, y γ2 de la laminina 332, respectivamente.
Un varón de 43 años con antecedentes de psoriasis en placas. Dieciséis meses antes, coincidiendo con un evento estresante, había presentado un brote de ampollas tensas en la cara, el cuero cabelludo, los genitales y las ingles, sin afectación de las mucosas, para el cual había recibido tratamiento con prednisona a dosis de 0,5mg/kg/día, con remisión del mismo. Posteriormente había presentado nuevos brotes de lesiones, para los que había realizado tratamiento con ciclosporina (sin éxito) en otro centro, respondiendo finalmente a dosis altas de dapsona (200mg/día).
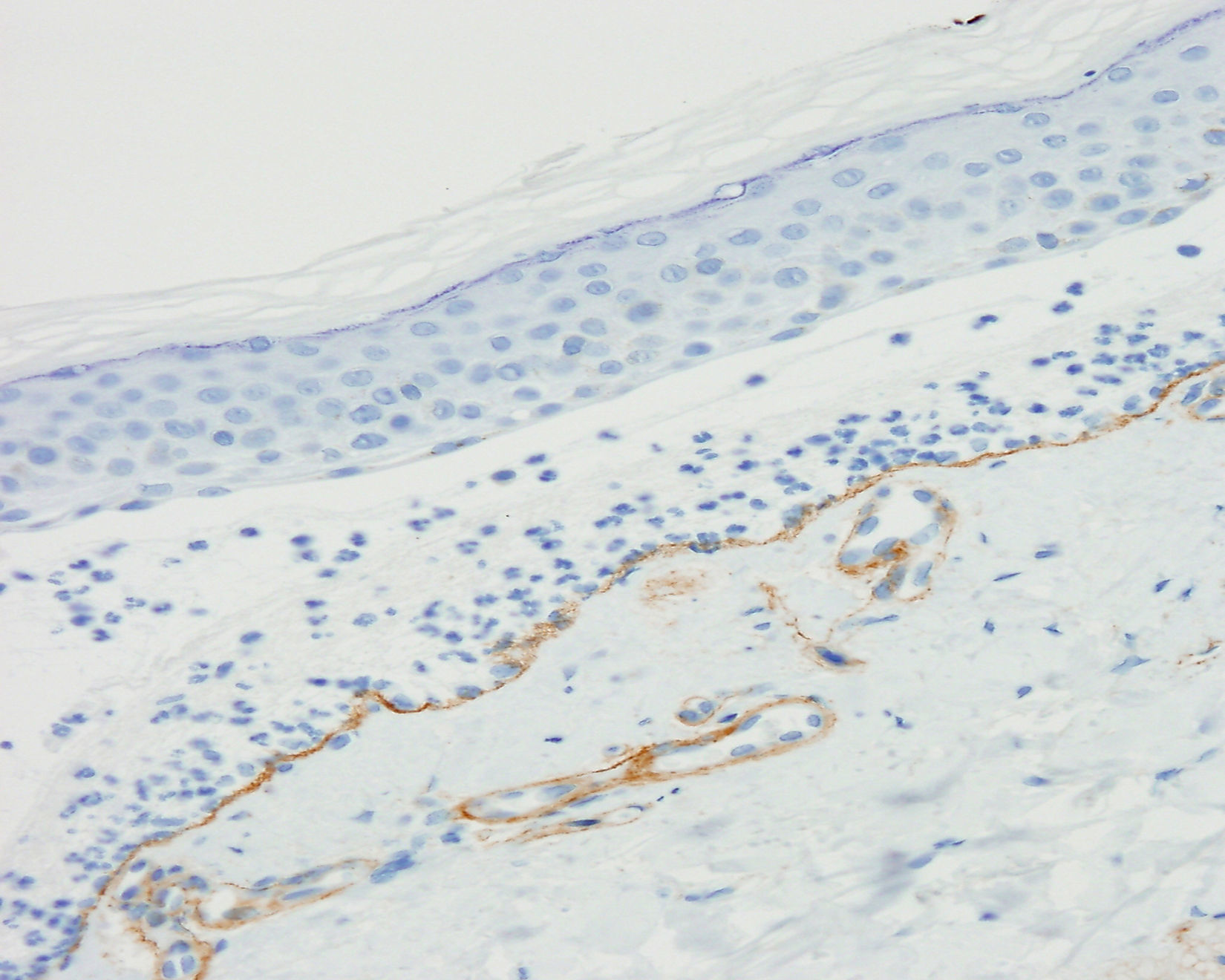
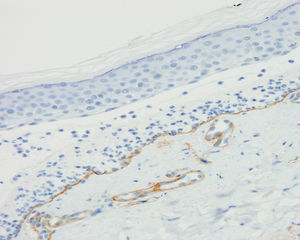
La exploración física en su primera visita evidenció múltiples placas eritemato-descamativas en el tronco y en las extremidades, correspondientes a lesiones de psoriasis, junto con máculas y placas hiperpigmentadas de predominio en las extremidades superiores. En la biopsia cutánea se observó una ampolla subepidérmica con abundantes polimorfonucleares y microabscesos de neutrófilos en papilas dérmicas. Los resultados de las IF directa e indirecta y de los ELISA anti-BP180 y anti-colágeno vii fueron idénticos a los descritos en el primer paciente (fig. 3). Se realizó además un estudio inmunohistoquímico para colágeno iv con el bloque de parafina, y a diferencia del paciente anterior, se observó un marcaje intenso del suelo de la ampolla (fig. 4). El inmunoblot confirmó el diagnóstico de penfigoide anti-p200 (fig. 2).
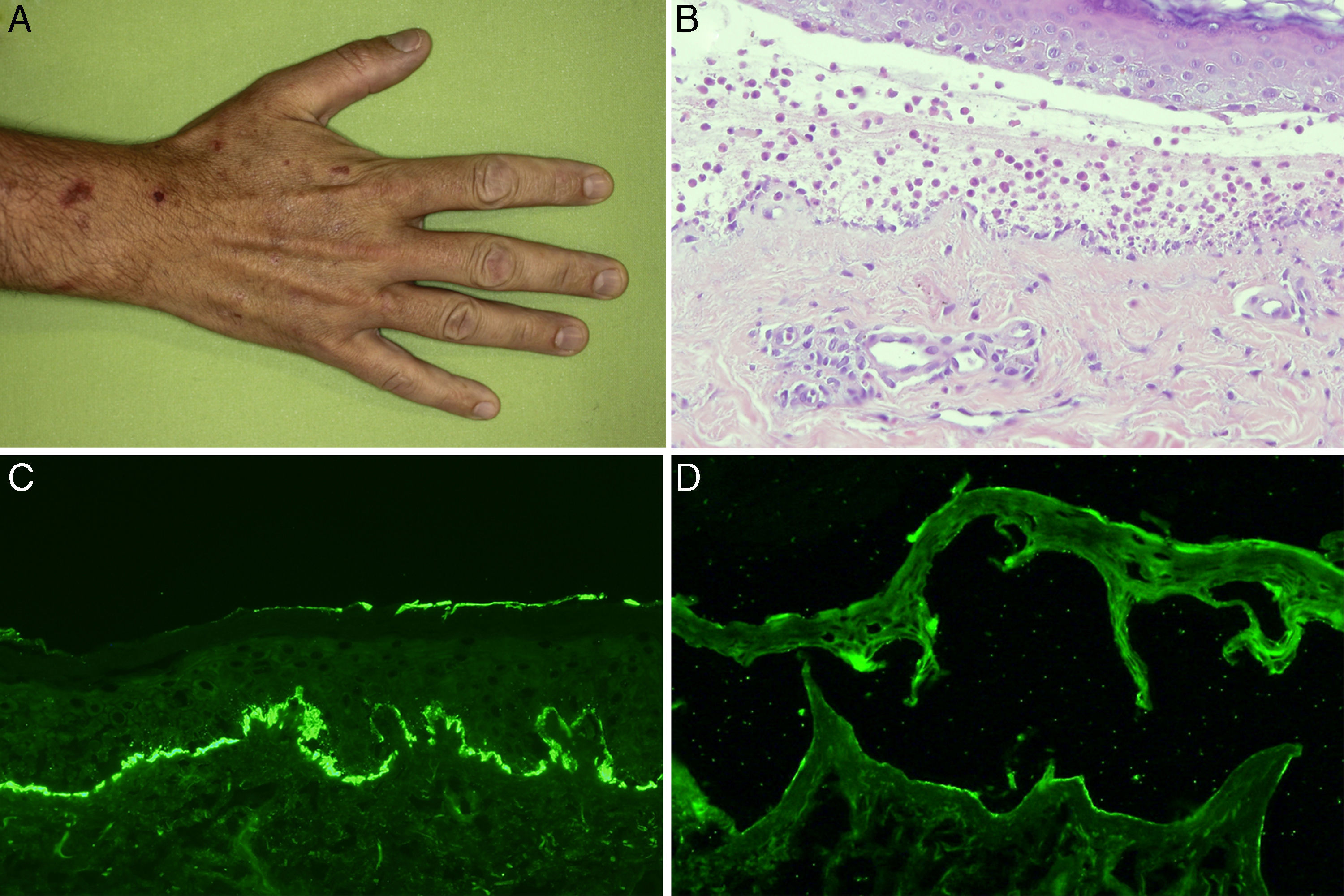
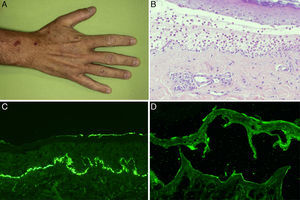
A. Máculas y placas hiperpigmentadas en la mano. B. Ampolla subepidérmica con abundantes polimorfonucleares en su interior (hematoxilina-eosina, ×200). C. Depósito lineal en membrana basal de C3 en la inmunofluorescencia directa. D. Marcaje débil de anticuerpos de clase IgG dirigidos contra el lado dérmico de la ampolla en la inmunofluorescencia indirecta sobre piel separada con cloruro sódico 1M (dilución de anticuerpos de 1/10).
Dada la práctica remisión de las lesiones con dapsona 200mg/día y la mala tolerancia del paciente por presentar astenia, se redujo progresivamente su dosis hasta suspenderla, con aparición intermitente de alguna vesícula aislada resuelta mediante glucocorticoides tópicos potentes.
DiscusiónEl penfigoide anti-p200 es una enfermedad ampollosa de reciente descripción1,2,5,6. Los pacientes suelen ser adultos de edad media (<65años) con ampollas tensas y placas urticariformes pruriginosas generalizadas, con características clínicas similares al PA o la forma inflamatoria de la epidermólisis ampollosa adquirida (EAA)2,5,6. En aproximadamente el 20% de los casos se observan lesiones mucosas2,5,6. Las ampollas suelen resolverse sin dejar cicatrices o quistes de milium2,5. Se ha observado una alta prevalencia de psoriasis (30%)2,5–7. Algunos casos se han relacionado con fármacos (penicilina) o la fototerapia PUVA6,8.
Los hallazgos histopatológicos característicos son la presencia de una ampolla subepidérmica acompañada de un infiltrado inflamatorio en la dermis superficial, habitualmente neutrofílico, y menos frecuentemente eosinofílico2,5,6,9. Ocasionalmente pueden observarse microabscesos de neutrófilos en las papilas dérmicas y espongiosis neutrofílica o eosinofílica2,5,6,9.
Los estudios de IF directa revelan depósitos lineales de C3 y/o IgG en la MB. La IF indirecta sobre piel separada con cloruro sódico 1M evidencia anticuerpos circulantes de clase IgG dirigidos contra el lado dérmico de la ampolla, aunque ocasionalmente se han observado depósitos a ambos lados1,2,5,6,9.
El diagnóstico se establece mediante el inmunoblot con extractos dérmicos de piel humana, en el que el suero de los pacientes reacciona contra una proteína de 200kDa1,2,5. En un 25% de los casos se ha objetivado una reactividad más débil con otros antígenos, como el BP180, el BP230 o la laminina 332, lo que podría explicarse por un fenómeno de expansión intermolecular de epítopos2,5,6,10. El inmunoblot es una técnica compleja disponible en pocos laboratorios, lo que probablemente ha limitado el diagnóstico de algunos casos de penfigoide anti-p200.
El estudio inmunohistoquímico de los componentes de la MB en biopsias de ampollas recientes fijadas en parafina, permite localizar habitualmente el colágeno iv (que marca la lámina densa) en el lado dérmico de la ampolla, ayudando al diagnóstico cuando el inmunoblot no está disponible9.
En el momento actual persisten importantes incógnitas respecto a la etiopatogenia del penfigoide anti-p2002. El antígeno p-200 es una proteína no colágena, localizada en la interfase entre la lámina lúcida y la lámina densa de la MB. Recientemente se ha identificado la laminina gamma-1 como el autoantígeno en el 90% de los casos, con un epítopo localizado en el residuo del aminoácido 246 carboxiterminal5,7,11. Sin embargo, todos los intentos por demostrar la patogenicidad de los anticuerpos contra la fracción carboxiterminal de la laminina gamma-1 han resultado fallidos12–14.
El diagnóstico diferencial debe establecerse con otras enfermedades ampollosas subepidérmicas con depósitos de C3 y/o IgG lineales en la IF directa, principalmente con el PA y la EAA2,5. La IF indirecta sobre piel separada (o la IF directa sobre piel separada cuando no se detecten anticuerpos circulantes) nos permite distinguirlo del PA, pero no de la EAA. En estos casos, la inmunohistoquímica para el colágeno iv es una técnica sencilla que nos permitiría diferenciar el penfigoide anti-p200 de la EAA: encontraríamos el colágeno iv en el suelo de la ampolla en el primero y en el techo en la segunda. Sin embargo, esta puede no ser informativa en casos con intensos infiltrados inflamatorios9. Estos hallazgos no son patognomónicos y para establecer un diagnóstico inequívoco resulta imprescindible la realización de un inmunoblot o incluso técnicas más complejas, como la inmunoprecipitación2,5,7.
Respecto al tratamiento, se siguen las pautas propuestas para el PA: corticoides tópicos potentes, prednisona 0,5mg/kg en monoterapia o en combinación con dapsona (1,5mg/kg)2,5,15. La evolución del cuadro es variable, pero en general suele responder de forma rápida y favorable a los inmunosupresores2,5.
En conclusión, presentamos los 2 primeros casos de penfigoide anti-p200 descritos en nuestro país caracterizados clínica, patológica e inmunológicamente. Dadas las dificultades técnicas que plantea su diagnóstico parece probable que el penfigoide anti-p200 esté infradiagnosticado, habiendo casos erróneamente clasificados como PA o EAA. La diferenciación con esta última resulta especialmente importante, ya que ambas entidades presentan diferencias significativas respecto al manejo terapéutico y al pronóstico. Proponemos la inmunohistoquímica con colágeno iv sobre piel lesional, combinándola con las técnicas habituales de IF, como una herramienta sencilla y accesible para el diagnóstico diferencial con la EAA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio ha sido parcialmente financiado con cargo al proyecto de investigación PI 09/1410 del ISCIII (a J. Herrero), con cofinanciación del FEDER.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Deseamos expresar nuestro agradecimiento a la Dra. María Teresa Fernández Figueras y al Dr. Josep Palou Aymerich, por su valiosa colaboración cediéndonos los bloques de parafina de los pacientes para la realización de nuevos cortes, posibilitando la realización del estudio inmunohistoquímico con colágeno iv.