El erlotinib es un inhibidor del factor de crecimiento epidérmico humano aprobado en el tratamiento del cáncer de pulmón no microcítico. El objetivo de este estudio prospectivo y observacional es determinar la prevalencia de los efectos cutáneos adversos por erlotinib y su manejo.
MétodosOnce pacientes con cáncer de pulmón y una con cáncer de ovario fueron tratados con erlotinib en dosis de 150 mg diarios. Se evaluó la prevalencia, la intensidad y la cronología de los efectos cutáneos adversos.
ResultadosLa reacción cutánea más frecuente fue la erupción acneiforme (10 casos). Los pacientes fueron tratados con eritromicina o clindamicina tópicas, o con doxicilina. Los pacientes también desarrollaron dermatitis seborreica (5), paroniquia (4), xerosis (3), aftas orales (3), blefaritis (2), queilitis (1) y fisuras en manos y pies (1). Los efectos adversos más precoces fueron la dermatitis seborreica (9,8 días hasta la aparición) y la erupción acneiforme (11,8 días), mientras que la paroniquia fue el efecto más tardío (65,3 días). Un paciente con erupción acneiforme y otro con paroniquia suspendieron el tratamiento con erlotinib hasta la mejoría de las lesiones.
ConclusionesEl erlotinib produce efectos cutáneos adversos en la gran mayoría de los pacientes tratados. La erupción acneiforme, la dermatitis seborreica y la paroniquia son los efectos más frecuentes, que pueden llevar a interrumpir temporalmente la administración de erlotinib.
Erlotinib is an inhibitor of human epidermal growth factor approved for treating non-small cell lung cancer. The aim of this prospective observational study was to determine the prevalence of adverse cutaneous reactions caused by erlotinib and assess the management of such effects.
MethodsEleven patients with lung cancer and 1 with ovarian cancer received erlotinib at a dose of 150mg/d. The prevalence, severity, and time course of the adverse cutaneous reactions were assessed.
ResultsThe most frequent cutaneous reaction was acneiform eruption (10 cases). The patients were treated with topical erythromycin and clindamycin, or with doxycycline. Also reported were seborrheic dermatitis (5), paronychia (4), xerosis (3), mouth blisters (3), blepharitis (2), cheilitis (1), and fissures on the hands and feet (1). The first reactions to appear were seborrheic dermatitis (9.8 days until onset) and acneiform eruption (11.8 days), whereas the paronychia presented latest (65.3 days). One patient with acneiform eruption and another with paronychia suspended treatment until the lesions improved.
ConclusionsErlotinib induces adverse effects in most patients treated. Acneiform eruption, seborrheic dermatitis, and paronychia are the most frequently reported reactions and can lead to temporary suspension of erlotinib administration.
En los últimos años se han desarrollado nuevas moléculas en el tratamiento contra el cáncer. Algunos de estos fármacos inhiben la actividad del factor de crecimiento epidérmico (FCE), cuyos niveles se encuentran incrementados en algunos tumores sólidos, de forma que se produce una activación autocrina de la neoplasia1. La inhibición del FCE se puede conseguir mediante el bloqueo directo de su receptor (RFCE) con anticuerpos monoclonales, como cetuximab (Erbitux®, C225)2, o bien mediante inhibidores de la tirosinquinasa asociada al RFCE, como gefitinib (Iressa®, ZD1939), erlotinib (Tarceva®, OSI774)3–5 o lapatinib6. Estos fármacos presentan un mejor perfil de seguridad respecto a los quimioterápicos habituales, sin efectos adversos a nivel hematopoyético. Los efectos adversos que se asocian con mayor frecuencia a los inhibidores del RFCE son las reacciones cutáneas y la diarrea7, en particular un exantema pápulo-pustuloso localizado en la cara y la zona centrotorácica que aparece tras la primera semana de tratamiento.
Los efectos cutáneos relacionados con cetuximab y con gefitinib han sido estudiados anteriormente con detalle8–17. Erlotinib (Tarceva®, F. Hoffmann La Roche AG, Basel, Switzerland) ha sido aprobado por la EMEA y por la Agencia Española del Medicamento para pacientes con cáncer de pulmón no microcítico localmente avanzado o metastático tras el fallo, al menos, de un tratamiento quimioterápico anterior. Es un agente de reciente introducción, con un perfil de seguridad aparentemente similar al de otros inhibidores del RFCE. El objetivo del presente estudio es determinar la frecuencia, cronología y gravedad de las manifestaciones cutáneas adversas asociadas al empleo de erlotinib.
Pacientes y métodosUn total de 12 pacientes iniciaron un tratamiento con erlotinib en el servicio de oncología médica de nuestro hospital. Se trataba de 9 hombres y 3 mujeres con edades comprendidas entre los 29 y 67 años (media 52,9). Todos los pacientes presentaban un cáncer de pulmón, excepto una mujer con cáncer de ovario, en estadio III o IV que no había respondido a la quimioterapia convencional. Ninguno de los pacientes consumía otros fármacos que pudieran estar implicados en el desarrollo de los efectos cutáneos observados. Se administró erlotinib en una dosis diaria única de 150 mg por vía oral. Cada paciente fue visitado dos o más veces por un dermatólogo. La primera visita se realizaba a las dos semanas de tratamiento, y posteriormente cada 4 semanas para valorar la aparición de manifestaciones cutáneas tardías y la respuesta al tratamiento dermatológico. En cada visita se realizaba una exploración física completa de la superficie cutánea que incluía examen de las uñas, de la cavidad oral y del cuero cabelludo. Se valoró la localización, el tiempo de aparición desde el inicio del tratamiento con erlotinib y la gravedad. Esta se graduó según el baremo descrito en Common Terminology Criteria for Adverse Events v3.0 (CTCAE v3.0, disponible en http://ctep.cancer.gov/forms/CTCAEv3.pdf), del National Cáncer Institute.
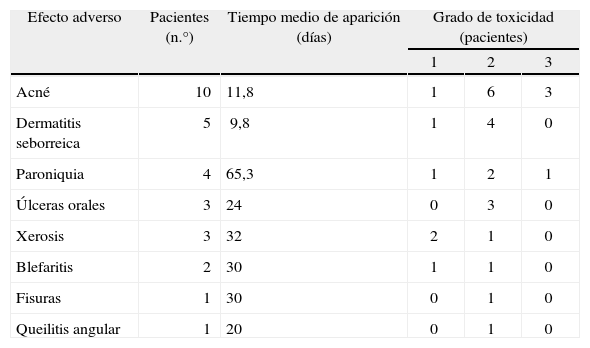
ResultadosSe observaron efectos adversos cutáneos en todos los pacientes incluidos en el estudio excepto en uno. Estos efectos adversos consistieron en erupción acneiforme, aparición o empeoramiento de dermatitis seborreica, paroniquia, xerosis cutánea, aftas orales, fisuras en talones o en dedos, blefaritis y queilitis angular (tabla 1). No se detectaron otros cambios mucocutáneos, que los previamente descritos, que se asociaran al uso de erlotinib. No se desarrollaron efectos adversos de gravedad 4 o 5.
Efectos mucocutáneos adversos por erlotinib
| Efecto adverso | Pacientes (n.°) | Tiempo medio de aparición (días) | Grado de toxicidad (pacientes) | ||
| 1 | 2 | 3 | |||
| Acné | 10 | 11,8 | 1 | 6 | 3 |
| Dermatitis seborreica | 5 | 9,8 | 1 | 4 | 0 |
| Paroniquia | 4 | 65,3 | 1 | 2 | 1 |
| Úlceras orales | 3 | 24 | 0 | 3 | 0 |
| Xerosis | 3 | 32 | 2 | 1 | 0 |
| Blefaritis | 2 | 30 | 1 | 1 | 0 |
| Fisuras | 1 | 30 | 0 | 1 | 0 |
| Queilitis angular | 1 | 20 | 0 | 1 | 0 |
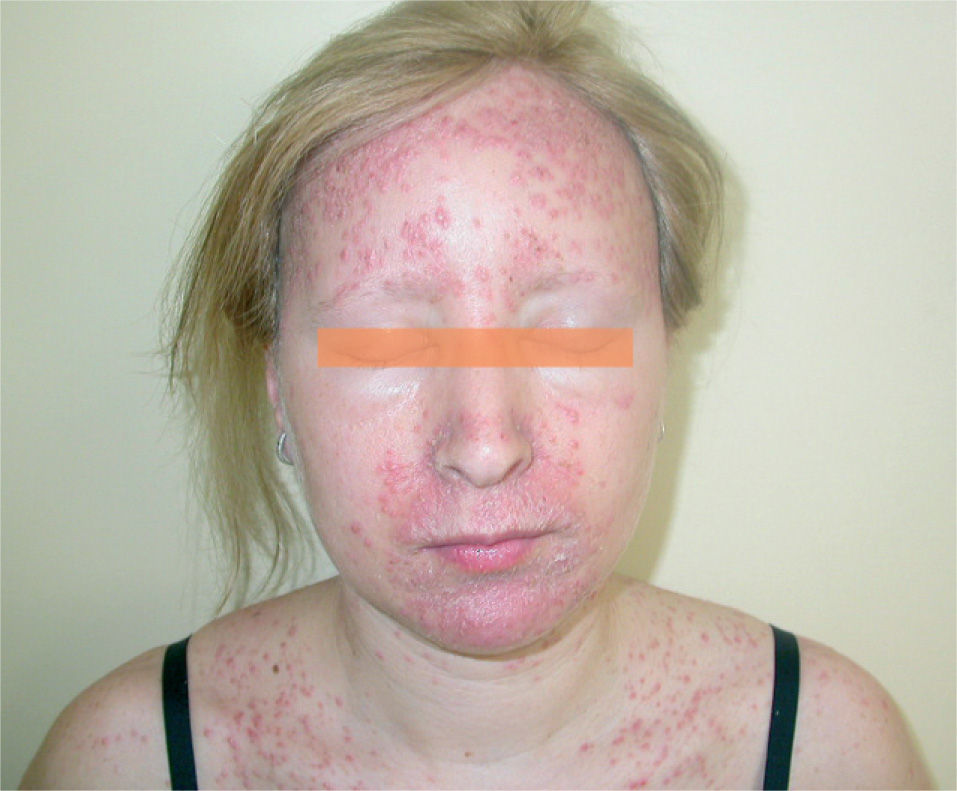
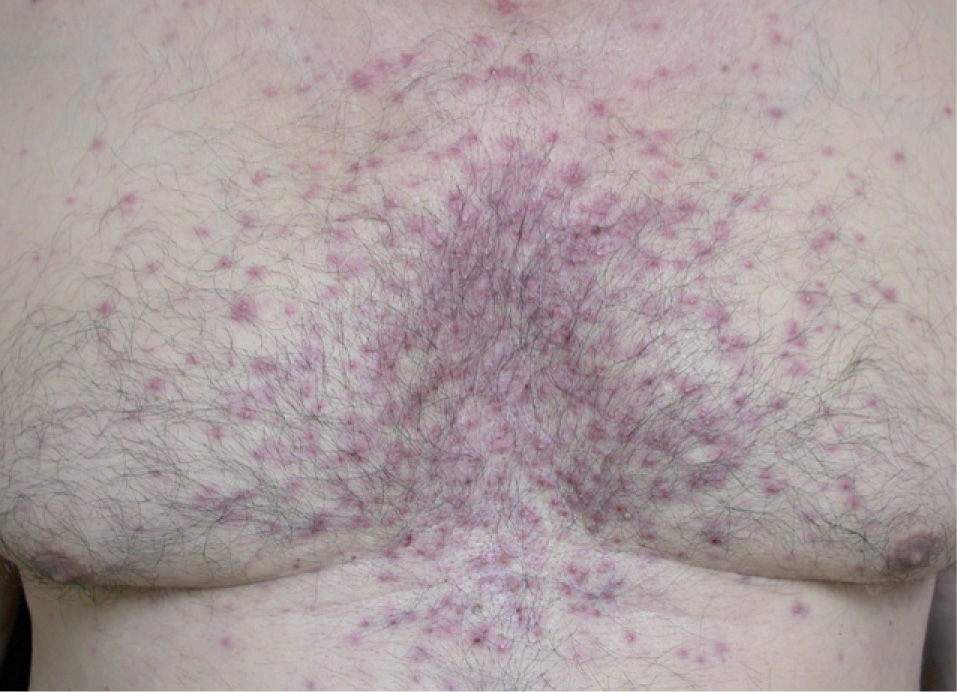
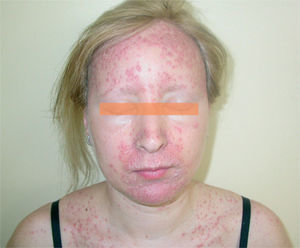
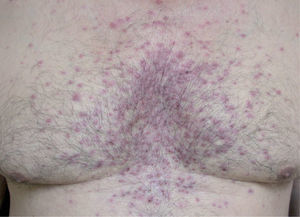
La erupción acneiforme consistía en pápulas inflamatorias y pústulas que se localizaban en todos los casos en el dorso de la nariz y en los surcos nasogenianos (fig. 1). En muchos pacientes se extendía a otras áreas de la cara como la frente y el mentón, cuero cabelludo, cuello y las áreas preesternal e interescapular (fig. 2). En el paciente con la erupción acneiforme más intensa se formaron costras hemorrágicas sobre las pústulas de la nariz. En este caso se retiró el tratamiento con erlotinib hasta que las lesiones cutáneas mejoraron. Al reintroducirse dos semanas después, la erupción acneiforme reapareció con una intensidad notablemente menor. Los pacientes con erupción acneiforme de grado 2 limitada a la cara fueron tratados con eritromicina o clindamicina de forma tópica. Aquellos con una erupción acneiforme de grado 2 extensa y de grado 3 fueron tratados con doxiciclina en dosis de 100 mg al día durante dos semanas o hasta la resolución de las lesiones. El desarrollo de lesiones acneiformes no parecía relacionarse con una mayor frecuencia o gravedad de los otros efectos cutáneos asociados a los inhibidores del RFCE.
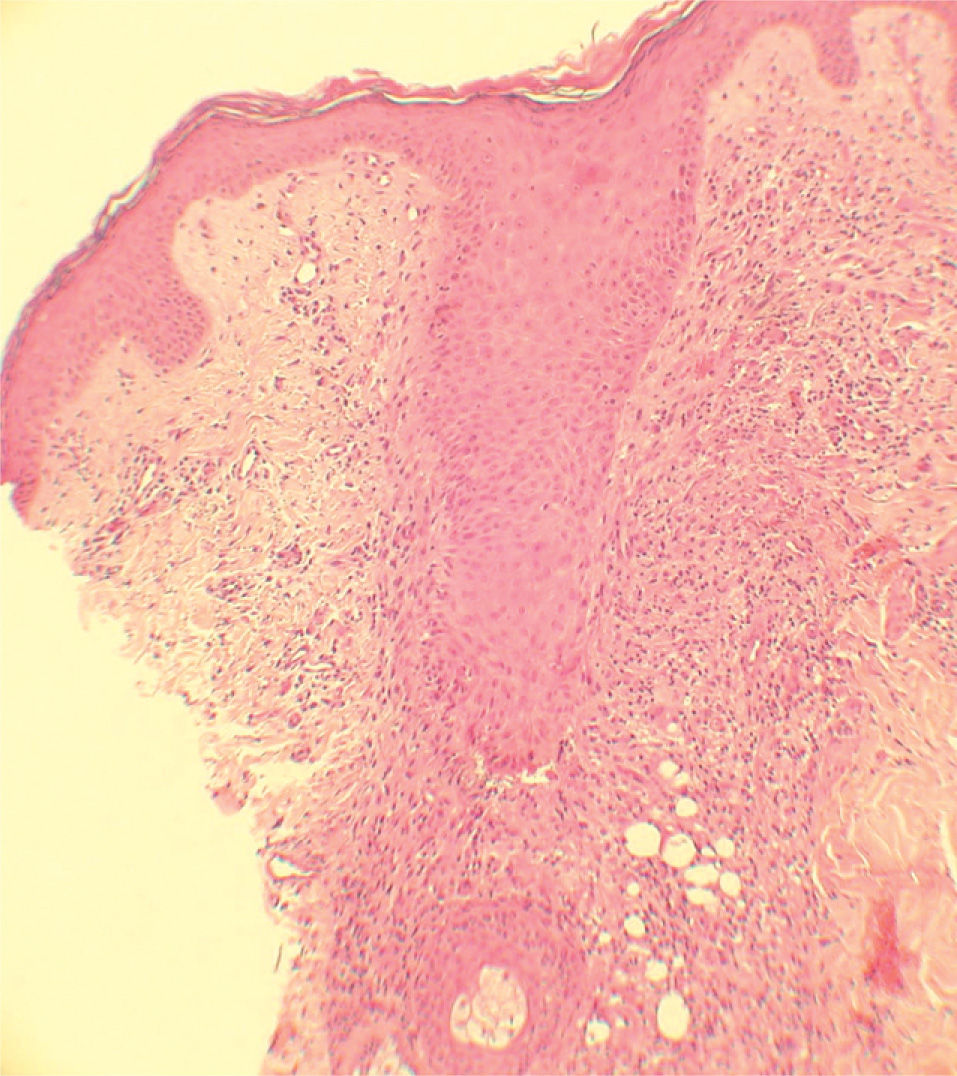
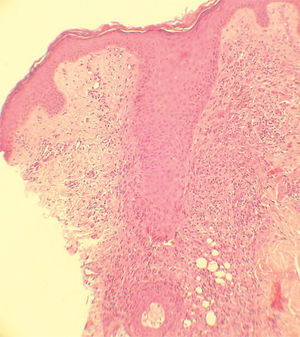
Se realizaron biopsias en sacabocado de las lesiones acneiformes en dos casos. En la biopsia del primer paciente destacaba una pústula subcórnea de neutrófilos. Se apreciaba una disminución del grosor de la capa córnea, disminución de la capa granulosa, vasodilatación capilar, infiltrado inflamatorio perivascular de predominio linfocitario con neutrófilos y extravasación de hematíes. En la segunda paciente se observaba un infiltrado linfohistiocitario que rodeaba el folículo pilosebáceo, con la formación de granulomas con células gigantes multinucleadas (fig. 3).
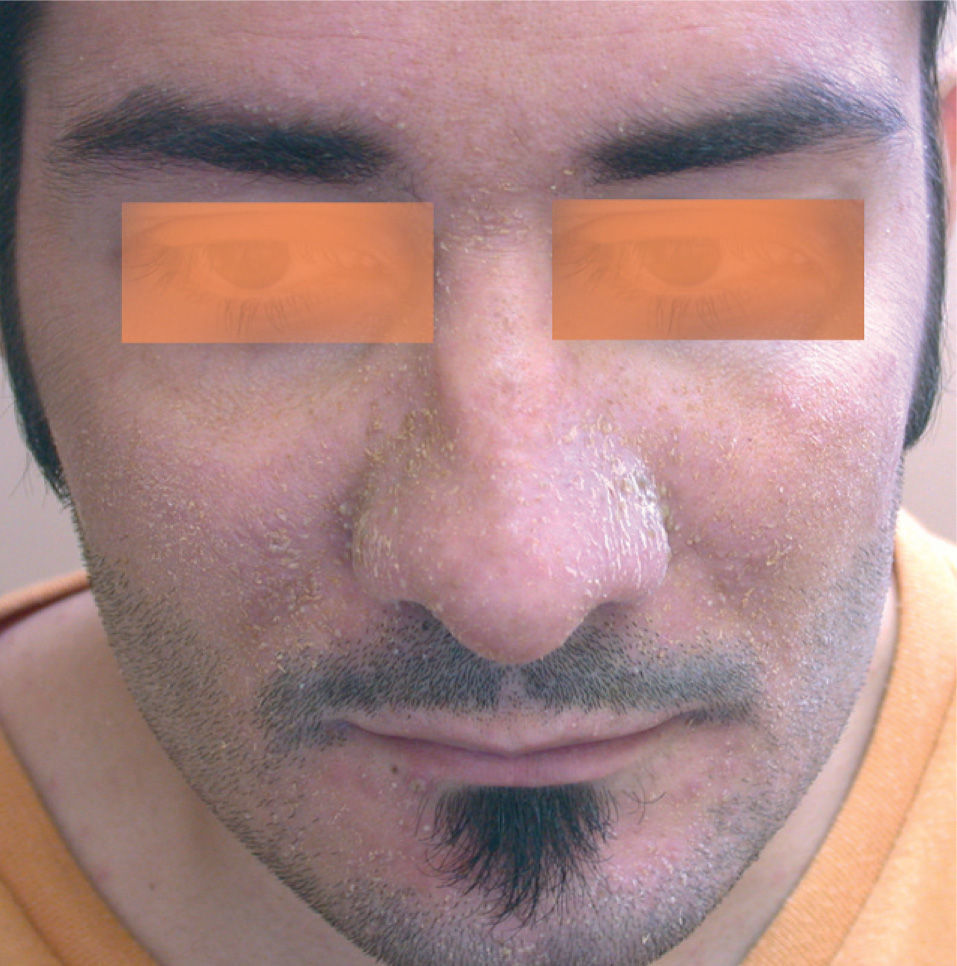
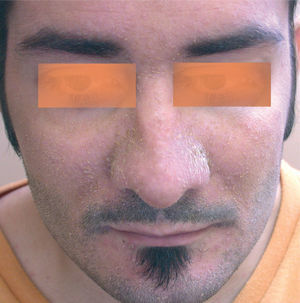
La segunda afectación cutánea más frecuente fue la erupción similar a dermatitis seborreica. Las áreas seborreicas de la cabeza estaban afectadas en la mayoría de los casos, como los surcos nasogenianos, la zona interciliar o la retroauricular (fig. 4). En un paciente con dermatitis seborreica leve previa limitada a la cara, aparecieron lesiones preesternales. En muchos casos se pudo observar en combinación de lesiones acneiformes, aunque la preeminencia de uno u otro componente fue muy variable. Los casos que presentaban un predominio claro de dermatitis seborreica fueron tratados con una emulsión de hidrocortisona y ketoconazol.
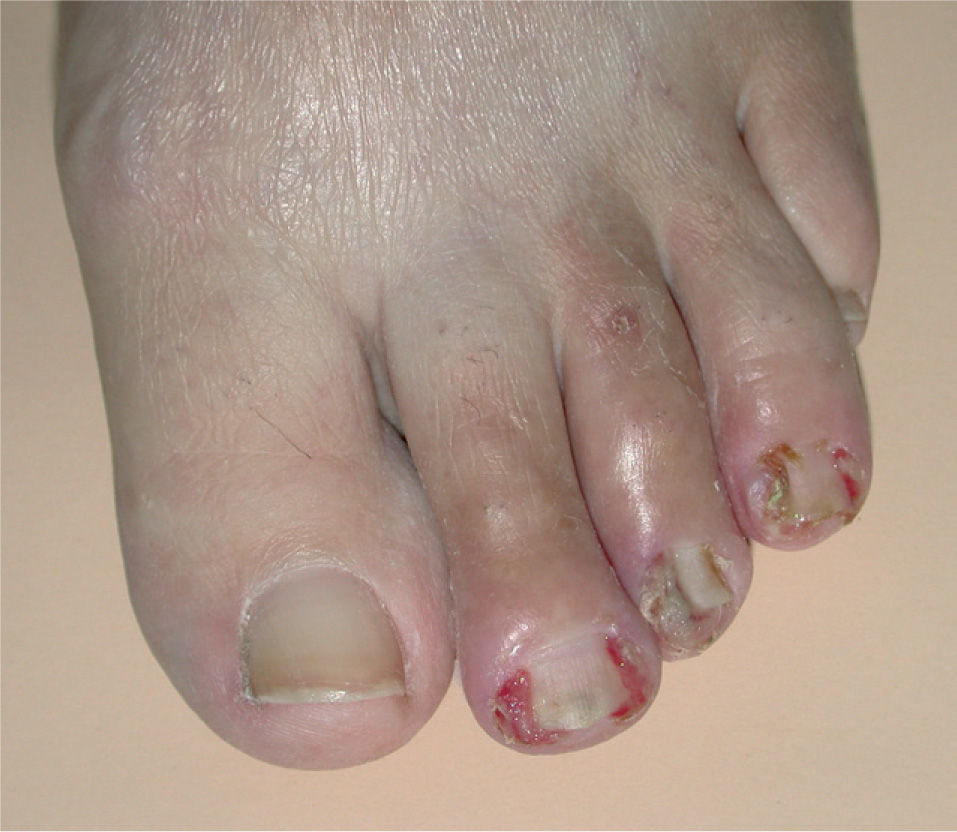
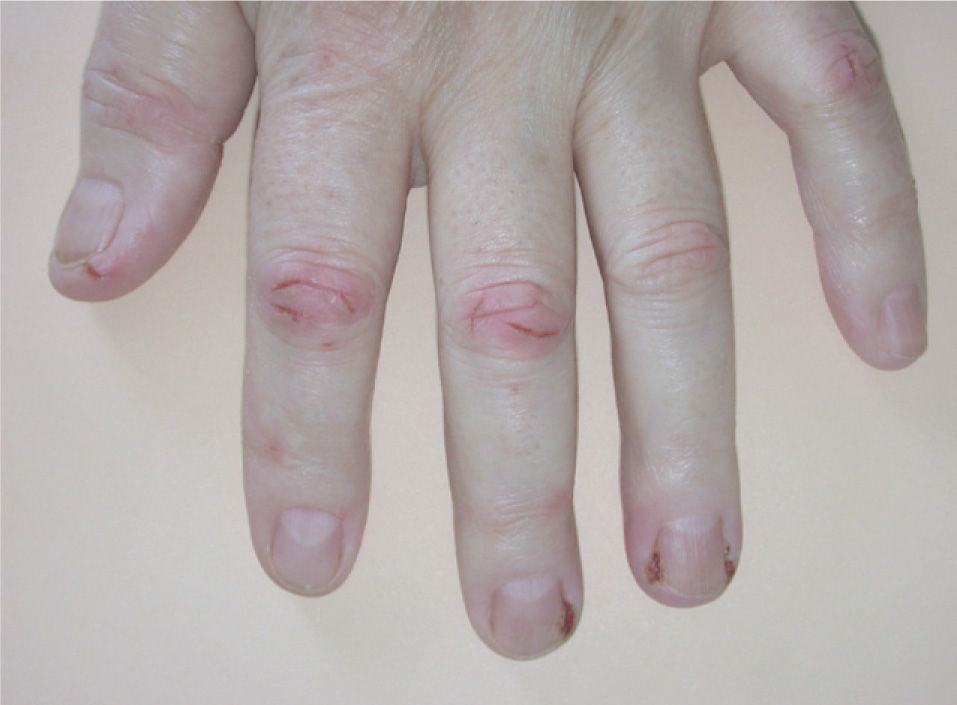
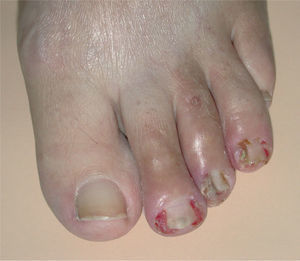
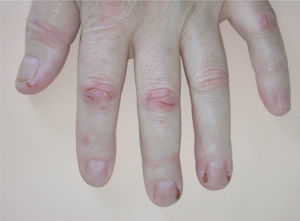
La paroniquia afectó tanto a los dedos de las manos como de los pies. La afectación ungueal podía ser única o múltiple, simultánea o consecutiva. Los pliegues periungueales estaban inflamados y desarrollaron en la mayoría de los casos granulomas piogénicos (fig. 5). Una paciente presentó paroniquia intensamente dolorosa con exudación que obligó a suspender temporalmente el tratamiento con erlotinib hasta la mejoría de las lesiones. En el cultivo del exudado se aisló S. aureus. Los pacientes fueron tratados con baños astringentes, antibióticos tópicos y antibióticos orales en los casos supurativos rebeldes al tratamiento previo. Con el fin de reducir el tejido exuberante se aplicó nitrato de plata.
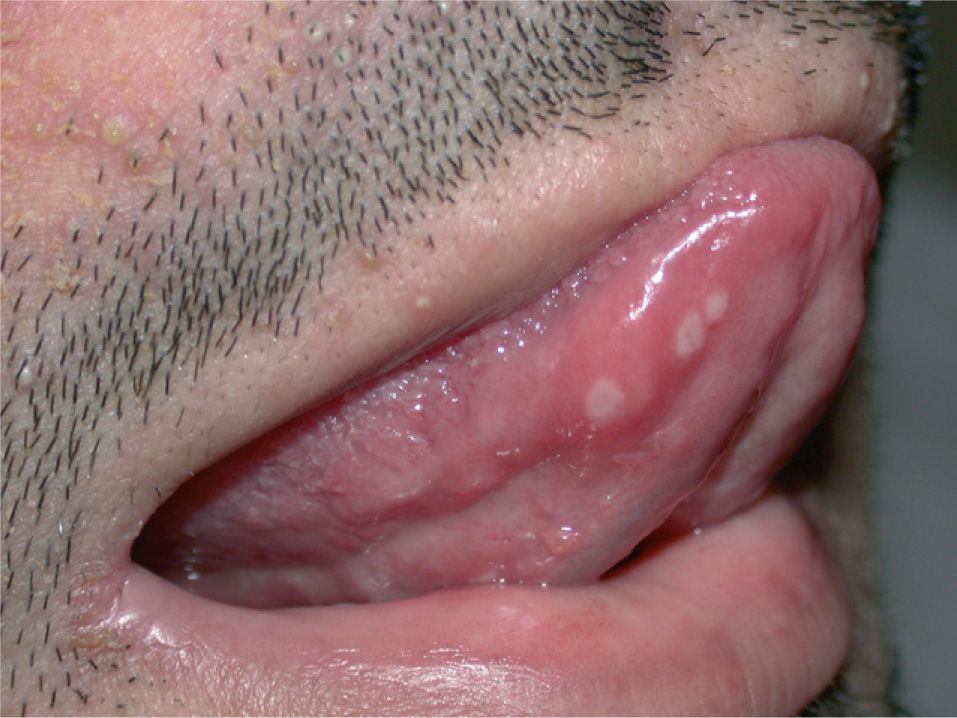
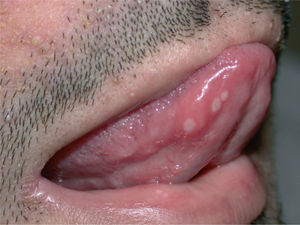
Las aftas orales eran de un diámetro aproximado de 2 mm, con fondo blanquecino, dolorosas aunque poco sintomáticas (fig. 6). Aparecieron tanto en la mucosa bucal como en la lengua, pero no en la mucosa nasal. La xerosis apareció en forma de eczema asteatósico y de sequedad cutánea generalizada. Una paciente presentó fisuras dolorosas en los talones y sobre las articulaciones interfalángicas de las manos (fig. 7). La blefaritis apareció en pacientes con erupción acneiforme, de forma simultánea a ésta.
Los pacientes no comunicaron trastornos en el crecimiento ni en la calidad del pelo. El único paciente que no presentó efectos adversos relacionados con el consumo de erlotinib desarrolló metástasis cutáneas del carcinoma epidermoide de pulmón, detectadas por el dermatólogo tras 8 semanas de tratamiento.
DiscusiónLos efectos adversos más frecuentes en pacientes tratados con inhibidores del RFCE son las manifestaciones cutáneas. Por su intensidad son, junto con la diarrea, limitantes de dosis18. Es necesario tratar correctamente estos efectos con el fin de mejorar la calidad de vida de los pacientes y su aceptación del tratamiento, así como para permitir el uso de estos fármacos en dosis mayores y durante períodos de tiempo prolongados. Sin embargo, no se han realizado estudios que evalúen la eficacia del manejo de estos efectos adversos, y sólo se dispone de comunicaciones de series cortas de pacientes. La tendencia a la resolución espontánea de estas lesiones hace todavía más difícil evaluar la eficacia de su tratamiento.
La erupción acneiforme es el efecto adverso cutáneo más frecuente con este grupo de fármacos. Erlotinib es el inhibidor del RFCE que con mayor frecuencia produce efectos adversos a nivel cutáneo, ya que se utiliza en la dosis máxima tolerada19. En un estudio realizado con 485 pacientes con cáncer de pulmón no microcítico tratados con erlotinib, el 75 % de los pacientes presentó una erupción, que en el 6 % de los casos precisó reducción de dosis y en el 1 % obligó a suspender el tratamiento19. La aparición de esta erupción ha recibido una especial atención de los oncólogos, puesto que su intensidad podría relacionarse con una mejor respuesta tumoral y un aumento de la supervivencia2,4,20,21. Se ha propuesto que la medida de la intensidad de esta erupción puede ser útil para ajustar la dosis de IFCE, con el fin de obtener una máxima respuesta tumoral21–23. Su etiopatogenia es desconocida, aunque podría deberse a la inhibición del receptor del RFEC a nivel de la epidermis y del folículo piloso. El RFEC se expresa preferentemente en la capa basal de la epidermis y en la vaina externa del folículo piloso, donde contribuye a la diferenciación y desarrollo folicular24. El acné inducido por los inhibidores del RFCE podría relacionarse con la hiperqueratosis folicular, taponamiento folicular, obstrucción del ostium folicular y alteración del ciclo de progresión del cabello, que conlleva la degeneración y destrucción del folículo, acompañadas de una intensa respuesta inflamatoria8. No se han encontrado datos que apoyen un origen infeccioso de las pústulas9,14.
El exantema predomina claramente en áreas seborreicas: cara (en particular surcos nasogenianos, nariz y mentón), cuero cabelludo, cuello, hombros y tórax, con predominio preesternal e interescapular. Se trata de pápulas y pústulas foliculares, con frecuencia pruriginosas. En algunos pacientes se desarrolla un eritema de base que acompaña a las pápulo-pústulas y simula una rosácea, o bien se acompaña de descamación que recuerda a una dermatitis seborreica. En los casos de mayor intensidad se pueden formar costras hemorrágicas sobre las pústulas13. Aparece tras la primera semana de tratamiento, alcanza su máxima intensidad tras dos o tres semanas, para desaparecer generalmente de forma progresiva y espontánea3,19. La intensidad del exantema y la rapidez de su aparición están directamente relacionadas con la dosis del fármaco administrado25. La mayoría de los casos de exantema por inhibidores del RFCE desarrolla una toxicidad de grado 1 ó 2, sólo en el 13 % de los pacientes de grado 3 y, de forma destacable, no se ha comunicado ningún caso de toxicidad cutánea con compromiso vital26. La ausencia de comedones, el aspecto monomórfico, la ausencia de quistes o nódulos, la resolución completa sin cicatrices deprimidas y el intenso prurito que en ocasiones acompaña a las lesiones diferencian a esta reacción pustulosa del verdadero acné, aunque la denominación de erupción acneiforme es la más extendida en el momento actual.
Los cambios histopatológicos de las lesiones por erlotinib, gefitinib y cetuximab son equivalentes. Según la literatura predomina un infiltrado neutrofílico en la dermis, particularmente alrededor del infundíbulo folicular. La capa córnea se adelgaza y compacta, y pierde su apariencia en «cesta de mimbre». En algunos casos se ha identificado una reacción liquenoide con apoptosis de queratinocitos, degeneración vacuolar de la basal e infiltrado mononuclear. Otros hallazgos observados son la acantolisis, paraqueratosis y extravasación de hematíes. Las glándulas sudoríparas y sebáceas son normales8–10,12–15,27.
Se ha descrito un tratamiento con antibióticos y antisépticos tópicos, como eritromicina, clindamicina o ácido fusídico, tretinoína en crema, ketoconazol y econazol en crema, peróxido de benzoilo en gel, corticoides tópicos, solución de povidona yodada, solución de hexamidina y antibióticos orales como minociclina o ácido fusídico8,12,13,15. Es preferible evitar productos formulados en gel o en solución, así como el ácido retinoico y salicílico, en pacientes con xerosis y descamación. Se ha descrito la desaparición espontánea y progresiva de las lesiones a pesar de continuar con el inhibidor del RFCE en la misma dosis13. En un estudio en el que se administró ácido fusídico oral y emulsión de eritromicina desde la primera dosis de cetuximab no aparecieron pápulas ni pústulas13. Se desaconseja el uso de isotretinoína oral, ya que podría agravar la xerosis y la paroniquia. Los antihistamínicos pueden ayudar cuando la erupción acneiforme es pruriginosa.
En esta serie de pacientes el acné fue el efecto adverso más frecuente. El uso de antibiótico en solución, eritromicina o clindamicina, no pareció ser efectivo. En cambio los pacientes tratados con doxiciclina experimentaron una notable mejoría, probablemente por su efecto antiinflamatorio, más que por la acción antibiótica28.
A pesar de ser un hallazgo muy frecuente en nuestros pacientes, en los trabajos previos se ha hecho poco hincapié en la erupción semejante a la dermatitis seborreica. Aquellos pacientes que desarrollaron una erupción extensa, de grado 2 y 3, parece que son los que previamente padecían una dermatitis seborreica leve o moderada; por lo cual este fármaco agravaría dicha patología en sujetos predispuestos. La aparición de lesiones seborreicas y acneiformes con una distribución y evolución temporal parecidas sugiere que comparten el mismo mecanismo patogénico, seguramente relacionado con la expresión de RFCE en la unidad pilosebácea29,30. Hemos preferido evaluar estas lesiones como una manifestación a parte de la erupción acneiforme, puesto que en algunos pacientes la imagen clínica es claramente diferenciable, si bien es posible que se trate de los dos polos de un mismo efecto adverso, donde seguramente se pueda incluir también la blefaritis. En los casos con claro predominio de la erupción similar a la dermatitis seborreica, la combinación de hidrocortisona y ketoconazol en emulsión aportó un beneficio rápido a todos los pacientes que la emplearon. Desconocemos si este efecto beneficioso se debe exclusivamente a los principios activos o también al vehículo empleado que actúa como emoliente.
Los inhibidores del RFCE pueden provocar una sequedad cutánea con descamación difusa que recuerda a la dermatitis atópica, más frecuente en pacientes de edad avanzada y que hayan recibido previamente agentes quimioterápicos8,15,30.
También se han descrito de forma anecdótica alteraciones en el crecimiento del pelo con el uso de gefitinib, como enlentecimiento del crecimiento de la barba, tricomegalia o vello fino y quebradizo11,15,31. En estos pacientes no se observaron trastornos capilares, probablemente debido a que se trata de una serie corta, aunque es posible que existan diferencias en el perfil de efectos adversos de los inhibidores de la tirosinquinasa del RFCE.
La paroniquia se presenta como dolor, eritema y proliferación de tejido de granulación alrededor de varias uñas de los pies y/o de las manos que simula una uña encarnada. Puede aparecer desde las 4 semanas hasta después de 12 meses de tratamiento con gefitinib8 y es frecuente la sobreinfección secundaria32. Se ha tratado con baños antisépticos y astringentes, antibióticos tópicos o sistémicos e incluso con escisión parcial de la lámina ungueal, aunque esto último no parece eficaz8,33,34. En nuestros casos la aplicación de nitrato de plata fue de ayuda para reducir el tejido de granulación. Debido al intenso dolor, que puede dificultar la deambulación, puede ser necesaria la interrupción temporal de erlotinib.
ConclusionesAunque la erupción acneiforme es el efecto adverso más frecuente y más conocido, erlotinib se asocia con otras manifestaciones cutáneas que pueden alterar la calidad de vida de los pacientes. Aunque se trata de una serie corta de pacientes, coincide con otros estudios de inhibidores del RFCE en que las manifestaciones más frecuentes son la erupción acneiforme, la paroniquia y la xerosis. Es difícil comparar la incidencia de la dermatitis seborreica, puesto que algunos autores la consideran como parte de la erupción acneiforme. La erupción acneiforme y la paroniquia son las manifestaciones que pueden obligar a reducciones de dosis e incluso a la interrupción temporal del tratamiento. El manejo adecuado de los efectos adversos cutáneos mejora claramente la calidad de vida de los pacientes. De particular interés resulta el hecho de que una mejor tolerancia al erlotinib podría permitir utilizar dosis mayores del fármaco con el fin de obtener una mejor respuesta tumoral y prolongar la supervivencia de estos pacientes. En todo caso, es necesario disponer de estudios con un mayor número de pacientes para conocer la incidencia, la cronología y la respuesta al tratamiento de los efectos adversos asociados al erlotinib.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.