La psoriasis es un proceso inflamatorio crónico que se ha asociado con comorbilidades cardiovasculares y metabólicas, especialmente las formas más graves y en pacientes jóvenes. Estudios recientes relacionan también la psoriasis con enfermedad renal, y parece lógico que sea así porque, por un lado, el riñón es un órgano diana de los factores de riesgo cardiovascular clásicos, y además, algunos de los tratamientos clásicos empleados para controlar la psoriasis tienen toxicidad renal. Con este artículo queremos hacer una llamada de atención sobre esta comorbilidad recientemente descrita; es fundamental su detección precoz porque una vez instaurada, la enfermedad renal crónica es irreversible. Consideramos importante que en el estudio basal de todo paciente con psoriasis, especialmente aquellos que van a recibir terapia sistémica, se analice la función renal con una analítica de sangre con filtrado glomerular y un análisis sencillo de orina para estudiar la albuminuria (relación albúmina/creatinina).
Psoriasis is a chronic inflammatory disease that has been associated with cardiovascular and metabolic comorbidities, particularly in young patients and patients with more severe forms of the disease. Recent studies have also linked psoriasis to kidney disease, and this would seem only logical, as the kidney is both a target of classic cardiovascular risk factors and susceptible to the toxic effects of some of the traditional drugs used to control psoriasis.
In this article, we would like to draw readers’ attention to this recently described comorbidity and stress the importance of early detection, as once chronic kidney disease develops, it cannot be reversed. When evaluating patients with psoriasis, particularly when they are candidates for systemic therapy, we believe it is important to order laboratory tests including glomerular filtration rate and a simple urine test to screen for albuminuria (albumin/creatinine ratio).
La psoriasis es una enfermedad inflamatoria cutánea crónica y recidivante que afecta al 0,1-2,9% de la población mundial1,2, siendo del 2,3% la prevalencia estimada en España3. La gravedad de esta enfermedad es variable y puede afectar no solo a la piel, sino también a las articulaciones (en un 12,8% en una encuesta efectuada a dermatólogos en España y Portugal)4, y además puede tener otras manifestaciones sistémicas5. Se ha encontrado asociación entre psoriasis y diabetes mellitus, obesidad, enfermedad coronaria, hipertensión arterial, enfermedad de Crohn, cáncer y depresión. En los últimos años se ha despertado un gran interés por las comorbilidades relacionadas con la psoriasis tanto desde el punto de vista del diagnóstico precoz como de su prevención y tratamiento y repercusión en el manejo de la enfermedad psoriásica6.
Relación entre psoriasis y afectación sistémica. Factores de riesgo cardiovascularLa psoriasis puede coexistir con otras enfermedades, posiblemente debido al proceso inflamatorio al que están sometidos los pacientes. De entre ellos destacan la obesidad7, la hipertensión, la hiperlipemia8 y la diabetes9, todos ellos factores de riesgo cardiovascular (RCV). Los motivos por los que el RCV está aumentado son múltiples:
- 1.
La existencia de un proceso inflamatorio sistémico que ocasiona el incremento de enfermedades inflamatorias como ateroesclerosis10.
- 2.
El incremento en esta población de estilos de vida no saludables con un aumento de la ingesta de alcohol, tabaco y sedentarismo11.
- 3.
Un aumento de los factores de RCV como hipertensión, diabetes y dislipidemia8.
- 4.
Algunos de los fármacos usados en el tratamiento de la psoriasis como la ciclosporina (CSA) o la acitretina pueden incrementar el RCV. La CSA puede aumentar la presión arterial y producir hiperlipidemia12 y la acitretina puede modificar el perfil lipídico, aumentando los triglicéridos y el colesterol13.
La mayoría de los estudios que relacionan la psoriasis con estas enfermedades sistémicas son estudios observacionales epidemiológicos. Por eso, hay autores que ponen en duda el carácter sistémico de la psoriasis o que exista un mecanismo común entre estas comorbilidades y la psoriasis11. La coexistencia de varias enfermedades no precisa obligatoriamente la existencia de mecanismos comunes14. Aunque diversos autores han puesto de relieve la coexistencia de psoriasis y arteriosclerosis10 y han encontrado que la psoriasis es un factor de riesgo independiente de enfermedad cardiovascular (infarto de miocardio), especialmente en pacientes jóvenes con psoriasis graves15, otros no han encontrado dicha asociación, pero no incluían a pacientes jóvenes y la mayoría eran psoriasis que no precisaban tratamiento sistémico o fototerapia16.
Cuando se analizan los mecanismos responsables de las alteraciones sistémicas y renales, parece estar implicado fundamentalmente el proceso inflamatorio sistémico. La inflamación produciría un incremento de la resistencia a la insulina, y además las citocinas presentes, como las adiponectinas, se correlacionan con la tensión arterial y la LDL17. La inflamación, junto con la infección, induce múltiples alteraciones en el metabolismo de los lípidos y lipoproteínas, muchas de ellas proaterogénicas: aumenta los triglicéridos y el colesterol total18. Un gran número de estudios han comparado los niveles de lípidos en suero en los controles y los pacientes con psoriasis. Los resultados han sido extremadamente variables, por las diferencias en la gravedad de la psoriasis o en comorbilidades como la obesidad que pueden afectar al metabolismo de los lípidos. En general, hay una tendencia a un aumento de los triglicéridos en suero y una disminución de HDL en los pacientes con psoriasis19–21.
La existencia de artritis psoriásica también aumenta el RCV, por lo que parece que la presencia de un fenómeno inflamatorio sistémico puede ser un factor de RCV por sí mismo22. En estos casos más graves, se ha observado un incremento de los marcadores inflamatorios como la proteína C reactiva y la velocidad de sedimentación globular23. Se ha descrito una activación de los linfocitos T y la producción de citocinas como el TNFα, causantes del estado inflamatorio, que se han relacionado con el aumento de eventos cardiovasculares23.
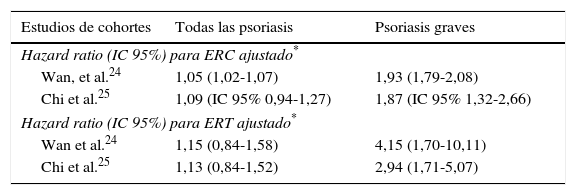
Asociación entre psoriasis y enfermedad renalExiste una alta prevalencia de enfermedad renal crónica (ERC) en pacientes con psoriasis, con un riesgo incrementado que varía según los diferentes estudios entre 1,28-1,924. El desarrollo de enfermedad renal ocurre más en aquellos casos de afectación cutánea más extensa, y es independiente del uso de fármacos nefrotóxicos como antiinflamatorios no esteroideos o inmunosupresores, así como de otros factores clásicos como edad y sexo25.
Esta relación parece ser dependiente del estado inflamatorio característico de esta enfermedad26. La mayoría de los estudios encuentran una asociación entre psoriasis y ERC en los pacientes con psoriasis más graves27(ver tabla 1). La presencia de artritis psoriásica supone un incremento del riesgo de sufrir ERC incluso en fases muy avanzadas, estimando algunos autores un riesgo relativo de 2,97 comparado con población sana25.
Hazard ratio para enfermedad renal crónica (ERC) y enfermedad renal terminal (ERT) en pacientes con psoriasis en 2 estudios de cohortes publicados
| Estudios de cohortes | Todas las psoriasis | Psoriasis graves |
|---|---|---|
| Hazard ratio (IC 95%) para ERC ajustado* | ||
| Wan, et al.24 | 1,05 (1,02-1,07) | 1,93 (1,79-2,08) |
| Chi et al.25 | 1,09 (IC 95% 0,94-1,27) | 1,87 (IC 95% 1,32-2,66) |
| Hazard ratio (IC 95%) para ERT ajustado* | ||
| Wan et al.24 | 1,15 (0,84-1,58) | 4,15 (1,70-10,11) |
| Chi et al.25 | 1,13 (0,84-1,52) | 2,94 (1,71-5,07) |
Las causas de la afectación renal en el paciente con psoriasis son múltiples. En un primer lugar, el riñón es un órgano diana de los factores de RCV clásicos, en un segundo lugar, las enfermedades autoinmunes son causa de afectación glomerular, y por último, la implicación de varios de los tratamientos usados en el control de la psoriasis en el daño renal.
La ERC se define como la disminución de la función renal, expresada por un filtrado glomerular (FG) inferior a 60ml/min/1,73m2 o como la presencia de daño renal de forma persistente durante al menos 3 meses28. Daño renal se entiende como cualquier alteración anatómica, o la existencia en la orina de proteinuria o hematuria. Por tanto el concepto de daño renal incluye diagnóstico por método directo (alteraciones histológicas en biopsia renal) o de forma indirecta por marcadores como la albuminuria o proteinuria, variaciones en el sedimento urinario o alteraciones en pruebas de imagen.
La existencia de albuminuria patológica es muy superior en pacientes con psoriasis frente a controles y los parámetros de gravedad de la psoriasis se correlacionan significativamente con la albuminuria de 24h29.
El riñón como órgano diana de factores de riesgo cardiovascular en la psoriasisLa ERC se encuentra estrechamente relacionada con el envejecimiento de la población y la elevada prevalencia de diabetes e hipertensión arterial30. El desarrollo de la enfermedad renal se relaciona directamente con factores de riesgo muy prevalentes en el paciente con psoriasis como la hipertensión, la diabetes, la obesidad, la dislipidemia y el síndrome metabólico, que también son factores de RCV de forma independiente31. Por lo tanto, cualquiera de estas alteraciones puede desarrollarse en paralelo y contribuir mutuamente a su progresión32.
Todos estos factores de forma independiente incrementan el riesgo de presentar ERC, por lo que la unión de varios de ellos incrementa más aún esta posibilidad. No es de extrañar por lo tanto que un paciente como el psoriásico, con varios de estos factores, tenga una mayor probabilidad de desarrollar ERC. La hipertensión tanto sistólica como diastólica es un predictor independiente de desarrollo de enfermedad renal33. La diabetes es igualmente un importante factor de daño vascular con implicación renal. Así, la nefropatía diabética ocurre en un 25-40% de los pacientes con diabetes tipo 1 o tipo 2 con una enfermedad prolongada y es en sí misma otro factor de RCV34. La obesidad es un factor bien conocido de deterioro de la función renal, al igual que el síndrome metabólico35.
Psoriasis y enfermedad glomerularHay numerosos casos aislados de diferentes tipos de glomerulonefritis y psoriasis, pero son pocos los estudios que han estudiado de una manera completa la relación entre psoriasis y glomerulonefritis. Recientemente, en un extenso estudio realizado en 4.344 pacientes con psoriasis seguidos 5 años, se ha visto un incremento de los casos de glomerulonefritis en estos pacientes (HR 1,50; IC 95% 1,24-1,81) que puede ser otro factor de deterioro de la función renal. Este incremento es mayor en pacientes con una psoriasis más grave, y con artritis psoriásica26. Entre los casos descritos, la glomerulonefritis más frecuente fue la mesangioproliferativa con y sin depósitos de IgA29,36. Este tipo de glomerulonefritis es frecuente en enfermedades autoinmunes e infecciosas, y aunque no se conocen sus mecanismos fisiopatológicos, el aumento de la síntesis de IgA polimérica en estas enfermedades parece estar implicado en su origen37.
Asociación entre diferentes tratamientos de la psoriasis y el desarrollo de enfermedad renal crónicaExiste controversia en la literatura sobre la relación de ERC con los fármacos usados en el tratamiento de la psoriasis como la CSA o el metotrexato o con la propia psoriasis. El motivo es que es bien conocida la nefrotoxicidad de ambos tratamientos.
La CSA se ha relacionado con hipertensión, afectación renal y procesos linfoproliferativos. Por esos motivos no se aconseja su uso más de 2 años38. La CSA también puede causar un fracaso renal agudo al producir una vasoconstricción de la arteriola aferente. Su suspensión mejora la función renal en 5-7 días39.
Pero la CSA puede ocasionar una ERC no recuperable cuando se usa durante periodos prolongados. El tiempo estimado como de riesgo de uso de CSA es variable, pero el estudio original que detectó daño renal por CSA estima que los tratamientos superiores a 12 meses presentan un mayor riesgo de desarrollar daño renal40. Se ha comprobado que el uso discontinuo no mejora este efecto y es comparable al uso continuo41. Numerosos estudios realizados en trasplante hepático no han encontrado relación entre unas dosis altas o no de CSA, ni con niveles altos con el desarrollo de enfermedad renal42.
El metotrexato puede ocasionar daño renal por precipitación en los túbulos renales o por efecto directo del propio fármaco sobre los túbulos renales, pues su eliminación es en un 90% en los riñones. Su toxicidad depende de los niveles en sangre una vez administrado. Los niveles superiores a 10μM a las 24h o más de 1μM a las 48h se asocian a alta probabilidad de nefrotoxicidad, especialmente en ancianos43. Existen publicaciones sobre nefrotoxicidad por metotrexato en pacientes con psoriasis44,45. Aunque la dosis empleada en la psoriasis es baja, y no hay muchos casos reportados en estos pacientes, conviene saber que existe la posibilidad de llegar a dosis nefrotóxicas, al existir una alta variabilidad.
El uso de antiinflamatorios no esteroideos se ha relacionado igualmente con un incremento de daño renal en los casos de psoriasis moderada y grave con un riesgo relativo de 1,6926. En muchas ocasiones los antiinflamatorios no esteroideos se usan junto al metotrexato por lo que pueden aumentar el daño renal.
Respecto a los tratamientos biológicos, por un lado, se han descrito casos de enfermedad renal autoinmune inducida por estos tratamientos en pacientes con diversas enfermedades entre ellas psoriasis46–53. La mayoría son glomerulonefritis membranosas, también se han descritos nefritis granulomatosas. Se han agrupado en: glomerulonefritis asociadas a vasculitis sistémica, glomerulonefritis en síndromes lupus-like y alteraciones renales autoinmunes aisladas. La mayoría son casos relacionados con anti-TNF54. Por otro lado, los tratamientos biológicos, dada su ausencia de toxicidad orgánica, son una buena opción terapéutica en pacientes con ERC, incluso en sus estadios finales, y ya hay casos de pacientes con psoriasis en hemodiálisis tratados con éxito con distintos biológicos55.
Implicaciones sistémicas de la enfermedad renal en el paciente con psoriasisLa enfermedad renal crónica como factor de riesgo cardiovascularLa ERC es un problema de salud pública importante que afecta al 10% de la población adulta y a más del 20% de los mayores de 60 años56, sabiéndose además que está infradiagnosticada. Es un factor de RCV independiente, de manera que el riesgo de mortalidad cardiovascular asociada a la ERC es superior al de progresión a la diálisis o trasplante. La enfermedad cardiovascular asociada a la ERC es tratable y potencialmente prevenible57.
Es conveniente conocer que el deterioro de la función renal se relaciona con el desarrollo de enfermedad cardiovascular y muerte. En la práctica clínica se debe estudiar la existencia de proteinuria (albuminuria) y función renal en la población de riesgo. Debido a la alta incidencia de enfermedad renal en pacientes con psoriasis, esta posibilidad debe de ser contemplada. El RCV ocurre desde que se confirma un aumento de microalbuminuria, aun con función renal normal, y este riesgo aumenta a medida que la función renal se deteriora, y en fases avanzadas el riesgo de enfermedad cardiovascular es hasta 20-30 veces el de la población general58.
La tasa de filtración glomerular estimada y la microalbuminuria (30-300mg/24h) o macroalbuminuria (>300mg/24h) se usan para evaluar la fase de la alteración renal. Una tasa de filtración glomerular estimada inferior a 60ml/min define la insuficiencia renal e implica un aumento significativo del RCV. La albuminuria a menudo acompaña a la tasa de filtración glomerular estimada reducida, y la combinación de las 2 tiene un efecto aditivo. Inicialmente hay que tratar de controlar los factores de riesgo en pacientes con alteración renal. Los pacientes con alteración renal y cardiopatía isquémica y/o insuficiencia cardiaca a menudo no están tratados con toda la medicación posible y en ellos se debe prestar una atención especial para mejorar su supervivencia59.
Valorar factores de riesgo cardiovascular emergentesEn los pacientes con insuficiencia renal se pierde progresivamente la capacidad de excretar fósforo. Para conseguir incrementar la eliminación urinaria de fósforo, aumentan los mecanismos fosfatúricos, como son la parathormona (PTH) y el FGF23, que mantienen la capacidad fosfatúrica total normal. El FGF23 es una fosfatonina de 251 aminoácidos, que tiene como misión mantener el fósforo en niveles normales descendiendo su absorción tubular renal, inhibiendo la actividad del cotransportador Na/P tipo ii en el túbulo proximal. Pero además inhibe la actividad de la 1 alfa hidroxilasa, y reduce así la síntesis de 1-25 dihidroxicolecalciferol a expensas del calcidiol y aumenta la 24 alfa hidroxilasa que incrementa el catabolismo de la vitamina D. Es decir, el paciente con insuficiencia renal tiene un descenso de la vitamina D60. El aumento de la PTH y del FGF23, así como el descenso de la vitamina D, aumenta el RCV61.
El paciente con psoriasis tiene un descenso en los niveles de vitamina D y un aumento en los valores de PTH. El déficit de vitamina D en el paciente con psoriasis puede llegar al 80% en invierno62. El origen del déficit de vitamina D en la psoriasis no ha sido bien estudiado, pero sus implicaciones pueden ser varias. En primer lugar, el déficit de vitamina D puede ser responsable de causar osteoporosis, descender la respuesta inmune, aumentar el riesgo de diabetes y de mortalidad por causa cardiovascular63,64. Pero además, el déficit de vitamina D tiene importantes implicaciones en la patogénesis de la psoriasis, pues existen receptores de vitamina D responsables del crecimiento y diferenciación del queratinocito y de las funciones inmunes de las células dendríticas y linfocitos T65. De hecho el uso tópico de derivados de la vitamina D se ha empleado en el tratamiento de la psoriasis, así como existe la posibilidad de que la fototerapia incremente la vitamina D endógena y sea uno de sus mecanismos de acción66,67. Igualmente se ha observado un incremento de la PTH sérica en el paciente con psoriasis que puede tener implicaciones directas sobre el RCV de estos pacientes68. El origen de este aumento se debe posiblemente al déficit de vitamina D, pero no se puede descartar un mecanismo fosfatúrico por descenso de la eliminación renal de fósforo.
Recomendaciones a los dermatólogos para prevenir daño. Qué hacer, cuándo y cada cuántoComo hemos expuesto, la psoriasis es una enfermedad inflamatoria con repercusión sistémica en muchos casos, que se asocia a varios factores de RCV. Por todo ello parece prudente tener en cuenta estas posibilidades cuando se trata a un paciente con psoriasis (ver tabla 2).
Recomendaciones para prevenir el daño renal en pacientes con psoriasis
| 1. Estudio de función renal en psoriasis con>3% de superficie afecta y repetir anualmente en pacientes con psoriasis moderada-grave |
| Creatinina en sangre |
| Filtrado glomerular estimado por fórmulas (MDRD-4 o CKD-EPI) |
| Microalbuminuria |
| 2. Si se usan fármacos potencialmente nefrotóxicos incrementar la monitorización de la función renal |
| 3. Valoración por nefrólogo si se produce descenso del filtrado glomerular o aumento de microalbuminuria |
| 4. Control de factores de riesgo cardiovascular clásicos: hipertensión, diabetes, dislipidemia o sobrepeso/obesidad |
Es recomendable, al menos en las formas moderadas-graves, al igual que en otras enfermedades inflamatorias, realizar al menos una vez al año un estudio de función renal, incluyendo microalbuminuria, creatinina y FG estimado por fórmulas. Las fórmulas más usadas son las derivadas del estudio Modification of Diet in Renal Disease (MDRD) conocida como MDRD-469 o la del Chronic Kidney Disease Epidemiology Collaboration conocida como CKD-EPI70. Algunos autores recomiendan realizar una microalbuminuria, una creatinina y un FG a aquellos pacientes con psoriasis con placas en más de un 3% de la superficie corporal, y extremar el cuidado con el uso de fármacos nefrotóxicos, como metotrexato o CSA, independientemente de la enfermedad en la que se emplee20. En el caso de usar fármacos potencialmente nefrotóxicos, la monitorización de la función renal debe de ser incrementada15. La existencia de daño renal desaconseja los fármacos nefrotóxicos. Igualmente es recomendable no usar fármacos como la CSA durante periodos superiores a 2 años. El uso de fármacos no nefrotóxicos puede ser una alternativa razonable para reducir este riesgo.
Cuando se detecte un descenso del FG o un incremento de la microalbuminuria con respecto a determinaciones previas, el paciente debe de ser valorado detenidamente por si fuera preciso ser remitido a un nefrólogo. No debemos olvidar que es un paciente crónico, y cuanto más precoz sea el diagnóstico de afectación renal, mejor será su estabilización, pues no es recuperable.
Estudio de factores de riesgo cardiovascularEn el paciente con psoriasis, especialmente en las formas moderadas o graves, debe de hacerse un estudio de factores de RCV clásicos como hipertensión arterial, diabetes, dislipidemia o sobrepeso/obesidad, con el fin de evitar un evento cardiovascular. Las formas de psoriasis más extensas tienen mayor riesgo de sufrir otras comorbilidades, también las que presentan otras manifestaciones extracutáneas de la enfermedad como la artritis.
Los mensajes clave de este trabajo se muestran en la tabla 3.
Psoriasis y enfermedad renal. Mensajes clave
| La psoriasis es una enfermedad inflamatoria sistémica que puede aumentar el riesgo de comorbilidades como la hipertensión arterial, dislipidemia y diabetes |
| Existe un aumento de la enfermedad renal en los pacientes con psoriasis, especialmente en las formas más graves de la enfermedad |
| La psoriasis tiene un mayor riesgo de ocasionar una glomerulonefritis mesangial |
| El daño vascular secundario a la inflamación y al resto de las comorbilidades asociadas puede ser la causa de la mayor prevalencia de daño renal |
| Diferentes tratamientos usados en la psoriasis son nefrotóxicos usados de una manera prolongada |
| En pacientes con psoriasis moderada-grave o con artritis psoriásica deben de realizarse controles periódicos de la función renal, determinando el filtrado glomerular y la proteinuria |
Abbvie ha promovido y financiado las reuniones presenciales de los integrantes de este grupo de trabajo.
Conflicto de interesesAbbvie ha facilitado reuniones para los integrantes del grupo pero ninguno de sus empleados ha participado en el desarrollo y elaboración del material científico, las discusiones o el texto escrito.
Raquel Rivera ha participado en asesorías para Laboratorios Abbvie, Janssen, Lilly y Pfizer, como ponente para MSD, Abbvie, Janssen, Leo Pharma, Novartis y Pfizer, como investigador para Abbvie, Pfizer, Janssen, Celgene, Lilly, Novartis, Leo Pharma y recibido ayuda para asistir a congresos de Abbvie, Janssen, Novartis, Pfizer, Leo Pharma, Celgene y MSD