En la segunda parte de este artículo se revisan las principales micosis sistémicas y sus manifestaciones cutáneas: paracoccidioidomicosis, coccidioidomicosis, histoplasmosis, mucormicosis y criptococosis. Las micosis sistémicas presentan lesiones en la piel solo en algunas ocasiones, ya sea por afectación directa de ella como puerta de entrada o tras la diseminación de la infección a partir de un foco profundo. Muchas veces estos signos cutáneos serán la única pista para el diagnóstico certero de patologías potencialmente fatales. Por lo mismo, y con mucho mayor énfasis que las micosis tratadas en la primera parte, es importante saber reconocer y tratar las micosis sistémicas.
In the second part of this review on the deep mycoses, we describe the main systemic mycoses—paracoccidioidomycosis, coccidioidomycosis, histoplasmosis, mucormycosis, and cryptococcosis—and their cutaneous manifestations. Skin lesions are only occasionally seen in deep systemic mycoses either directly, when the skin is the route of entry for the fungus, or indirectly, when the infection has spread from a deeper focus. These cutaneous signs are often the only clue to the presence of a potentially fatal infection. As with the subcutaneous mycoses, early diagnosis and treatment is important, but in this case, even more so.
Las micosis sistémicas son infecciones fúngicas cuya puerta de entrada es un órgano o sitio profundo, como pulmón, tubo digestivo o senos paranasales. Tienen la capacidad de diseminarse en forma hematógena para producir una infección generalizada, frecuentemente con afección cutánea secundaria. Existen 2 variedades de micosis sistémicas: las micosis oportunistas (candidiasis sistémica, aspergilosis y mucormicosis sistémica) y las respiratorias endémicas (histoplasmosis, blastomicosis, coccidioidomicosis, paracoccidioidomicosis y criptococosis); en la práctica, debido a la tendencia de ambos grupos a desarrollarse en pacientes predispuestos, es difícil distinguir entre ambas y tienden a estudiarse en conjunto.
En esta segunda parte revisamos las micosis profundas más comunes que producen manifestaciones cutáneas dentro del curso de la enfermedad.
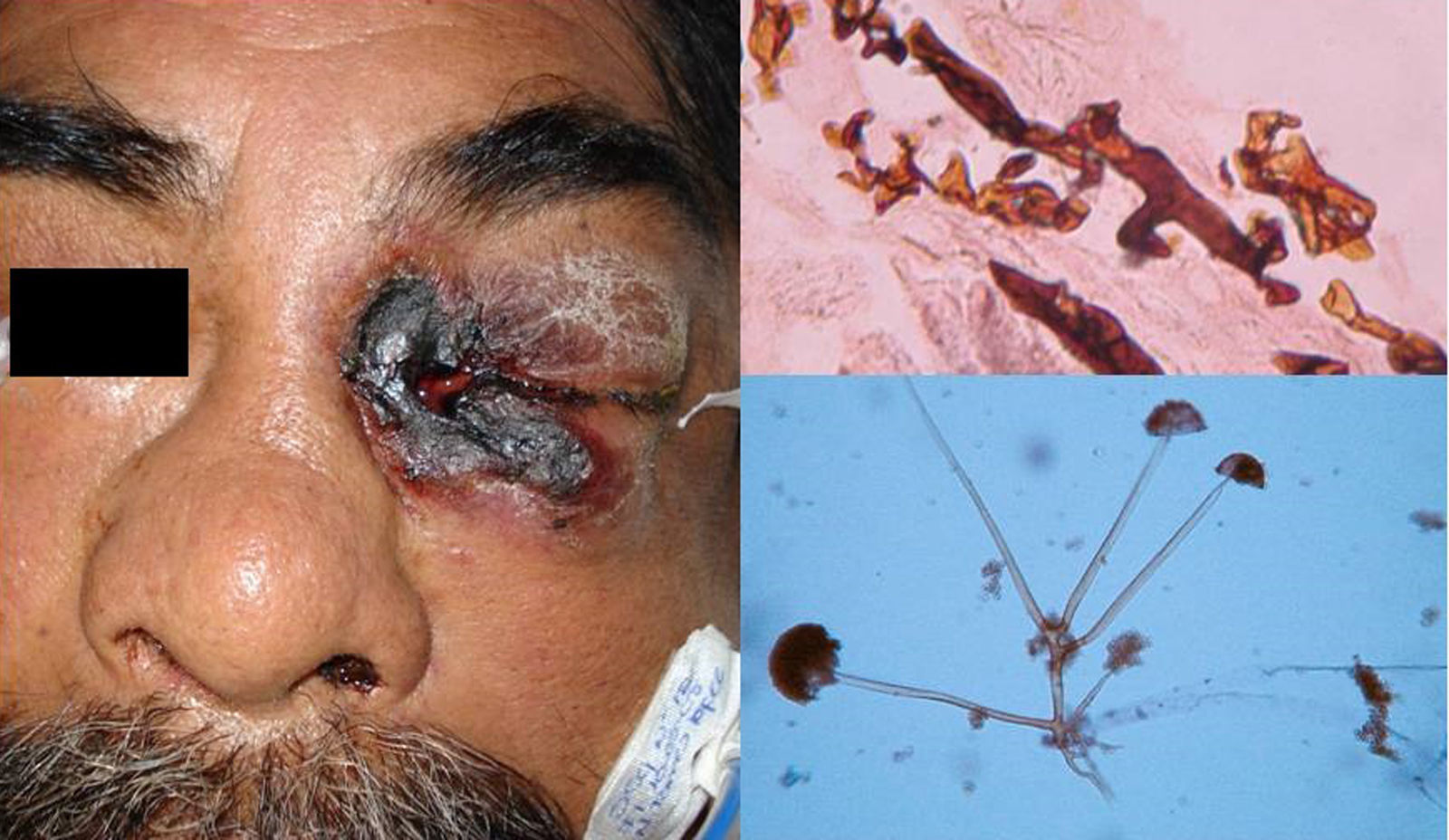
MucormicosisTiene localización visceral debido a la inmunosupresión del huésped1,2. Causada por zigomicetos mucorales, puede provocar mucormicosis rinocerebral, cutánea, pulmonar y diseminada. La variedad más frecuente es la rinocerebral, que se caracteriza por afección a los senos nasales, úlceras palatinas y extensas lesiones necróticas cerebrales y cutáneas. La mayoría de casos se asocian a diabetes mellitus descompensada y a estados de neutropenia (leucemias)3.
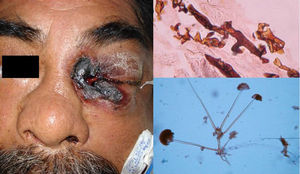
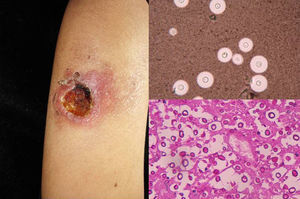
ClínicaHabitualmente tiene un curso agudo, rápidamente progresivo, con alta letalidad. Las infecciones rinocerebrales son las más frecuentes, seguidas de las pulmonares, intestinales, cutáneas y diseminadas3. Las manifestaciones primarias cutáneas son extremadamente raras y ocurren principalmente en sitios de venopunción, por lo que son más frecuentes en las extremidades. Se manifiestan como pápulas o nódulos que luego se ulceran, con centro necrótico, exudado pútrido o maloliente. Puede comprometer tejidos profundos (muscular-óseo) localmente, siendo altamente destructivas3. Las manifestaciones mucocutáneas secundarias a una mucormicosis rinocerebral son mucho más frecuentes, de forma que el 25% de los pacientes cursan con úlceras palatinas y fístulas palpebrales extremadamente dolorosas (fig. 1)3.
DiagnósticoEl examen micológico directo del material necrótico, esputo, lavado broncopulmonar, aspirado de senos paranasales y raspado de lesiones cutáneas muestra hifas largas, cenocíticas (sin tabiques) de paredes finas, ramificadas (fig. 1). Los microorganismos pueden cultivarse rápidamente en agar dextrosa Sabouraud y su identificación se hace mediante las formas de reproducción o por biología molecular; la técnica más usada es la PCR dirigida al segmento ITS del ADNr1,4.
TratamientoEl tratamiento es multifactorial, con control de factores predisponentes (cetoacidosis, neutropenia, etc.), antifúngicos sistémicos y desbridamiento quirúrgico agresivo4. En la forma subcutánea: yoduro de potasio, ketoconazol y fluconazol. Puede asociarse trimetoprim-sulfametoxazol1. El antimicótico de elección es la anfotericinaB, y se puede combinar con caspofungina o posaconazol.
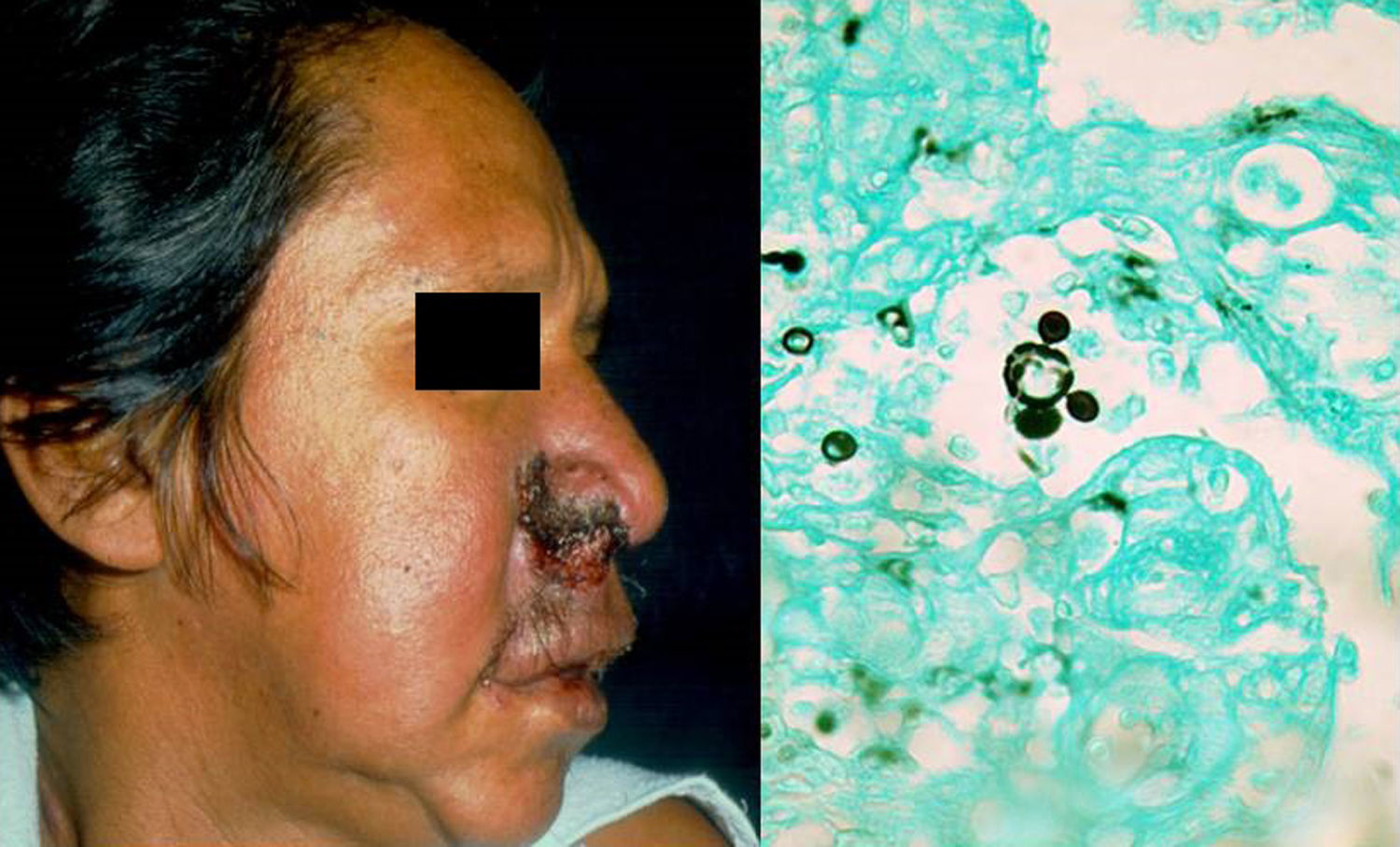
ParacoccidioidomicosisMicosis crónica, subaguda o raramente aguda producida por Paracoccidioides brasiliensis y Paracoccidioides lutzii, con compromiso cutáneo y visceral5. Es una enfermedad granulomatosa sistémica potencialmente letal y considerada endémica en América (México, Argentina, Guayanas, Brasil, Venezuela y Colombia)6. P.brasiliensis en un hongo dimórfico, aislado de vegetales y del suelo de regiones húmedas, donde permanece bajo la forma de micelio. Se desconoce si hay contagio interhumano. Penetra por vía respiratoria. La infección adquirida por inhalación puede permanecer latente una o 2 décadas, desencadenando infección según el estado inmunológico6-8.
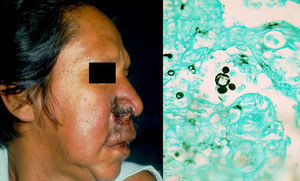
ClínicaLa infección primaria suele ser asintomática y puede resolverse o dejar una lesión residual (cicatriz). La enfermedad sintomática es una consecuencia de la relación parásito-hospedador, siendo importante la virulencia de cada cepa. Las formas sintomáticas se presentan como una forma crónica del adulto, la más frecuente (90% de los casos con lesiones pulmonares y metástasis en diversos órganos), o como una forma juvenil aguda, con participación pulmonar y del sistema reticuloendotelial, con adenopatías, hepatoesplenomegalia y afectación ósea6. Destacan las lesiones en la mucosa orofaríngea, que simulan amigdalitis crónicas, las lesiones periodontales y las laríngeas, así como lesiones ulcerovegetativas periorales. Además, puede haber lesiones cutáneas nodulares, necróticas o de tipo absceso frío subcutáneo (fig. 2)6. Se han descrito casos con compromiso de genitales externos simulando un chancro sifilítico8.
El diagnóstico diferencial debe incluir leishmaniosis mucocutánea, granulomatosis de Wegener, sífilis, linfoma, esporotricosis y escrofuloderma, entre otros.
DiagnósticoMuestras de esputo, raspado de piel o pus para visualización del hongo por examen micológico directo (levaduras multigemantes en forma de rueda de timón) (fig. 2). El cultivo se realiza en Sabouraud dextrosa agar con y sin antibióticos en 15 o 20días mostrando colonias filamentosas blancas en donde se ven los micelios. Se puede usar PCR frente a internal transcribed spacer (ITS)9 u otras regiones10, ya sea en tejido o suero. La biopsia de piel mostrará inflamación granulomatosa cutánea supurativa asociada a hiperplasia pseudoepiteliomatosa6.
TratamientoEn el tratamiento se puede utilizar anfotericinaB, triazoles sistémicos y sulfamidas durante tiempo prolongado.
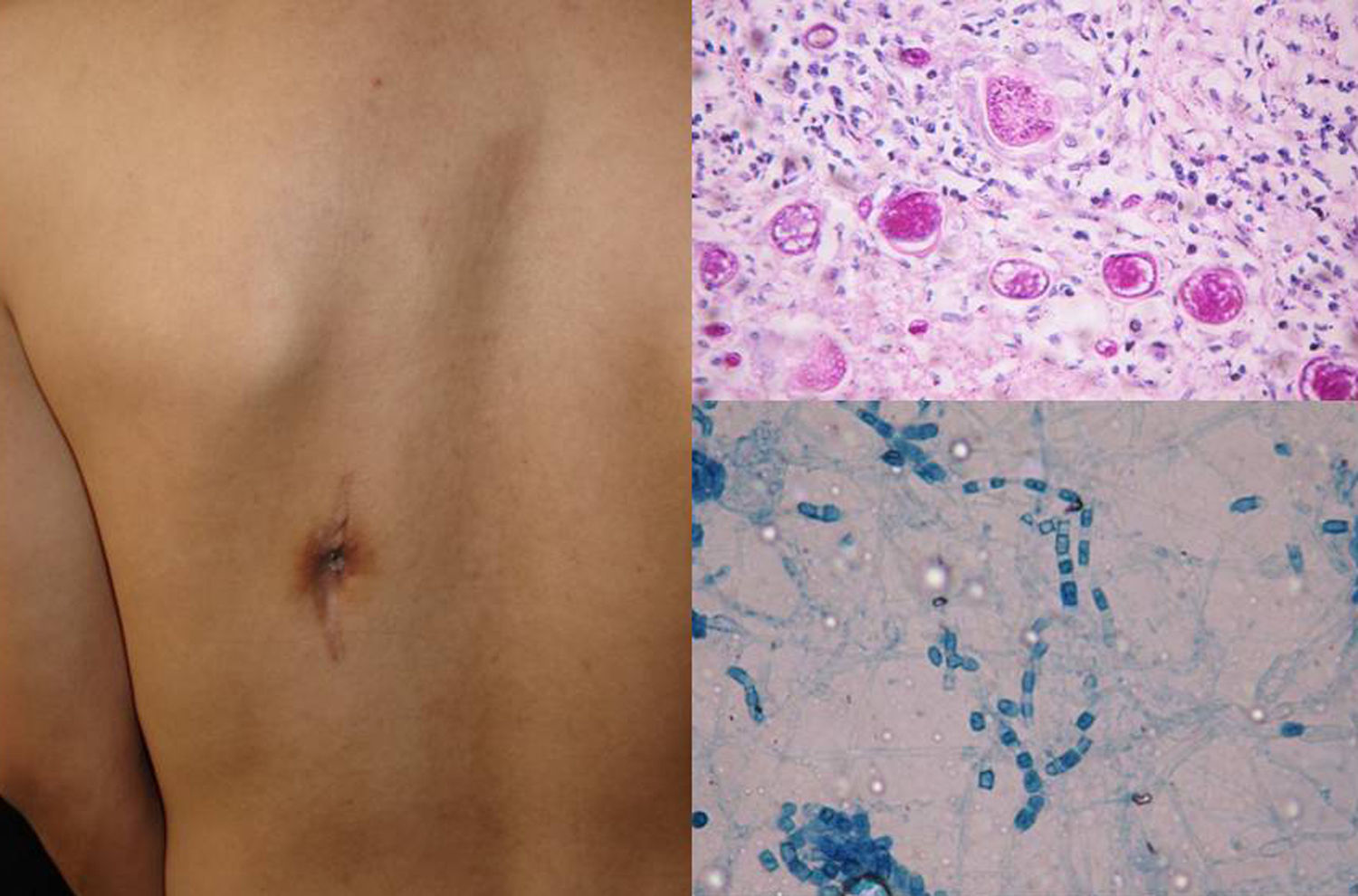
CoccidioidomicosisEs producida por Coccidioides immitis y Coccidioides posadasii, ambos hongos dimórficos. Epidemiológicamente el reservorio es el suelo seco con pH alcalino. La enfermedad afecta a hombres y animales y la infección se adquiere por inhalación de artroconidios de C.immitis de suelos de zonas endémicas (EE.UU., México, Argentina, Paraguay, Colombia, Venezuela y Brasil); la incubación es de una a 4 semanas5,11,12.
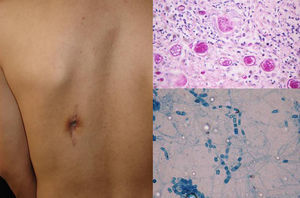
ClínicaPredomina un cuadro pulmonar, comprometiendo con menor frecuencia la piel, la laringe, los huesos, las articulaciones y las meninges, entre otros. Las lesiones cutáneas pueden ser diversas, en forma de pápulas, pústulas, placas, abscesos, trayectos fistulosos (fig. 3), úlceras, erupción macular difusa, eritema multiforme o eritema nodoso11,12.
La tuberculosis, la paracoccidioidomicosis, la esporotricosis, la histoplasmosis e incluso las neoplasias deben ser consideradas como parte del espectro del diagnóstico diferencial.
DiagnósticoEl cultivo y el examen micológico directo revelan esférulas de doble membrana con conidios dentro (fig. 3). El cultivo, peligroso y altamente infectante, se realiza en Sabouraud dextrosa agar con y sin antibióticos; en él se observan artroconidios hialinos separados unos de otros por una célula de unión (rexólisis). La histología es útil por la presencia de esférulas con endosporas (fig. 3). Los test serológicos con anticuerpos IgM específicos en las formas agudas son diagnósticos solo después de las 4 semanas; son también de importancia la intradermorreacción con coccidiodina y la valoración de complemento11,12. Se puede usar además PCR frente a la región 28S del ADNr13.
TratamientoEl tratamiento consiste en anfotericinaB desoxicolato o liposomal, itraconazol o fluconazol durante 6 a 12meses12.
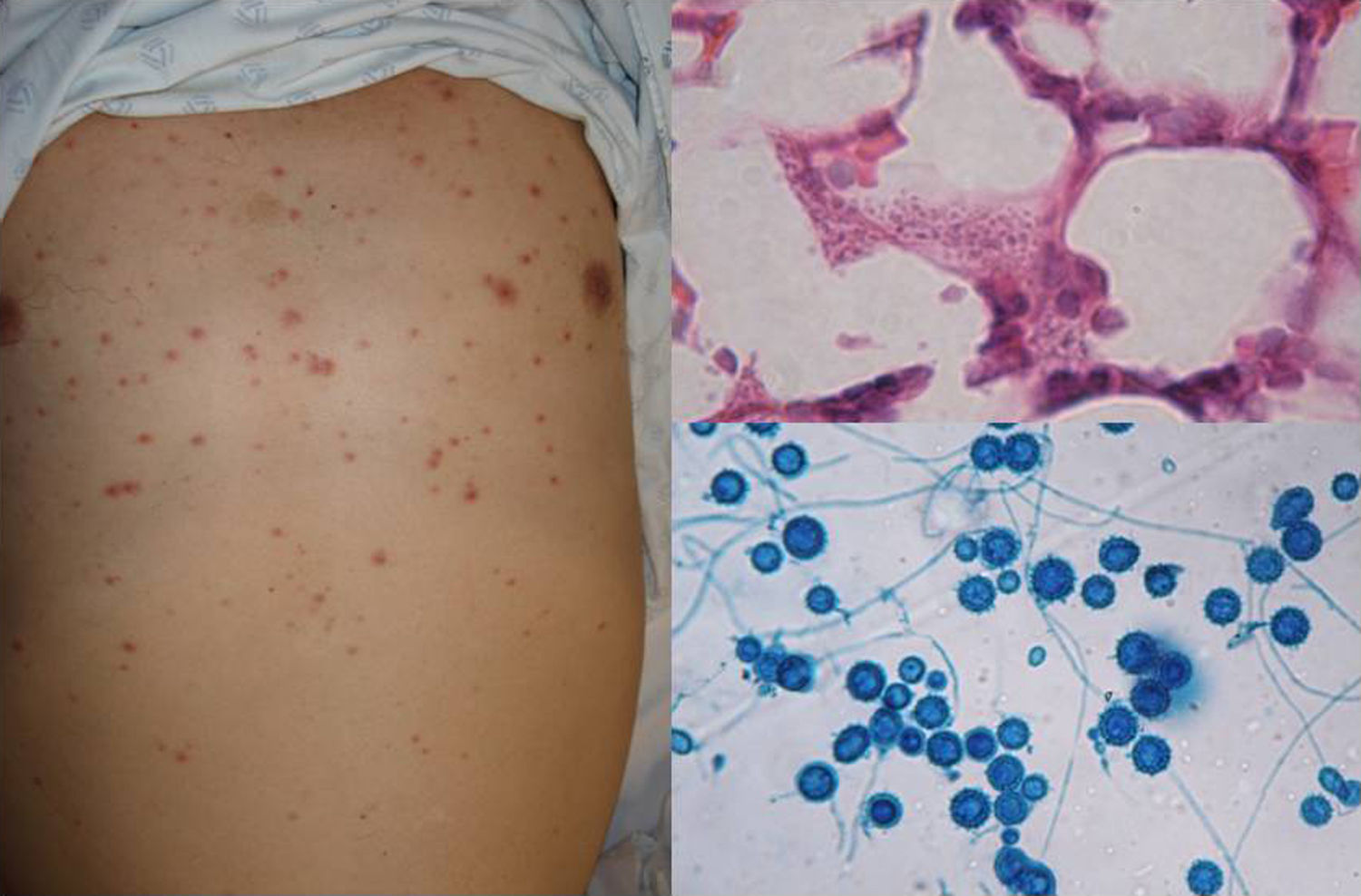
HistoplasmosisLa histoplasmosis americana o enfermedad de Darling es una micosis sistémica causada por el hongo dimórfico Histoplasma capsulatum var. capsulatum14, que afecta especialmente al sistema reticuloendotelial5.
El pulmón es el sitio habitual de la infección inicial. Más tarde, el hongo puede extenderse a varios órganos, incluso a la piel14. La histoplasmosis es la infección micótica pulmonar más común y ocurre en casi todas las partes del mundo (se ha reportado en más de 60 países). El patógeno crece sobre todo en zonas de clima tropical como centro y Sudamérica, en el este de EE.UU. y en el sur de México. El hongo se encuentra en el suelo, en restos de la descomposición de materiales vegetales orgánicos, así como también en especial en los excrementos de murciélagos (clásicamente en cuevas)15 y algunas aves, como pollos, pavos, palomas y gansos16.
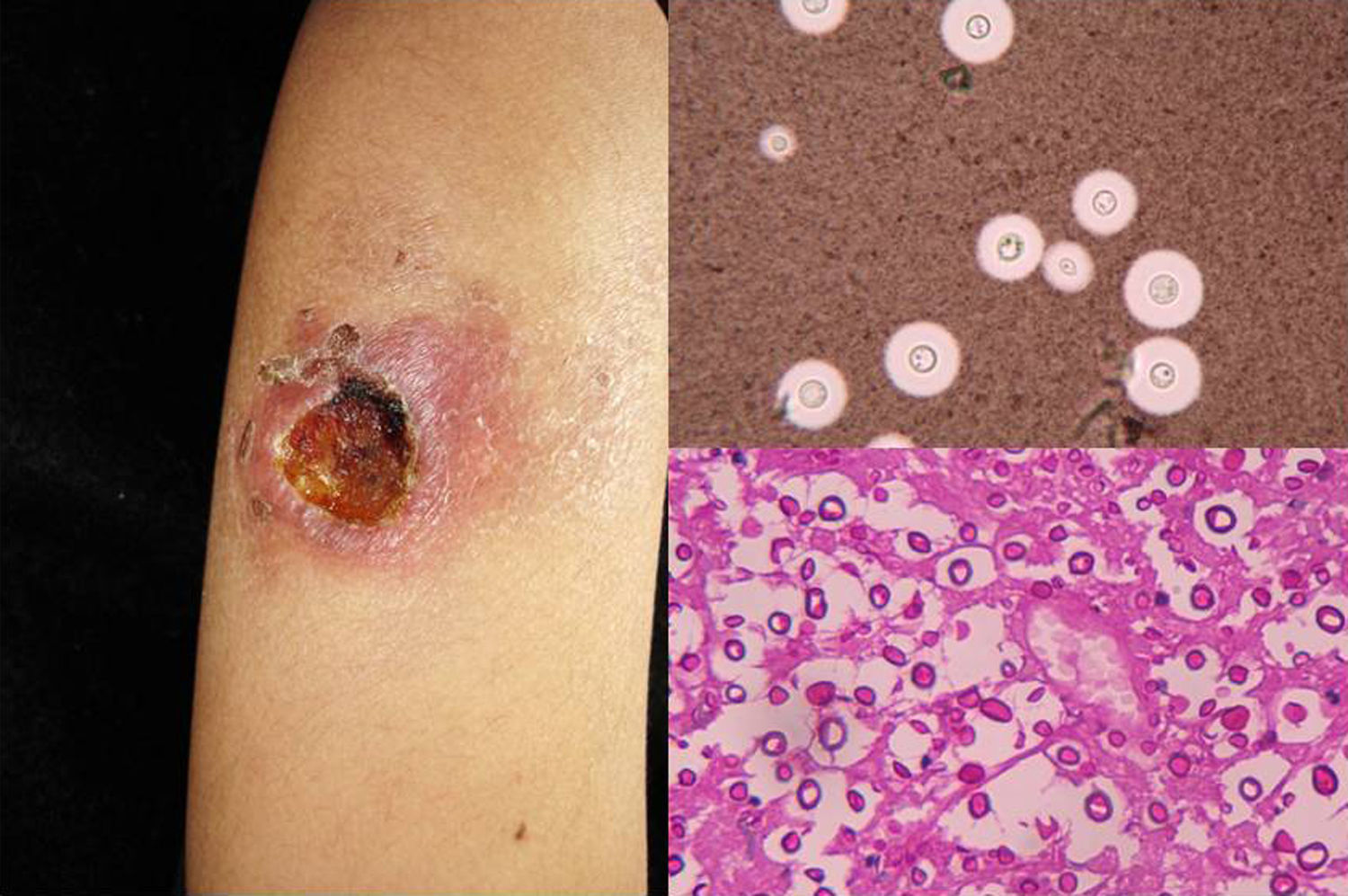
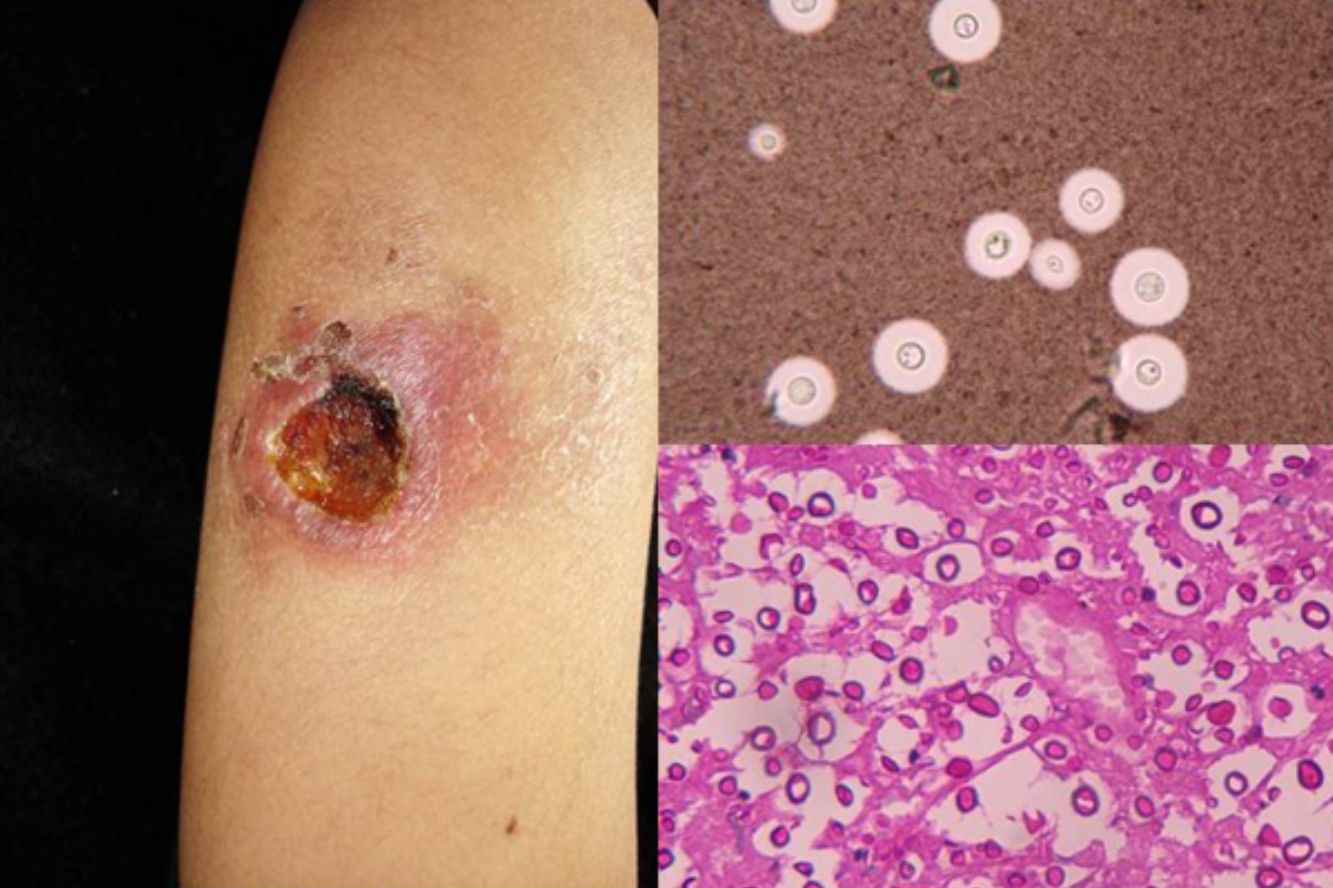
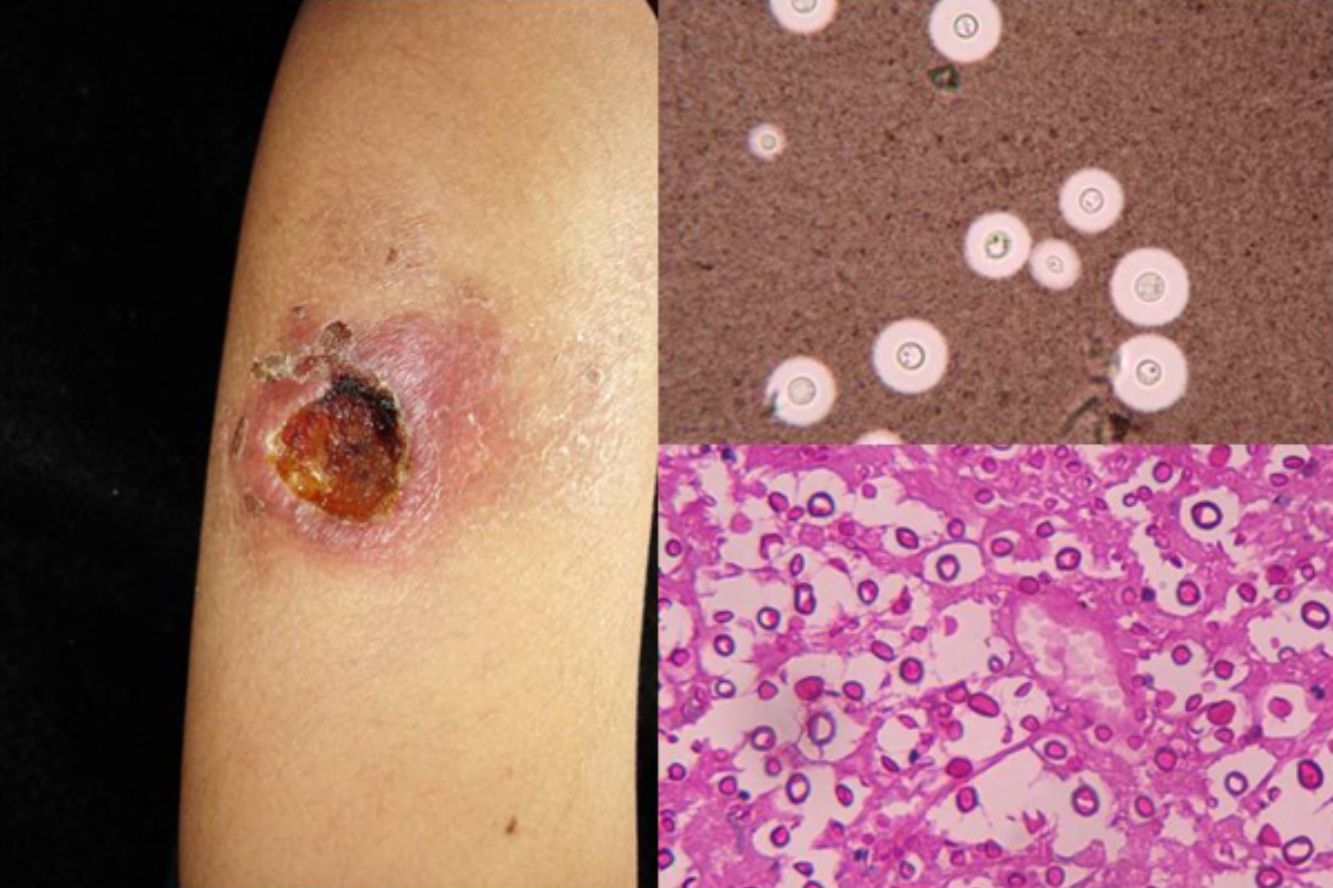
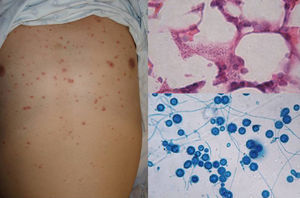
ClínicaEn el 95% de las personas la infección no se manifiesta clínicamente. En la forma aguda, los síntomas varían desde un cuadro pseudogripal a cuadros más complejos con imágenes radiológicas en forma de calcificaciones diseminadas y otros que asemejan una tuberculosis16. La forma crónica corresponde a la evolución de la anterior y afecta a varones mayores de 50años preferentemente; cursa con tos y expectoración, siendo difícil aislar H.capsulatum del esputo. En las formas diseminadas crónicas el compromiso de las mucosas es muy característico, sobre todo lesiones ulcerogranulomatosas en mucosa oral, lengua, tabique nasal o laringe. Por último, en la forma diseminada aguda, que suele ocurrir en pacientes con sida, puede presentarse con meningoencefalitis y focos de osteólisis en las metáfisis de los huesos largos. En estos enfermos por lo regular, a nivel cutáneo, se presentan casos diseminados (el compromiso cutáneo ocurre en el 11% de los pacientes)15 compuestos por lesiones papulares que se localizan en la cara y el tronco (fig. 4), y en ocasiones lesiones ulcerativas en mucosas14.
DiagnósticoPuede hacerse aislando el hongo de la sangre, médula ósea, líquido cefalorraquídeo, aspirado de médula o biopsia del tejido infectado. El cultivo se realiza en Sabouraud dextrosa agar con y sin antibióticos. El hongo se puede identificar por biología molecular mediante PCR frente al ADN fúngico (ITS o 18S ADNr)17,18.
En la visión directa del producto patológico, teñido con Giemsa, se observan las típicas formas de levadura intracelulares, con un halo alrededor que simula cápsula (fig. 1).
TratamientoConsiste en itraconazol durante 6 a 24meses o anfotericinaB14.
CriptococosisLa criptococosis es una micosis sistémica causada por una levadura encapsulada del género Cryptococcus, con 2 especies más frecuentes: C.neoformans y C.gatii. La principal puerta de entrada al organismo es a través de los pulmones. Las manifestaciones clínicas varían desde la colonización pulmonar asintomática a la diseminación sistémica. La meningoencefalitis es la principal manifestación clínica19,20.
C.neoformans se encuentra comúnmente en el suelo, en el excremento de palomas y murciélagos. En centros urbanos la diseminación es por el polvo doméstico de los árboles20.
ClínicaLas levaduras y las esporas inhaladas llegan a los espacios alveolares y el desarrollo de la enfermedad dependerá de la eficacia fagocítica de los macrófagos, así como de la respuesta inmune celular del huésped. Las formas clínicas pueden ser: pulmonar, del sistema nervioso central (SNC), diseminada y mucocutánea20. La forma pulmonar suele ser asintomática, inespecífica o semejando una tuberculosis aguda. La más frecuente es la del SNC, presentándose en forma de meningitis crónica, de meningoencefalitis o de granuloma criptocócico cerebral. La forma mucocutánea corresponde a metástasis de la forma diseminada, observándose pápulas y nódulos subcutáneos (fig. 5) en la cara y la nuca principalmente en pacientes VIH positivos, generalmente en la etapa avanzada del sida15,20.
Dado el gran polimorfismo que pueden presentar las lesiones, el diagnóstico puede ser dificultoso. Los diagnósticos alternativos más frecuentemente contemplados en la literatura son el molusco contagioso y las infecciones herpéticas20.
Este polimorfismo, que es frecuente en pacientes con diferentes enfermedades como el VIH etapa sida, los linfomas, la sarcoidosis, la diabetes o en pacientes trasplantados, y que además puede ser secundario a múltiples agentes microbiológicos, obliga a un estudio exhaustivo y minucioso.
DiagnósticoLas levaduras de Cryptococcus son células grandes que tienen cápsulas que se observan mejor mediante microscopia con tinciones de tinta china (fig. 5) o con tinción de mucicarmín de Mayer. El cultivo en medio de agar dextrosa Sabouraud presenta crecimiento entre 24 a 48h o más de una semana. Las pruebas serológicas son rápidas y específicas. Entre las pruebas inmunológicas destaca la aglutinación-látex en suero para detectar el antígeno capsular, con sensibilidad y especificidad >80%21. La identificación se puede hacer mediante biología molecular con diferentes técnicas de PCR22, o bien por espectrografía de masa MALDI-ToF23, siendo la ventaja de este último el hecho de que con cultivo positivo la identificación es casi inmediata (10min), con una correlación del 100% en comparación con las técnicas de secuenciación de ADN24-26.
TratamientoEl tratamiento se realiza con anfotericinaB desoxicolato o liposomal, con o sin fluorocitosina o fluconazol20.
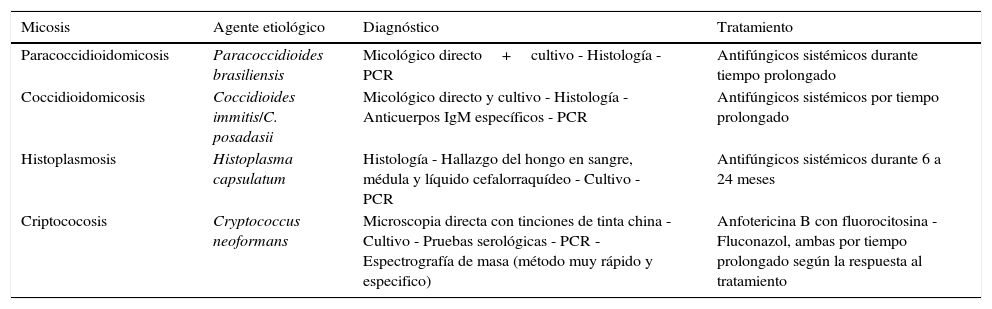
ConclusiónEn el presente artículo hemos revisado las manifestaciones cutáneas de las micosis sistémicas (tabla 1). Es importante reconocerlas, ya que se trata de patologías de alta mortalidad en las cuales el dermatólogo puede cumplir un papel central al realizar el diagnóstico oportuno, ya sea por el aspecto clínico o debido a que la piel otorga el mejor sitio para realizar un examen diagnóstico certero como la biopsia cutánea.
Resumen de las características de las micosis sistémicas
| Micosis | Agente etiológico | Diagnóstico | Tratamiento |
|---|---|---|---|
| Paracoccidioidomicosis | Paracoccidioides brasiliensis | Micológico directo+cultivo - Histología - PCR | Antifúngicos sistémicos durante tiempo prolongado |
| Coccidioidomicosis | Coccidioides immitis/C. posadasii | Micológico directo y cultivo - Histología - Anticuerpos IgM específicos - PCR | Antifúngicos sistémicos por tiempo prolongado |
| Histoplasmosis | Histoplasma capsulatum | Histología - Hallazgo del hongo en sangre, médula y líquido cefalorraquídeo - Cultivo - PCR | Antifúngicos sistémicos durante 6 a 24 meses |
| Criptococosis | Cryptococcus neoformans | Microscopia directa con tinciones de tinta china - Cultivo - Pruebas serológicas - PCR - Espectrografía de masa (método muy rápido y especifico) | Anfotericina B con fluorocitosina - Fluconazol, ambas por tiempo prolongado según la respuesta al tratamiento |
Los autores declaran no tener ningún conflicto de intereses.