En los pacientes con linfoma primario cutáneo de células B de la zona marginal (LPCBZM), la afectación de la médula ósea en el momento del diagnóstico es poco frecuente. Además, es raro en estos pacientes detectar afectación de la médula ósea al diagnóstico de forma aislada. Los pocos casos de LPCBZM y afectación inicial de la médula ósea habitualmente presentan también afectación secundaria nodal o visceral que son detectadas con otras pruebas de estadificación (normalmente con la TAC). Por dicho motivo, en los últimos años ha sido tema de controversia si debe realizarse la biopsia de médula ósea al diagnóstico de forma sistemática en todos los casos de LPCBZM dado el buen pronóstico y la baja incidencia de infiltración medular y/o afectación extracutánea por parte de este tipo de linfoma.
Bone marrow involvement at the time of diagnosis is uncommon in patients with primary cutaneous marginal zone B-cell lymphoma (PCMZL). Moreover, in these patients such involvement is rarely found in isolation on diagnosis. Typically the few patients with PCMZL who have early bone marrow involvement also present secondary nodal or visceral involvement, which is detected by other staging studies (usually computed tomography). In recent years, this has given rise to some debate about whether a bone marrow biopsy should be routinely performed in patients diagnosed with PCMZL in view of the good prognosis and low incidence of bone marrow infiltration and/or extracutaneous involvement in this type of lymphoma.
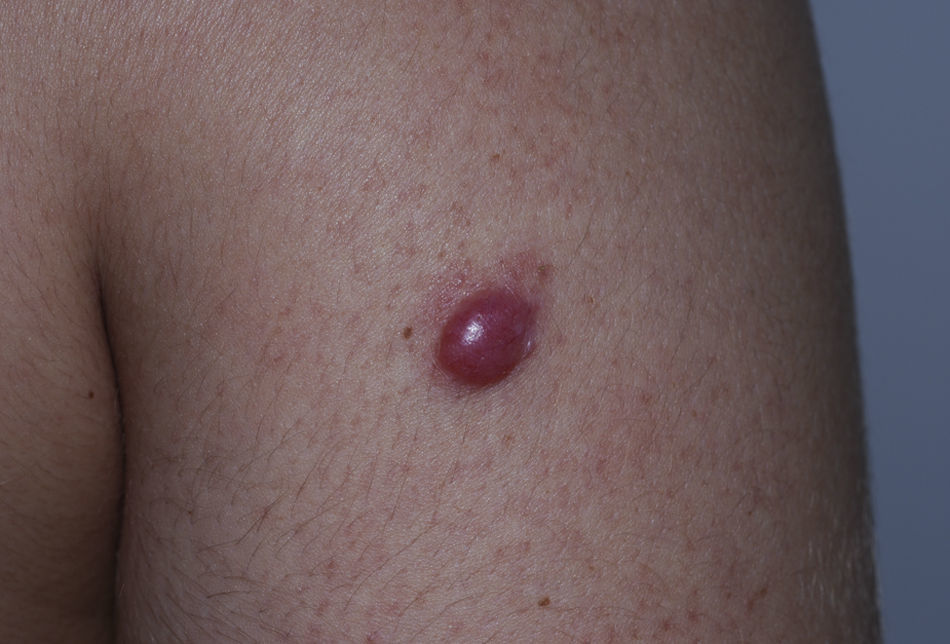
El linfoma primario cutáneo de células B de la zona marginal (LPCBZM) o linfoma de células B de la zona marginal extranodal asociado al tejido linfoide de mucosas (linfoma tipo MALT) con presentación en la piel se define como un linfoma indolente de células B que se presenta inicialmente en la piel sin enfermedad extracutánea en el momento del diagnóstico, y es uno de los principales subtipos de linfomas de células B cutáneos1,2. Se presentan clínicamente como nódulos o placas infiltradas solitarias o múltiples, a menudo localizadas en el tronco o en la parte proximal de las extremidades (fig. 1). Afecta a pacientes de edad mediana y muestra una cierta predisposición por el sexo masculino. Su comportamiento es indolente, permaneciendo localizados en la piel, aunque son frecuentes las recidivas cutáneas localizadas en las zonas iniciales y/o a distancia. En una minoría de casos puede presentarse afectación extracutánea en el momento del diagnóstico o a lo largo de la evolución, tanto en otros territorios MALT (el tubo digestivo, las glándulas salivales, el tiroides, la mama, el pulmón, la órbita), como en los ganglios linfáticos o la médula ósea. No obstante, el pronóstico es en general excelente con una supervivencia a los 5 años próxima al 100%3–7.
Estudio de extensión del linfoma primario cutáneo de células B de la zona marginalLa valoración inicial de un paciente con sospecha de LPCBZM debe incluir, con el objetivo de descartar una posible afectación sistémica, una historia clínica y una exploración física detallada (presencia de síntomas B, examen cutáneo completo y palpación de ganglios linfáticos y visceromegalias). El estudio de extensión debe incluir analítica con recuento y fórmula de células en sangre periférica; perfil bioquímico convencional con niveles de lactatodeshidrogenasa (LDH) y de beta-2 microglobulina; y serologías de virus de la hepatitis C, virus herpes tipo 8, citomegalovirus, virus Epstein Barr y Borrelia burgdorferi. Como prueba de imagen debe realizarse una tomografía axial computarizada (TAC) toracoabdominal que incluya ventana pélvica. Además, los estudios pioneros proponían incluir sistemáticamente la biopsia de médula ósea dentro del estudio de extensión inicial6.
Biopsia de médula óseaLa biopsia de médula ósea se considera una prueba diagnóstica invasiva que consiste en la extracción de un pequeño fragmento de hueso que contiene en su interior una pequeña cantidad de médula ósea mediante el uso de una aguja de biopsia. Habitualmente la realizan los hematólogos y la muestra suele obtenerse de la cresta ilíaca. Aunque se utiliza anestesia local, el estudio es molesto y en algunas ocasiones doloroso para el paciente. En algunos casos el médico deberá realizar una fuerte presión al introducir la aguja de biopsia y el paciente puede sentir un dolor agudo y momentáneo cuando la aguja atraviesa el hueso. Después del procedimiento el paciente puede experimentar molestia o dolor en la zona, que generalmente cede en las horas siguientes con la ayuda de analgésicos habituales. Otros efectos secundarios del proceso son el hematoma local o el sangrado en la zona de punción y el riesgo de infección local o del hueso biopsiado, lo cual hoy en día es muy excepcional por las condiciones de asepsia con las que se realiza la prueba. Desde el punto de vista histológico, la infiltración del linfoma B de la zona marginal (LBZM) extranodal no adopta un patrón de infiltración específico, pudiendo observarse infiltración de la médula ósea con un patrón nodular, intersticial, paratrabecular, difuso o sinusoidal. La mediana de la superficie de extensión medular infiltrada por parte del LBZM extranodal es del 5%, lo que supone en ocasiones un reto diagnóstico para el patólogo8–10.
A diferencia de los LBZM esplénicos y nodales, que tienden a infiltrar la médula ósea en el 67-100% y 30-40% de los casos respectivamente, los LBZM extranodales infiltran la médula ósea con mucha menor frecuencia y de forma global lo hacen alrededor del 10% de los casos8.
Linfoma primario cutáneo de células B de la zona marginal y afectación de la médula ósea al diagnósticoEn los pacientes con LPCBZM la afectación de la médula ósea en el momento del diagnóstico es poco frecuente. Además, es raro en estos pacientes detectar afectación de la médula ósea al diagnóstico de forma aislada. Los pocos casos de LPCBZM y afectación inicial de la médula ósea habitualmente presentan también afectación secundaria nodal o visceral, que son detectadas con otras pruebas de estadificación (normalmente con la TAC). Por dicho motivo, en los últimos tiempos se considera un tema controvertido si es o no necesaria la realización de la biopsia de médula ósea al diagnóstico en todos los casos de sospecha de LPCBZM. Kim et al.11, en un artículo de consenso entre el grupo de linfoma cutáneo de la Organización Europea de Investigación y Tratamiento del Cáncer (EORTC) y la Sociedad Internacional del Linfoma Cutáneo (ISCL), proponen una nueva clasificación para la estadificación TNM de los linfomas cutáneos diferentes de la micosis fungoide y el síndrome de Sézary. En este artículo se recogen las pruebas recomendadas para la estadificación inicial de dichos linfomas (tabla 1). Respecto a la realización de la biopsia de médula ósea, es importante señalar que la consideran imprescindible en aquellos casos de linfomas con riesgo de diseminación extracutánea y de comportamiento intermedio o agresivo según la clasificación WHO-EORTC (tabla 2) (el linfoma natural killer, el linfoma de células T CD8+, el linfoma de células T gamma-delta y el linfoma B difuso de células grandes tipo de las piernas). Por el contrario, en los linfomas de comportamiento clínico indolente, entre los que se incluye el LPCBZM, además del linfoma primario cutáneo B centrofolicular (LPCBCF) y del linfoma anaplásico de células T CD30+, la biopsia de médula ósea se plantea como optativa, a menos que otras pruebas de estadificación resulten positivas. Analizando exhaustivamente la literatura hemos comprobado que existen muy pocos artículos12–15 que revisen de forma específica la afectación de la médula ósea al diagnóstico en los LPCBZM, y menos aún que aborden el tema acerca de si la biopsia de médula ósea deba realizarse o no en los LPCBZM de manera rutinaria. Estos estudios12–14 confirman la baja frecuencia de afectación inicial de la médula ósea en los LPCBZM y también sugieren que la biopsia de médula ósea no estaría justificada de forma rutinaria en la evaluación inicial de estos linfomas. El artículo más relevante al respecto es el de Senff et al.12, donde tras revisar 275 resultados de biopsias de médula ósea en 193 LPCBCF y 82 LPCBZM, encuentran afectación de la misma en el momento del diagnóstico del linfoma en 22 LPCBCF (11%), de los cuales solo 9 muestran implicación de la médula ósea como signo único de diseminación extracutánea; y en 2 LPCBZM (2%), siendo solo en uno de ellos la única afectación extracutánea. Sin embargo, en otras guías, entre las que se incluye la del grupo de Hemato-Oncología de Holanda y Bélgica siguen manteniendo la biopsia de médula ósea como parte de la estadificación rutinaria en todos los pacientes con linfoma no-Hodgkin16. Los criterios de realización de la biopsia de médula ósea varían en las diferentes guías clínicas de los grupos de trabajo. Revisando la literatura puede observarse que la mayoría de los grupos (austríaco, holandés e italiano) solicitan la biopsia de médula ósea en todos los casos, si bien es cierto que son trabajos previos al artículo de consenso publicado en 20073,5,17. Por otro lado, el grupo de Chicago, Gerami et al., revisa 30 casos de LPCBZM y encuentra que solamente se realizó la biopsia de médula ósea en la mitad de los mismos4.
Recomendaciones de la EORTC/ISCL para la estadificación inicial en los linfomas cutáneos diferentes de MF/SS11
| Historia clínica y exploración física completas |
| Estudios de laboratorio |
| Hemograma y bioquímica completos, incluyendo niveles de LDH |
| Siempre que esté indicado, estudio de citometría de flujo de células mononuclerares de sangre periférica |
| Pruebas de imagen |
| TAC de tórax, abdomen y pelvis con contraste; incluir TAC o ecogragría de cuello si adenopatías cervicales |
| PET corporal total (como prueba de imagen alternativa a la TAC con contraste) |
| Aspirado y biopsia de médula ósea |
| Requerida en los linfomas de comportamiento clínico intermedio o agresivo según la clasificación de la WHO-EORTC |
| Debe ser considerada en los linfomas cutáneos de comportamiento clínico indolente, pero no obligada a menos que otras pruebas de estadificación resulten positivas |
EORTC: Organización Europea de Investigación y Tratamiento del Cáncer; ISCL:Sociedad Internacional del Linfoma Cutáneo; TAC: tomografía axial computarizada; MF: micosis fungoide; SS: Síndrome de Sezary.
Clasificación de la WHO-EORTC de los linfomas primarios cutáneos
| Linfomas cutáneos de células T |
| Comportamiento clínico indolente |
| Micosis fungoides |
| MF foliculotropa |
| Reticulosis pagetoide |
| Piel laxa granulomatosa |
| Linfoma primario cutáneo anaplásico de células grandes |
| Papulosis linfomatoide |
| Linfoma de células T subcutáneo paniculitis-like |
| Linfoma primario cutáneo de células T CD4+pequeñas/medianas pleomórfico |
| Comportamiento clínico agresivo |
| Síndrome de Sézary |
| Linfoma primario cutáneo de células T/NK, tipo nasal |
| Linfoma primario cutáneo de células T CD8+agresivo |
| Linfoma primario cutáneo de células T gamma/delta |
| Linfoma primario cutáneo de células T periférico, inespecificado |
| Linfomas cutáneos de células B |
| Comportamiento clínico indolente |
| Linfoma primario cutáneo de células B de la zona marginal |
| Linfoma primario cutáneo de células B de células centrofoliculares |
| Comportamiento clínico intermedio |
| Linfoma primario cutáneo de células B difuso de células grandes, tipo de las piernas |
| Linfoma primario cutáneo de células B difuso de células grandes, otros |
| Linfoma primario cutáneo de células B intravascular de células grandes |
De todos modos, en el caso de los LPCBZM, el hecho de no realizar la biopsia de médula ósea va a tener unas consecuencias clínicas muy limitadas. Si durante la estadificación inicial a un paciente con lesiones cutáneas de LBZM (incluida la biopsia de médula ósea) aquel resulta negativo, de acuerdo con la clasificación de la WHO-EORTC, este paciente quedaría clasificado como LPCBZM. Si, por el contrario, fuese posible identificar la infiltración tumoral a distancia a través de la biopsia de médula ósea u otra fase la estadificación, el paciente no tendrá un linfoma primario cutáneo y, según esto, debería ser clasificado según la clasificación de la WHO como un LBZM extranodal con presentación inicial en la piel y afectación del tejido MALT correspondiente. Por último, si no realizamos la biopsia de médula ósea y los otros métodos de estudio de extensión son negativos, desde un punto de vista semántico tampoco podríamos confirmar que se trate de un LPCBZM. Se trataría de un LBZM extranodal con lesiones cutáneas. Cambia el modo de clasificarlos, pero en todos los casos se trata de linfomas con comportamiento indolente y el tratamiento y el pronóstico no variarán sustancialmente. El tratamiento de un LBZM extranodal con lesiones cutáneas y afectación aislada de la médula ósea no difiere del de un LPCBZM. En ambos casos, la primera opción terapéutica es el tratamiento dirigido a la piel con radioterapia local, aunque con un seguimiento más estrecho de los primeros12.
Por otro lado, si el LPCBZM por definición debe estar limitado a la piel en el momento del diagnóstico, para su correcto diagnóstico es por tanto necesario realizar una estadificación oncológica que descarte la presencia de linfoma sistémico con participación cutánea secundaria. Por consiguiente, si de ahora en adelante no se va a practicar de forma rutinaria la biopsia de médula ósea en estos pacientes, tampoco se podrá realizar el diagnóstico de linfoma primario cutáneo con certeza. Esto último dificultaría el conocimiento de las diferencias patogenéticas entre los distintos tipos de linfomas MALT según su localización, en términos de translocaciones y estímulos antigénicos involucrados en su desarrollo.
ConclusiónEn nuestra opinión, la biopsia de médula ósea sería necesaria para el diagnóstico y la clasificación del linfoma cutáneo desde un punto de vista teórico, si bien es cierto que desde el punto de vista clínico su aportación es limitada, y si no se realiza, solo se dejaría de diagnosticar muy pocos casos con afectación aislada de la médula ósea. Creemos que serían necesarios más estudios prospectivos y con mayor número de pacientes donde se estudie la afectación aislada de la médula ósea en los pacientes con LPCBZM que permitan indagar sobre el significado, las implicaciones terapéuticas y el pronóstico de esta infiltración medular con el fin de poder concluir en un futuro si la biopsia de médula ósea en la estadificación inicial es o no necesaria realizarla de forma rutinaria en este tipo de linfomas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses