El melanoma sigue siendo un problema sanitario de primera magnitud. Se trata de uno de los tipos más frecuentes de tumor en adultos jóvenes1. Por otro lado, su incidencia y mortalidad han aumentado en las últimas décadas2–4.
Aunque el melanoma metastásico es solo curable en contadas ocasiones, los nuevos tratamientos de inmunoterapia5–7 (altas dosis de IL-2, ipilimumab —anti-CTL4—, pembrolizumab y nivolumab —anti PD1—, etc.) y los tratamientos combinados frente a mutaciones específicas8–9 (inhibidores de BRAF, inhibidores de MEK, inhibidores del c-KIT, etc.) aumentan la supervivencia en estadios iii y iv. En ocasiones, el melanoma se diagnostica en fase avanzada, sin el hallazgo del tumor primario tras una exploración física exhaustiva. El melanoma metastásico de primario desconocido se define como la presencia histológica de melanoma en un ganglio, órgano u otro tejido sin una historia o evidencia de lesión primaria cutánea, mucosa u ocular. Se estima que constituye el 3,2% del total de los melanomas y parece tener un mejor pronóstico que el de origen conocido10.
Presentamos los casos de 2 pacientes atendidos en hospitales de tercer nivel, que se orientaron como melanoma metastásico de primario desconocido y que posteriormente acudieron a nuestro centro solicitando una segunda opinión.
Casos clínicosVarón de 67 años valorado en el hospital de su localidad por una gran masa adenopática inguinal izquierda. Tras el estudio histológico e inmunohistoquímico de una de las adenopatías se diagnosticó de melanoma metastásico de origen desconocido. Fue valorado por un oncólogo y un dermatólogo sin llegar a descubrir el melanoma primario, y dado que no era candidato a tratamiento con inmunoterapia y carecía de la mutación en BRAF, recibió 3 sesiones de quimioterapia durante varios meses. Estaba pendiente de reducción de masa inguinal para realizar la linfadenectomía paliativa.
Curiosamente, esa misma semana valoramos al segundo paciente. Se trataba de un varón de 45 años, con una gran tumoración de rápido crecimiento en la región laterocervical izquierda, por la que consultó a su centro hospitalario de referencia. El estudio histológico e inmunohistoquímico de la masa orientó al diagnóstico de metástasis de melanoma, así como de la mutación del BRAF. En el estudio de extensión por PET-TC se hallaron también metástasis ganglionares en otras localizaciones. Tras una valoración multidisciplinar por un oncólogo, un dermatólogo, un otorrinolaringólogo y un oftalmólogo se diagnosticó de melanoma metastásico de origen desconocido y se aconsejó iniciar tratamiento combinado con un inhibidor de BRAF (vemurafenib) y un inhibidor de MEK (trametinib).
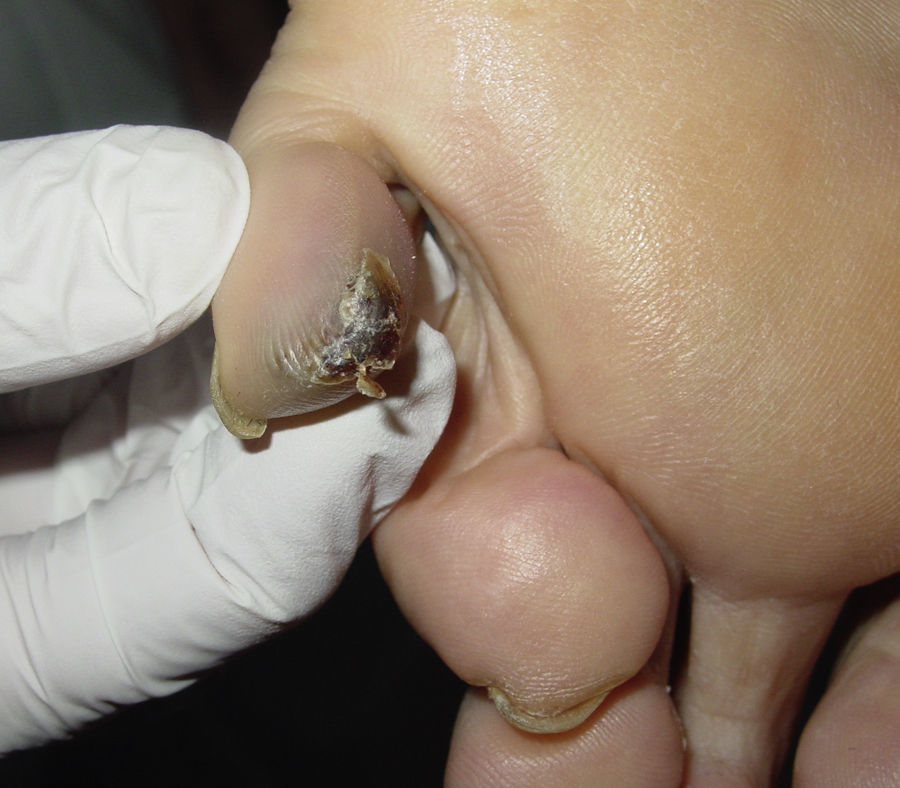
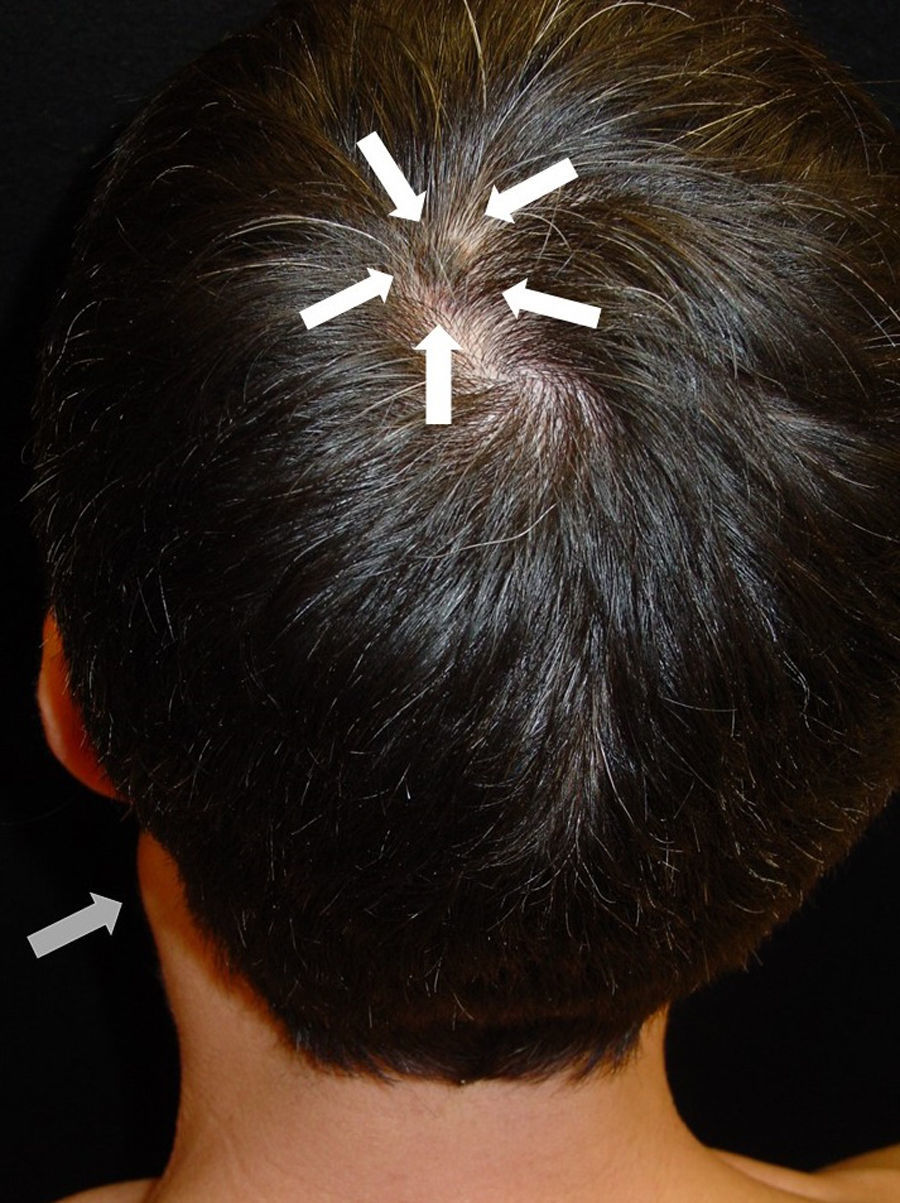
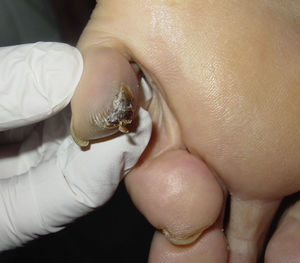
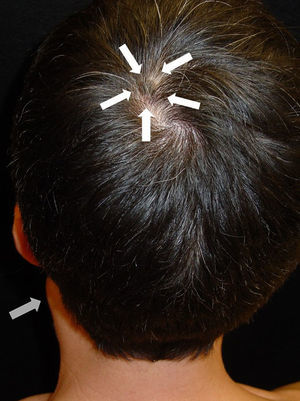
Tras la anamnesis y la exploración física de los pacientes se halló el tumor primario en los 2 casos: el primer paciente presentaba una lesión pigmentada oscura y queratósica de 1,5×1cm, con signo de Hutchinson, en el pulpejo del primer dedo del pie izquierdo (fig. 1). El segundo paciente presentaba una lesión hiperpigmentada de 2×1,5cm de diámetro en la región parietal izquierda, con un patrón dermatoscópico atípico característico (fig. 2). En ambos casos la lesión era evidente y estaba en el territorio cutáneo que había que explorar por la localización metastásica ganglionar. Eso sí, exigían una mínima minuciosidad exploratoria porque estaban respectivamente en un área pilosa del cuero cabelludo y en la zona más acral del cuerpo.
Presentamos estos 2 casos que probablemente sean el reflejo de situaciones similares evitables en los departamentos de dermatología de nuestros hospitales. Aunque a priori pueda parecer que esta omisión diagnóstica no influirá en el seguimiento y enfoque terapéutico de los pacientes, el pronóstico de un melanoma difiere si el tumor primario es conocido o desconocido10.
La anamnesis detallada y la exploración física minuciosa son la base del diagnóstico en la dermatología. Un estudio de EE. UU.11 concluye que el porcentaje de dermatólogos que exploran de forma completa a los pacientes con factores de riesgo de melanoma no llega al 50%. Otros trabajos12–18 remarcan cómo la exploración física corporal total permite el diagnóstico precoz de un porcentaje elevado de melanomas en pacientes que acudían a la consulta por otro motivo.
Por tanto, la exploración física del paciente en una unidad de melanoma debe ser protocolizada y minuciosa. En primer lugar, hay que explorar al enfermo desnudo, con una iluminación adecuada, a ser posible con luz natural, valorando toda la superficie corporal, sin olvidar las zonas acras y las de difícil acceso para algunos pacientes (área retroauricular, región interdigital o plantas de los pies, etc.). No deben omitirse las mucosas (oral, genital, conjuntival, etc.) ni los anejos (uñas y áreas con folículos pilosos). Cuando el paciente haya sido diagnosticado de melanoma metastásico de primario desconocido será prioritaria la exploración exhaustiva del territorio cutáneo correspondiente para ese drenaje ganglionar.