En un informe rutinario dermatopatológico sobre un melanoma se recoge una significativa información pronóstica para el manejo de estos pacientes y que actualmente es empleada en la estadificación de la American Joint Committee on Cancer como el grosor tumoral, la presencia de ulceración, el número de mitosis y la presencia o no de microsatelitosis. Sin embargo, existen múltiples factores que si bien no están incluidos en esta clasificación, han demostrado tener un impacto pronóstico en diversos estudios y que son objeto del presente texto.
Skin histopathology reports of melanoma routinely include important prognostic information used in the staging system of the American Joint Committee on Cancer (AJCC). This information, which influences disease management, includes tumor depth, presence of ulceration, number of mitotic figures, and presence or absence of microsatellites. However, numerous studies have found many other factors that are not included in the AJCC classification but that are nevertheless of prognostic significance. We discuss these factors in this paper.
La estadificación del melanoma publicada por la American Joint Committee on Cancer recientemente1 puede considerarse, probablemente, como la mejor dentro de las distintas estadificaciones tumorales. Es un sistema de estadiaje que recoge datos de más de 50.000 pacientes con melanoma pertenecientes a grandes centros de referencia de tres continentes distintos.
Pese a los grandes esfuerzos que se han realizado en las últimas décadas en la identificación de factores pronósticos en el melanoma cutáneo para el estadio localizado (estadio I y II), la estadificación de la AJCC recoge únicamente el grosor tumoral, la ulceración y el número de mitosis (este último, sólo incluido para los melanomas finos [T1]) como los factores pronósticos que mejor discriminan las curvas de supervivencia de esta gran base de datos.
Sin embargo, se hace necesario seguir investigando otros factores pronósticos que expliquen mejor el comportamiento de los melanomas y, por tanto, las curvas de supervivencia de estos. En el siguiente texto se revisan los distintos factores pronósticos que pueden ser recogidos en un informe dermatopatológico de un melanoma, así como diversos factores clínicos que han demostrado significación estadística como determinantes pronósticos en estudios previos.
GéneroEn la mayoría de las series sobre población caucásica la incidencia de melanoma es superior en las mujeres. Sin embargo, en las últimas décadas la incidencia en hombres ha experimentado un gran aumento, relativamente superior al de las mujeres2,3.
Existen múltiples estudios epidemiológicos que demuestran una clara ventaja en la supervivencia de las mujeres con un melanoma primario4–6. Por este motivo, en un primer momento, se sugirió que el melanoma pudiera tener una relación estrógeno dependiente. Sin embargo, la evidencia actual basada en la ausencia de receptores estrogénicos o la falta de respuesta a antiestrógenos permite descartar esta posibilidad7,8. Este efecto positivo sobre la supervivencia del género femenino se observa en otras neoplasias internas, como el carcinoma de pulmón, colorrectal, gástrico, esofágico y los sarcomas de tejidos blandos9. En el caso del melanoma hay que añadir que otros factores, como el grosor o la localización, pudieran ser los responsables de esta diferencia en la supervivencia. De esta forma, las mujeres tienden a presentar melanomas más finos10,11 y con más frecuencia localizados en las extremidades, mientras que, por el contrario, son más frecuentes en el tronco en los hombres, localización que tiene un peor pronóstico. El género muestra en general un beneficio en la supervivencia a los 5 y 10 años entre un 10-20% más para las mujeres en la mayoría de los estudios12,13. Esta ventaja podría desaparecer después de los 65 años14.
LocalizaciónLa localización del melanoma primario ha demostrado ser un factor pronóstico independiente de la supervivencia15. En general, los pacientes con melanomas ubicados en las extremidades, salvo la localización en manos y pies, han demostrado tener una mayor supervivencia que la de los de localización axial15. En el caso del melanoma localizado se observó un 90% de supervivencia a los 10 años en los casos de melanomas en las extremidades, frente a un 70% de supervivencia en los de localización axial16. Clásicamente se identificaban las denominadas áreas BANS (espalda [back], cara posterior del brazo [arm], cara posterior del cuello [neck], cuero cabelludo [scalp]) que implican un peor pronóstico para los melanomas ubicados en estas áreas17. Dentro de estas 4 áreas los pacientes que muestran una menor supervivencia son aquellos en los que su melanoma se ubica en el cuero cabelludo seguido del cuello, la espalda y los brazos18.
Estudios de áreas más concretas ponen de manifiesto que los pacientes con melanomas localizados en el antebrazo y en la zona anterior del brazo tienen mejor pronóstico que los localizados en las manos o la zona posterior del brazo19, o bien que existe un peor pronóstico para los pacientes con melanomas localizados en la zona media e inferior de la espalda y la zona mamaria y supramamaria20.
Una explicación del peor pronóstico que tienen los pacientes con melanomas ubicados en el tronco con respecto a las extremidades puede deberse a las diferencias en el drenaje linfático entre estas áreas. Para el tronco no sólo existe la posibilidad de drenaje a las áreas axilares o inguinales, sino también la posibilidad de drenaje hacia el mediastino y a los ganglios de localización paraórtica21, lo que justificaría la existencia de un patrón de diseminación diferente entre estas áreas con respecto a los localizados en las extremidades con un menor porcentaje de diseminación sistémica y, por tanto, unas mejores curvas de supervivencia22,23.
EdadLa edad avanzada se ha relacionado con el diagnóstico de melanomas con un fenotipo más agresivo, principalmente un mayor grosor y la presencia de ulceración, hecho constatado en múltiples estudios24–27. Algunos estudios han evidenciado que la edad avanzada es un factor pronóstico independiente de la supervivencia global28.
Este fenotipo más agresivo en este grupo de edad tiene varias justificaciones. Por un lado, estos pacientes le dan menos importancia a los cambios cutáneos que se observan. Además, realizan menos autoexploraciones que las personas más jóvenes29. Por último, es más frecuente la aparición de melanomas nodulares (MN), que a diferencia del melanoma de extensión superficial (MES) o el melanoma lentigo maligno (MLM) no se relaciona con los signos y síntomas precoces del melanoma30.
En el mayor estudio que hace referencia a la supervivencia por grupos de edad, tomando como datos censurados los pacientes perdidos o los fallecidos por otra causa, se observó que por debajo de los 40 años los pacientes presentan una supervivencia a los 10 años superior al 77%, mientras que esta va disminuyendo con cada década. De esta forma presentan un 69, 63 y 56% de supervivencia a los 10 años los pacientes de la sexta, séptima y octava décadas de la vida. Los ancianos mayores de 80 años presentan un 43% de supervivencia en el mismo periodo31.
Este peor pronóstico se ha explicado también a través de mecanismos de inmunosenescencia32, que resulta en una alteración de la reparación del daño en el ADN o una disminución en la capacidad de responder a estos tumores. Es un fenómeno poco conocido aún33.
En el caso del melanoma pediátrico parece que la edad de aparición es un factor importante; en una serie publicada los pacientes menores de 10 años de edad tienen una supervivencia libre de enfermedad a los 5 años superior a los mayores de 10 años (90 vs 47%)34. Esta diferencia no puede atribuirse al grosor tumoral, por lo que los melanomas en los niños más jóvenes podrían tener un comportamiento biológico diferente a los melanomas del adulto. El hecho de que la muestra en este estudio conste tan sólo de 33 pacientes condiciona que estos hallazgos deban valorarse con cautela.
Tipo histológicoDesde hace 40 años se describen 4 tipos clinicopatológicos principales: tres descritos inicialmente que corresponden al MES, el MLM y el MN35, a los que se unió años más tarde el melanoma lentiginoso acral (MLA)36,37. Estos subtipos pueden clasificarse en función de la presencia o no de fase previa de crecimiento radial (el MN carece de ella), y en caso de tenerla se diferencian en función del componente intraepidérmico. Este puede ser pagetoide (MES) o lentiginoso (MLM y MLA).
Estas diferentes variantes se han relacionado con el tipo de exposición solar, circunstancia apoyada por la expresión de BRAF o N-RAS en melanomas de zonas con exposición solar intermitente38. Por otro lado, los MLA se han relacionado con una mayor expresión de c-Kit39.
Se ha planteado la hipótesis de que estas formas histológicas tuvieran su origen en las células madre del folículo (en el caso del LMM), de la dermis (el MN) o de la capa basal de la epidermis (MES) en función de los hallazgos dermatoscópicos de cada uno40.
Sin embargo, hoy en día algunos autores son muy críticos con esta clasificación. Para ello se basan en que no son pocos los casos en los que se observa un solapamiento de los hallazgos histopatológicos clásicos, y además no tiene utilidad pronóstica más allá de la que se produce por la propia localización del melanoma, por lo que ven poco útil el seguir empleando estos términos41,42. Por el contrario, parece más probable que en el futuro se acaben estableciendo clasificaciones que permitan clasificar el melanoma a partir de alteraciones moleculares de mayor trascendencia pronóstica y terapéutica43.
Existen otras variantes menos frecuentes de melanoma; cabe destacar el melanoma desmoplásico constituido por células fusiformes en un estroma fibrótico. En algunos estudios se han considerado dos subvariantes: la forma de presentación “pura”, cuando la lesión es completamente desmoplásica, y “combinada” cuando existen en la misma lesión otras áreas en las que se observan otras estructuras de melanoma convencional44. La evidencia disponible permite sugerir que los melanomas desmoplásicos “puros” tendrían un mejor pronóstico que los de la variante combinada45. El melanoma desmoplásico suele iniciarse con un grosor tres veces superior a cualquier otro. La implicación que esto tiene en la supervivencia es contradictoria; mientras que en algunos estudios se concluye que los pacientes con estos melanomas muestran una supervivencia bastante mayor que los melanomas convencionales de grosor equiparable46, en otros se ha demostrado que cuando se ajustan por el grosor tumoral la supervivencia es similar47.
Existen otras series cortas de tipos histológicos muy poco frecuentes, como es el caso del melanoma tipo animal, una variante que se caracteriza por una intensa pigmentación marrón o negra y que puede aparecer en cualquier localización, incluidas las mucosas. El melanoma animal tiene una mayor propensión a las metástasis regionales. Sin embargo, parece que presenta una menor capacidad para el desarrollo de metástasis sistémicas48. En otras variantes de melanoma, como los nevoides, spitzoides, angiotrópicos o el nevus azul maligno su baja frecuencia impide conocer su impacto pronóstico49.
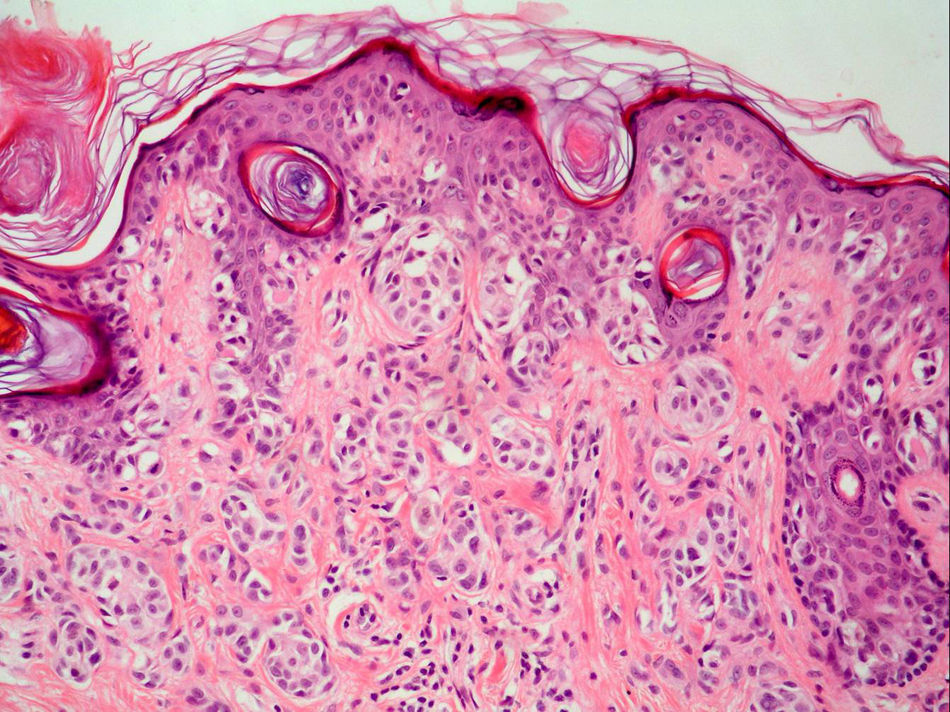
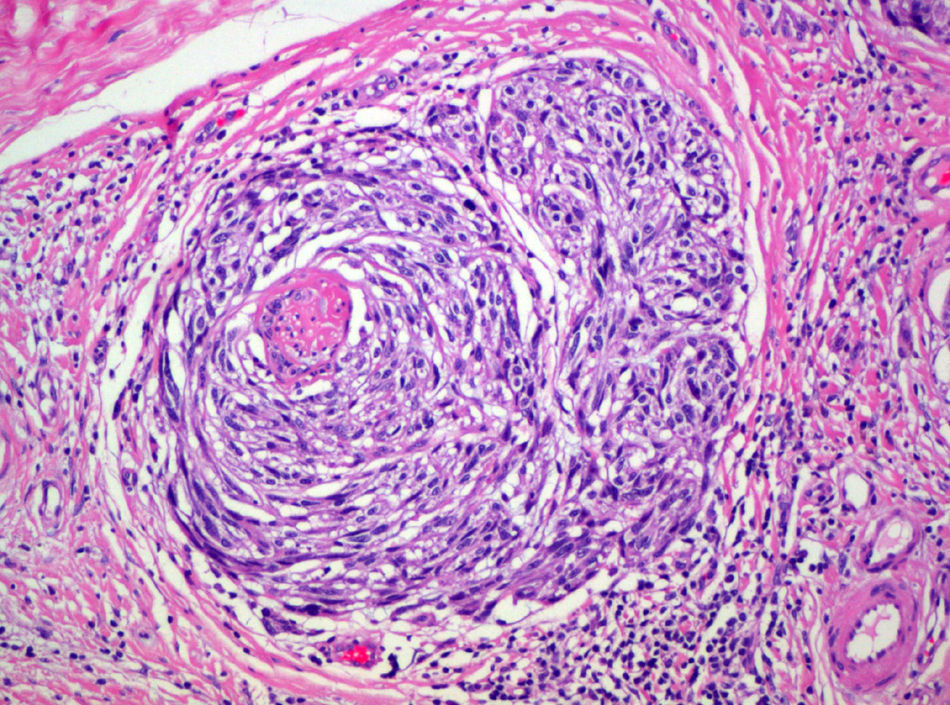
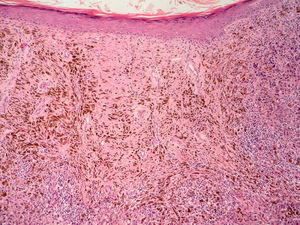
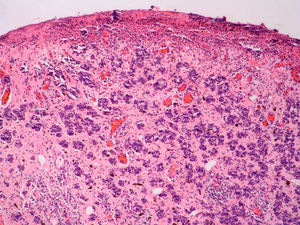
Fase de progresión tumoralSe consideran dos fases de progresión o de crecimiento, la fase radial y la vertical. Se habla de fase radial cuando los melanomas sólo muestran un componente intraepidérmico, es decir, un melanoma in situ, o aquellos que también presentan células en la dermis papilar, pero que bien son células aisladas, bien son tecas que tienen un menor tamaño que las que se encuentran en la epidermis y siempre en ausencia de mitosis (fig. 1). La fase de crecimiento vertical, por el contrario, muestra la presencia de mitosis o de nidos de células de mayor tamaño que en la epidermis50. Clark et al sugirieron por primera vez que aquellos melanomas que estaban en fase de crecimiento vertical presentaban un peor pronóstico, mientras que los que presentaban una fase de crecimiento radial tenían una supervivencia cercana al 100%15. En estudios de supervivencia multivariantes posteriores no se ha demostrado que la fase de progresión tumoral sea un factor pronóstico independiente51.
Sin embargo, los melanomas en fase radial no presentan metástasis en el ganglio centinela, por lo que este factor podría considerarse como criterio de exclusión para la realización de la biopsia selectiva del ganglio centinela52. Por el contrario, la presencia de fase vertical en los melanomas es un factor de riesgo para la diseminación en el ganglio centinela, incluso en los melanomas finos menores de 1mm. Este aumento del riesgo está condicionado por la presencia de mitosis y en menor medida por el género masculino53.
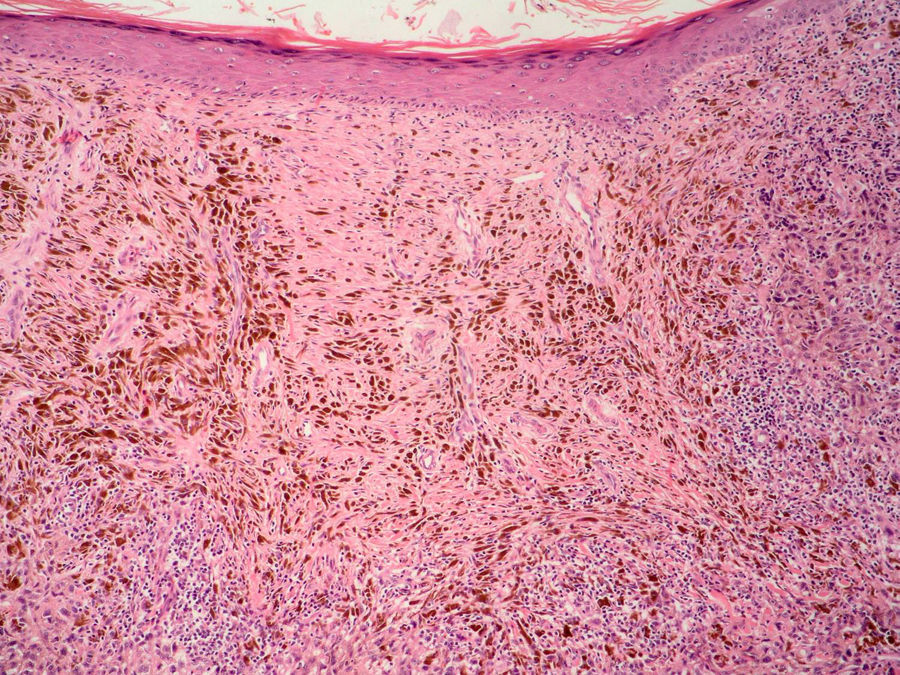
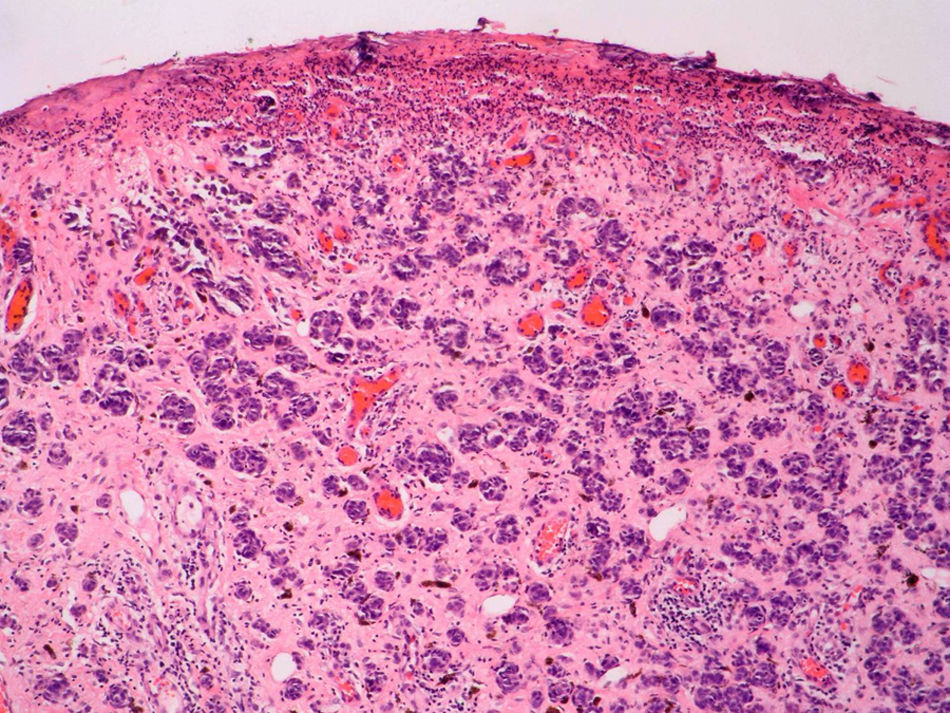
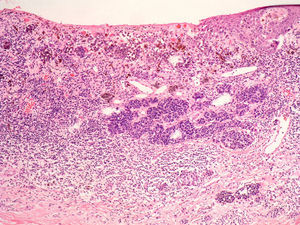
Regresión histológicaPese a que está presente entre un 10 y un 35% de los casos de melanoma, probablemente sea, entre los factores pronósticos clásicos, el que adolece de una mayor falta de consenso a todos los niveles, tanto en su descripción como en su utilidad pronóstica54.
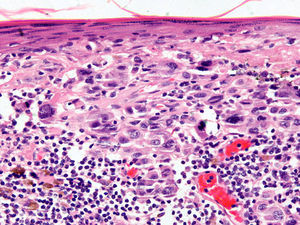
En la regresión histológica existe una disminución o desaparición de la porción dérmica del melanoma que es sustituido por fibrosis, apareciendo melanofagia y vasos neoformados que suelen disponerse perpendiculares a la epidermis (fig. 2)55.
La presencia de regresión se ha considerado clásicamente como un factor de mal pronóstico15, especialmente para los tumores delgados en los que se evidenciaba una extensión de la regresión mayor del 75% del tumor56. En un estudio sobre más de 9.500 pacientes la presencia de regresión mayor del 75% estaba presente en todos los casos es melanoma finos (< 0,8mm) que presentaban metástasis linfáticas regionales57. Se ha demostrado su mal pronóstico también cuando se ha considerado una extensión mayor o igual al 50% del tumor58. Sin embargo, otros autores no han podido demostrar este peor pronóstico59,60.
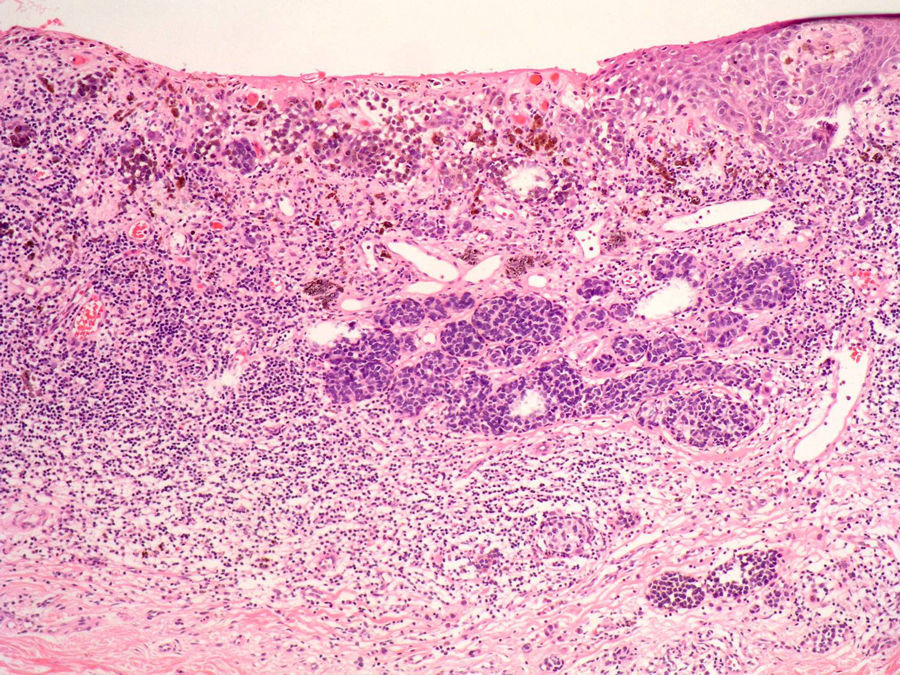
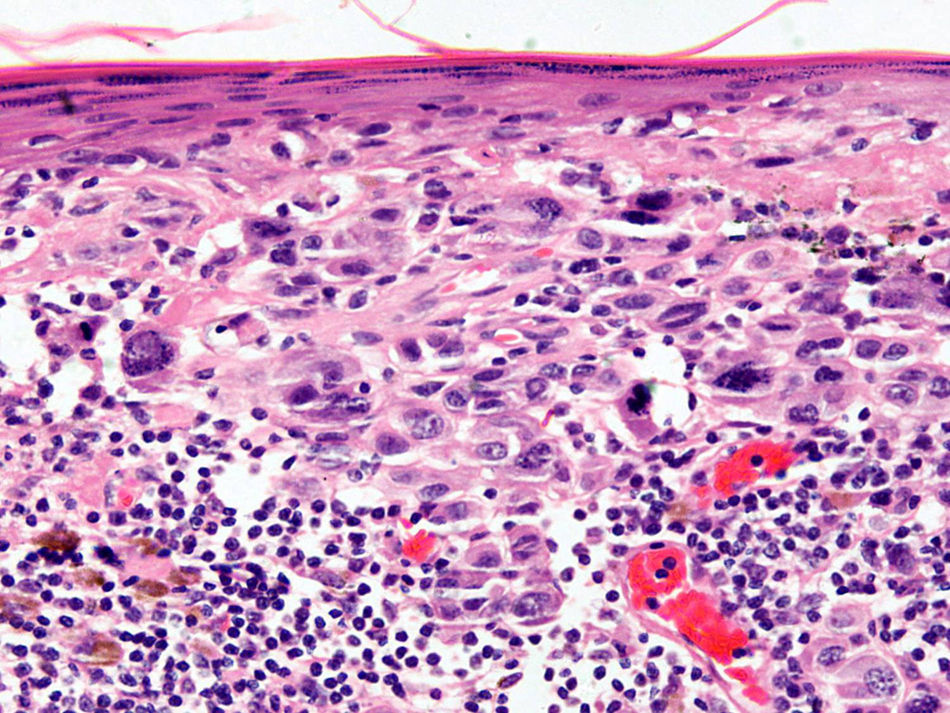
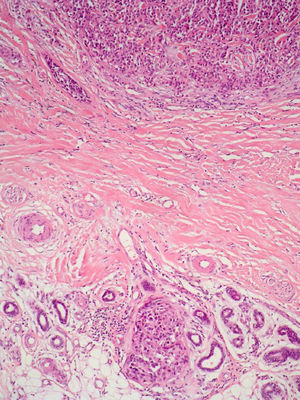
Infiltrado inflamatorioSe piensa que el sistema inmune desempeña un importante papel en el control del crecimiento del melanoma. Por este motivo el infiltrado inflamatorio asociado al tumor (tumor infiltrating lymphocytes [TIL]) se ha considerado una respuesta inmune del huésped hacia el melanoma. Sin embargo, su papel inmunológico, así como su implicación pronóstica aún son controvertidos.
De acuerdo con la descripción de Clark et al15 se debe considerar como TIL los linfocitos que bordean la fase de crecimiento vertical del melanoma o que la infiltran. Se considera que este infiltrado es intenso si infiltra todo el componente invasivo del tumor, o si rodea el margen profundo de la fase vertical (fig. 3). Se define como no intenso si el infiltrado es focal. Por último, se define como ausente si no existe, o si está presente pero no infiltra el tumor. En este estudio inicial la supervivencia global a los 8 años para los pacientes con melanoma en fase vertical fue del 88% para los pacientes con melanomas con TIL intensos, 75% para los pacientes con TIL no intenso y 59% para los pacientes con TIL ausentes. Con posterioridad se han publicado trabajos con resultados similares61, e incluso en un estudio la supervivencia fue del 100% a los 5 años (93% a los 10 años) en los pacientes con TIL intenso62. Por el contrario, otros autores no encontraron un beneficio en la supervivencia en cuanto al infiltrado. En el estudio de Barnhill et al51 sobre 548 pacientes la supervivencia a los 5 años fue de 86% para el grupo de TIL presente vs del 91% para los del grupo de TIL ausentes. Sin embargo, en este estudio se incluyeron los melanomas con fase radial y vertical, y además sólo un 25% de los casos tenía más de 1,7mm de espesor. Estas discrepancias podrían atribuirse en parte a las diferencias poblacionales de los diversos estudios. Por ejemplo, el ya comentado 25% de melanomas mayores de 1,7mm de Barnhill et al contrasta con el 82% en el de Clemente et al61 o el 74% en el trabajo de Turthill et al62.
La ausencia de TIL ha demostrado ser un factor pronóstico independiente predictivo de metástasis en el ganglio centinela, así como de recidivas regionales. Sin embargo, no se ha evidenciado que la supervivencia sea peor que en presencia de TIL63.
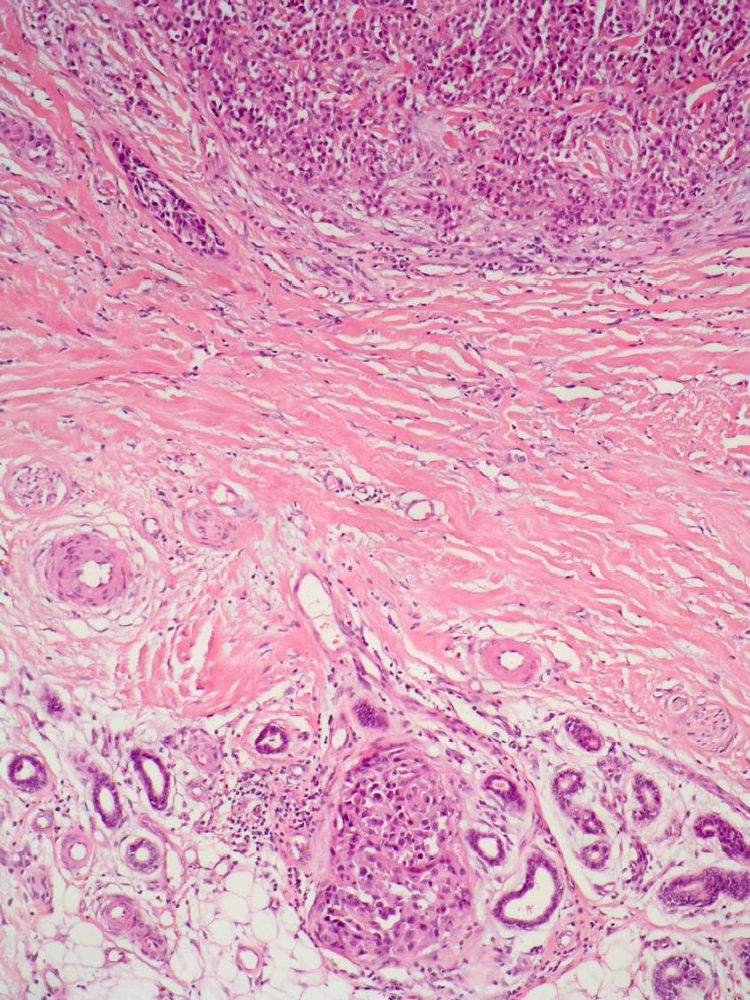
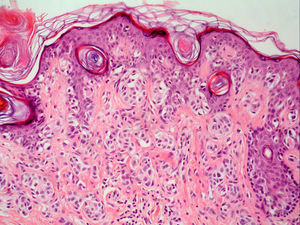
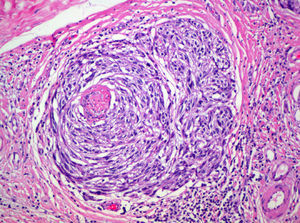
Satelitosis microscópica (microsatélites)Es un término empleado por primera vez por Day et al en 198164. Se refiere a la existencia de nidos de células de melanoma de un tamaño mayor de 0,05mm separados claramente de la masa tumoral por una capa de colágeno o grasa subcutánea de al menos 0,3mm (fig. 4).
Aunque la AJCC incluye la presencia de microsatelitosis en la categoría N2c de la clasificación TNM, lo que implica un estadio III1 y por tanto no debería ser objeto de revisión en este trabajo, los propios autores admiten que esta decisión se ha basado en los resultados de múltiples estudios de supervivencia que han demostrado una supervivencia similar a los pacientes con satelitosis macroscópicas65–67. Además, la inclusión en esta categoría se debe en parte a que se asume que las microsatelitosis representan una etapa previa en el desarrollo de las metástasis linfáticas.
Linfangiogénesis tumoralHoy en día existe evidencia de que el melanoma puede inducir la formación de nuevos vasos linfáticos y de que esta linfangiogénesis está relacionada con una mayor incidencia de metástasis en el ganglio centinela y con una menor supervivencia libre de enfermedad. Por tanto, la linfangiogénesis en el melanoma podría ser en el futuro un nuevo factor pronóstico.
El factor de crecimiento vascular endotelial-C (VEGF, por Vascular Endotelial Growth Factor-C), liberado por las células del melanoma y por los macrófagos asociados al tumor, probablemente representa el mayor factor linfangiogénico no sólo en el melanoma, sino también en muchos otros tumores68 conjuntamente con otros factores de crecimiento como el VEGF-D y el VEGF-A69,70.
La mayoría de los melanomas cutáneos metastatizan a través de los ganglios linfáticos regionales como primera localización metastásica22,23. Se sabe que la linfangiogénesis inducida por el tumor desempeña un papel activo en la génesis de las metástasis linfáticas regionales. El proceso se produce a través de la formación de un “nicho premetastásico” inducido por la expresión de VEGF en el melanoma primario69. Se ha correlacionado la extensión de la linfangiogénesis en el melanoma primario con la presencia de metástasis en el ganglio centinela en el momento de la cirugía71. De hecho, en un análisis multivariante la linfangiogénesis tumoral fue el factor pronóstico independiente con una mayor capacidad para predecir la positividad del ganglio centinela, incluso por delante del grosor tumoral72. También se ha correlacionado inversamente la linfangiogénesis con la supervivencia libre de enfermedad y con la supervivencia global73.
Invasión vascularSe considera que existe invasión vascular en el melanoma cuando se observan inequívocamente células de melanoma en la luz vascular, siendo un factor pronóstico independiente de mal pronóstico74,75. La presencia de invasión vascular es infrecuente para melanomas menores de 1,5mm, aumentando su frecuencia con el grosor75.
Se ha descrito también el concepto de “invasión vascular incierta”, en el que se observan células de melanoma adyacentes al endotelio vascular sin invadir la luz vascular75. El pronóstico para este grupo de pacientes es similar al del grupo con una “invasión vascular inequívoca”. El hecho de que la media de aparición de las recidivas sea algo superior en el patrón de invasión incierta lleva a pensar que este patrón es, en definitiva, un paso previo en la progresión del melanoma75.
El uso de marcadores inmunohistoquímicos vasculares no parece que aumente el diagnóstico de casos con invasión vascular comparado con la tinción de hematoxilina-eosina75,76.
Otro concepto descrito ha sido el de “angiotropismo”. Al igual que las células del melanoma pueden migrar por la periferia de estructuras, como los nervios o los anejos, también es posible que puedan migrar a través de la superficie externa de los vasos sanguíneos. El angiotropismo se observa principalmente en los pequeños vasos de los extremos del melanoma, y se ha propuesto como un nuevo mecanismo de metastatización extravascular77, siendo su observación más frecuente que la invasión vascular. Se ha relacionado con una mayor frecuencia de recidivas locales y de metástasis en tránsito78.
NeurotropismoSe define como la infiltración neoplásica de las fibras nerviosas con la subsecuente extensión del tumor a través de estos nervios (fig. 5). La presencia de neurotropismo determina la variante de melanoma desmoplásico neurotrópico (MND) dentro de los melanomas desmoplásicos (MD), ya que el melanoma neurotrópico sin desmoplasia es una entidad muy poco frecuente79.
En cuanto al pronóstico, en un estudio que contó con 190 pacientes con MD y 90 pacientes con MND no se encontraron diferencias significativas en lo que respecta a la supervivencia de ambos grupos comparadas con otras formas anatomoclínicas. La variante de MND se relacionó con una mayor frecuencia de recurrencias locales80. En un estudio más reciente se han publicado unas tasas de recurrencias locales más bajas. Es posible que esta diferencia se deba a la aplicación de unos márgenes de resección más adecuados81.
Atipia celularExisten escasos estudios que han evaluado la atipia celular como factor pronóstico (fig. 6). En un estudio sobre 669 pacientes se encontró que los pacientes con melanoma con una marcada atipia presentaban una supervivencia del 40% a los 10 años, comparada con el 60% para los melanomas con una atipia moderada y del 80% para el grupo con una atipia ligera82. En una serie de casos 11 de 12 casos que presentaron una atipia celular severa evolucionaron a enfermedad metastásica83.
Asociación con un nevus melanocítico previoLa presencia de un nevus en el estudio histológico de un melanoma ocurre en el 25% de los casos aproximadamente. En un estudio clásico de hace casi tres décadas Friedman et al determinaron sobre 557 pacientes un beneficio en la supervivencia libre de enfermedad a los 5 años en aquellos melanomas con presencia de nevus asociado (91 vs 78%). En un estudio más reciente también se evidenció que la presencia de nevus previo se relacionaba con una menor proporción de metástasis84, aunque no es un hecho que se haya podido corroborar en otros estudios85–87. Sin embargo, una historia previa de melanoma sobre nevus aporta 9 veces más riesgo para un segundo melanoma sobre nevus en estos pacientes88.
Tipo celularEl melanoma se presenta con una variedad celular amplia. No existen estudios que se hayan ocupado del valor pronóstico del tipo celular de una forma sistemática. En general, los melanomas con un tipo celular epitelioide son más susceptibles de desarrollar metástasis. Por el contrario, el tipo celular fusiforme le confiere un mejor pronóstico.
En un estudio la variedad de células pequeñas (fig. 7) se ha descrito como un factor pronóstico independiente, junto con la ulceración en el hallazgo de metástasis en el ganglio centinela89.
Hiperplasia epidérmica paratumoralLa hiperplasia epidérmica paratumoral hace referencia a los cambios que se producen en la epidermis adyacente al melanoma. Se define como la diferencia entre la penetración epidérmica paratumoral más profunda y el grosor de la epidermis normal. Se ha puesto de manifiesto que la presencia de hiperplasia epidérmica paratumoral, en especial si es mayor de 1mm, tiene un efecto protector en los melanomas gruesos84.
Índice de crecimiento del melanomaEste índice hace referencia a la velocidad con la que está creciendo un melanoma. La velocidad con la que crece un melanoma sería su volumen por unidad de tiempo. Sin embargo, no es posible en la mayoría de las ocasiones conocer el volumen real de un melanoma. Por este motivo, Grob et al en 2002 crearon este índice tomando el grosor tumoral (índice de Breslow) como valor subrogado del volumen y como medida de tiempo, el tiempo de evolución que los pacientes referían tener la lesión en los casos de novo, o bien el tiempo de evolución desde que se notaban cambios sobre una lesión melanocítica previa90, midiendo este índice en milímetros por mes. Posteriormente, se ha publicado que este índice se relaciona con un fenotipo de melanoma más agresivo, como el MN, un mayor índice mitósico, la presencia de ulceración y la amelanosis, así como una edad más elevada y el sexo masculino91. Recientemente se ha evidenciado que los melanomas que presentan un índice de crecimiento mayor de 0,4mm/mes tienen un peor pronóstico92.
En conclusión, los diferentes grupos de riesgo de los pacientes con melanoma que determinan los distintos estadios recogidos en la nueva versión de la AJCC se basan en tan sólo tres factores, que son el grosor tumoral, la ulceración y el número de mitosis. Sin embargo, son muchos más datos los que se pueden obtener del estudio histológico del tumor primario, que junto con diversas características clínicas ayudan a explicar las diferencias pronósticas que tienen los pacientes con idéntica estadificación. Por tanto, es recomendable reflejar en los informes dermatopatológicos la mayor cantidad posible de información en relación con estos factores pronósticos, ya que en el futuro pudieran ser de ayuda en el manejo y seguimiento de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.