La biopsia del ganglio centinela (BGC) en el manejo del paciente oncológico fue introducida hace casi 20 años y actualmente es ya considerada, en la mayoría de los centros hospitalarios, como una herramienta de diagnóstico de rutina para los pacientes con melanoma maligno (MM) localizado. Sin embargo la técnica es compleja, con numerosos detalles a conocer y a evaluar, ya que de ellos depende su fiabilidad diagnóstica y pronóstica. Además, en la última década, y gracias a la aplicación de técnicas inmunohistoquímicas y moleculares, la información que podemos obtener del estudio del ganglio centinela es cada vez más amplia, ofreciendo un interesante campo para la investigación de la patogenia del cáncer. Esta revisión tiene como objetivo ofrecer al lector un detallado análisis de aquellos factores y series publicadas más importantes a tener en cuenta hoy en día para la correcta indicación, realización e interpretación de los resultados de la BGC en los pacientes con MM
Sentinel lymph node biopsy was introduced into the management of cancer patients 20 years ago. Most hospitals now currently use the technique as a routine diagnostic tool in patients with localized malignant melanoma. However, the technique is complex and numerous details need to be determined and assessed to provide reliable diagnostic and prognostic information. In addition, the introduction of immunohistochemical and molecular techniques in the last decade has extended the information provided by the study of sentinel lymph nodes and created valuable opportunities for investigating the pathogenesis of this type of cancer. The aim of this review is to offer the reader a detailed analysis of the most important studies in the literature and the factors that should currently be considered in determining the indication for sentinel lymph node biopsy, performing the procedure correctly, and interpreting the findings in patients with malignant melanoma.
El comportamiento biológico del melanoma maligno (MM) está determinado por la interacción de una serie de factores que marcarán el pronóstico del paciente y, en consecuencia, su manejo terapéutico. El conocimiento e identificación de dichos factores ha centrado y centra gran parte de las investigaciones desarrolladas en torno a este complejo tumor. Sin embargo, en la actualidad, y a pesar de los grandes esfuerzos realizados para identificar factores pronósticos independientes para el MM, no existe aún ningún marcador molecular, cromosómico, inmunohistoquímico o histopatológico en el tumor primario que pueda predecir de forma precisa cómo va a comportarse el tumor1.
Según la sexta clasificación de la American Joint Committee on Cancer (AJCC) (tabla 1), el pronóstico para un paciente diagnosticado de MM dependerá principalmente de dos factores: el espesor del tumor primario, medido a través del grosor micrométrico de Breslow2, y la presencia o ausencia de metástasis en los ganglios linfáticos regionales. De forma indiscutible, la aceptación de la biopsia del ganglio centinela (BGC) como el procedimiento diagnóstico más preciso para determinar el estado histológico de los ganglios linfáticos regionales por parte del sistema de estadificación actual supuso un antes y un después en el manejo del paciente con MM. Como consecuencia de ello, el estado patológico del ganglio centinela (GC) se convirtió en el factor pronóstico independiente más importante en términos de supervivencia global (SG) y ha sido ampliamente utilizado para estandarizar criterios y resultados entre los distintos grupos de trabajo3.
Clasificación AJCC (American Joint Committee on Cancer) 2002 y supervivencias a los 5 y 10 años
| Estadiaje clínico | Estadiaje anatomopatológico | Supervivencia a los 5 años | Supervivencia a los 10años | ||||||
| T | N | M | T | N | M | ||||
| 0 | Tis | N0 | M0 | 0 | Tis | N0 | M0 | 99 | 95 |
| IA | T1a | N0 | M0 | IA | T1a | N0 | M0 | 95 | 90 |
| IB | T1b | N0 | M0 | IB | T1b | N0 | M0 | 91 | 85 |
| T2a | N0 | M0 | T2a | N0 | M0 | 89 | 80 | ||
| IIA | T2b | N0 | M0 | IIA | T2b | N0 | M0 | 77 | 65 |
| T3a | N0 | M0 | T3a | N0 | M0 | 79 | 65 | ||
| IIB | T3b | N0 | M0 | IIB | T3b | N0 | M0 | 63 | 50 |
| T4a | N0 | M0 | T4a | N0 | M0 | 67 | 55 | ||
| IIC | T4b | N0 | M0 | IIC | T4b | N0 | M0 | 45 | 35 |
| III | Tx | Nx | N0 | IIIA | T1-4a | N1a | M0 | 67 | 60* |
| T1-4a | N2a | M0 | 67 | ||||||
| IIIB | T1-4b | N1a | M0 | 52 | 40* | ||||
| T14b | N2a | M0 | 52 | ||||||
| T1-4a | N1b | M0 | 54 | ||||||
| T1-4a | N2b | M0 | 54 | ||||||
| T1-4a | N2c | M0 | 54 | ||||||
| T1-4b | N2c | M0 | 52 | ||||||
| IIIC | T1-4b | N1b | M0 | 24 | 20* | ||||
| T1-4b | N2b | M0 | 24 | ||||||
| Tx | N3 | M0 | 28 | ||||||
| IV | Tx | Nx | Mx | Tx | Nx | Mx | 10* | 5* | |
M: metástasis; N: node (ganglio); T: tumor.
Modificada de Balch et al3.
Sin embargo, en los últimos años han ido apareciendo críticas al actual sistema de clasificación propuesto por la AJCC debido a su complejidad y a que el pronóstico y el estadio no siempre están directamente correlacionados. Por ejemplo, la introducción de la BGC ha motivado que algunos pacientes, antes considerados como un estadio II (enfermedad localizada), pasaran a estar incluidos en un estadio IIIA, con lo que el pronóstico para los pacientes en el estadio III abarca un amplio espectro con una supervivencia libre de enfermedad (SLE) a los 5 años que varía del 13 al 69 %, con lo que se hace difícil aceptar que sea un grupo homogéneo que debiera ser tratado por igual4-7.
Por otro lado, según la actual clasificación, un paciente en el estadio IIC tiene peor pronóstico que otro situado en el estadio IIIA o IIIB, y el pronóstico para los pacientes con estadio IIB es equivalente al estadio IIIA. Lógicamente cabría esperar que un paciente N0 (sin enfermedad regional, estadios I y II de la clasificación) tuviera un pronóstico más favorable que un paciente N1 o N2 (estadio III). Todo esto hace pensar que deben existir otros factores pronósticos que nos ayuden a clasificar mejor a los pacientes tanto dentro de los N0 como de los N1. Entre estos otros factores, algunos ya han demostrado tener potencial pronóstico en diversas series independientes, por lo que se deberán tener en cuenta para futuras modificaciones de la clasificación actual como son el índice mitótico8,9, la expresión de ciertos marcadores en el tumor primario1,10 o en la sangre1 o factores tan conocidos como la edad o el sexo de los pacientes11. Otros están en vías de investigación, como son la aplicación de la tecnología de los «microarrays» en el tumor primario o el estudio molecular del GC, uno de los objetivos a revisar en el presente trabajo12,13.
La técnica de la biopsia del ganglio centinela en el melanomaHistoria y evoluciónEl concepto de que una determinada área del cuerpo drena de forma directa hacia un ganglio linfático antes de pasar a otros ganglios fue introducido por Virchow a mediados del siglo XIX. Sin embargo fue Braithwaite quien, en 1923, acuñó por primera vez el término de «centinela» para referirse a estos ganglios que recibían el drenaje linfático directo5. La aplicación de este concepto en el campo de la oncología quirúrgica se inició en 1960 de la mano de Gould y Cabanas, quienes publicaron sus trabajos sobre el drenaje del carcinoma de parótida y pene, respectivamente, aunque sin realizar un estudio linfográfico para identificar exactamente cuál era el GC en cada paciente14,15. Pero, sin lugar a dudas, la publicación de Morton et al del John Wayne Cancer Institute en 1992 fue la que supuso un antes y un después en el reconocimiento del uso potencial de la BGC en el mundo de la cirugía oncológica16.
Morton et al primero demostraron la viabilidad del mapeo linfático para la identificación del GC en un modelo felino para luego validar los resultados en una serie de pacientes con MM16. En dicha publicación, los autores describieron una nueva técnica que permitía la identificación intraoperatoria del GC en pacientes con MM usando exclusivamente la tinta azul como marcador, y definieron el GC como aquel ganglio más cercano al lugar del MM primario de la piel del que recibía drenaje linfático directo. Demostraron a su vez que el GC era el ganglio que albergaba las metástasis con mayor probabilidad y que la exéresis y el estudio intraoperatorio del GC permitía identificar correctamente estas metástasis. De esta forma seleccionaban a aquellos pacientes (los que presentaban metástasis en el GC) a los que se les debía realizar una linfadenectomía completa. Siguiendo esta técnica, los autores identificaron con éxito el GC en 194 de 237 territorios de drenaje linfáticos (81,8 %) y detectaron metástasis en 40 de ellos (20,6 %)16.
Posteriormente al trabajo de Morton, la hipótesis de que el estado histológico del GC, estudiado mediante la técnica de la BGC, refleja el estado del resto de los ganglios del mismo territorio ganglionar fue confirmada por múltiples estudios, entre los que destacan los de Reintgen en estados Unidos y Thompson en Australia17,18. Para validar dicha hipótesis, estos estudios incluyeron la práctica de la BGC junto con una linfadenectomía completa inmediata en todos los casos, de manera que todos los ganglios del territorio se examinaban. Las diferentes series de enfermos así analizados mostraron unos resultados que coincidían con el trabajo de Morton, identificando alrededor de un 20 % de pacientes con metástasis ocultas (GC positivo). La gran mayoría de ellas se encontraban limitadas en los ganglios identificados como GC, estableciendo una tasa de fallos de la técnica (GC negativo para metástasis pero alguno de los ganglios no-centinela positivos) del 1-2 %17-19.
A partir de dichos estudios, la técnica de la BGC se ha ido perfeccionando y estandarizando, y en la actualidad se usa de forma rutinaria para la estadificación del MM y el cáncer de mama, y es cada vez más utilizada en otros tumores sólidos como el cáncer de pulmón, el cáncer de cabeza y cuello, el carcinoma de colon, el cáncer de esófago y otros tumores de piel como el carcinoma escamoso o el tumor de células de Merkel20-23. En todos estos tumores está mayoritariamente aceptado hoy en día que el factor pronóstico más importante es la presencia o ausencia de metástasis en los ganglios linfáticos regionales y que la técnica de la BGC es la mejor herramienta para dicha estadificación ganglionar, permitiendo la realización de una linfadenectomía selectiva, es decir, reservada sólo a aquellos pacientes que muestran el GC positivo para metástasis3.
Controversia actual en torno a la biopsia del ganglio centinela: de la linfadenectomía electiva a la selectivaDesde la publicación del estudio de Morton, y principalmente en los últimos años, ha ido apareciendo un grupo de autores que se muestran contrarios a la implantación de la BGC como técnica estándar en el manejo del paciente con MM localizado24-26. El principal argumento en contra de la utilización rutinaria de dicha técnica es que la linfadenectomía electiva o profiláctica (LE) –ofrecida a todos los pacientes con MM localizadono– ha demostrado un aumento de la supervivencia frente a la linfadenectomía terapéutica o diferida (LT) –reservada sólo para aquellos pacientes con metástasis ganglionares clínicamente palpables– en los diversos estudios diseñados con tal fin. Por tanto, es de esperar que la BGC y la linfadenectomía selectiva posterior (LS) también carezcan de efectos beneficiosos para el paciente.
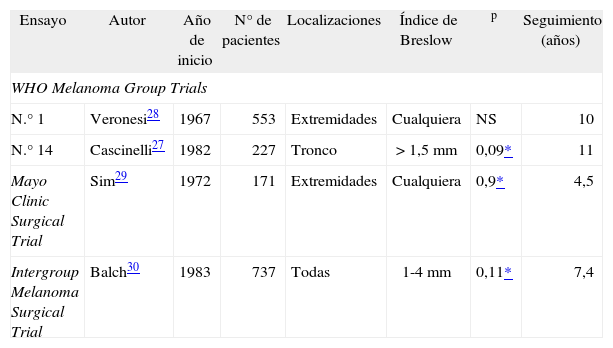
En la tabla 2 se resumen dichos estudios, dos de la Organización Mundial de la Salud, otro de la Clínica Mayo y otro del Intergroup Melanoma Surgical Trial, así como un metaanálisis de los 4, que de forma global demuestra la falta de beneficio de la LE27-30. Sin embargo, con un análisis más detallado de los mismos, se concluye que existen ciertos subgrupos de pacientes que sí se beneficiarían en cierto modo de la LE.
Estudios aleatorizados sobre linfadenectomía electiva y linfadenectomía terapéutica publicados hasta la fecha
| Ensayo | Autor | Año de inicio | N° de pacientes | Localizaciones | Índice de Breslow | p | Seguimiento (años) |
| WHO Melanoma Group Trials | |||||||
| N.° 1 | Veronesi28 | 1967 | 553 | Extremidades | Cualquiera | NS | 10 |
| N.° 14 | Cascinelli27 | 1982 | 227 | Tronco | > 1,5mm | 0,09* | 11 |
| Mayo Clinic Surgical Trial | Sim29 | 1972 | 171 | Extremidades | Cualquiera | 0,9* | 4,5 |
| Intergroup Melanoma Surgical Trial | Balch30 | 1983 | 737 | Todas | 1-4mm | 0,11* | 7,4 |
Fuentes: citas 27-30.
A pesar de ello, los defensores de la utilidad de la BGC argumentan que las conclusiones de estos estudios en torno al beneficio de la LE no pueden aplicarse a la BGC, ya que la LE y la LS no son del todo comparables. Por un lado la LE, sin la práctica de una linfogammagrafía preoperatoria previa, es un procedimiento ciego que en algunos casos extirpa y analiza ganglios que no reciben el drenaje del tumor primario. Se ha demostrado que alrededor de un tercio de los MM (sobre todo los localizados en cabeza y cuello o tronco) drenan en territorios no esperados o muestran un drenaje en ganglios en tránsito o aberrantes que sin la linfogammagrafía son imposibles de localizar31. Además, la BGC ofrece al patólogo la posibilidad de concentrarse en un número limitado de ganglios, con lo que es posible un análisis mucho más detallado de los mismos. Por otro lado, la morbilidad asociada a la LE es considerable y no puede comprarse a la de la BGC.
Pero el argumento más claramente a favor de la utilidad de la BGC para los pacientes con MM proviene precisamente de sus creadores, quienes diseñaron el estudio Multicenter Selective Lymphadenectomy Trial-I (MSLT-I) con el objetivo principal de averiguar si la BGC ofrece algún beneficio en cuanto a la supervivencia final para los pacientes con MM localizado con un Breslow ≥ 1mm y/o un nivel de Clark ≥ IV. En la tabla 3 se resumen los resultados por objetivos del primer análisis de dicho estudio, publicados recientemente32. Se comparó la supervivencia entre dos grupos aleatorizados de pacientes: BGC más la linfadenectomía inmediata cuando el GC es positivo u observación más LT, en el momento que existen ganglios clínicamente palpables. En total participaron 18 centros de Europa, Estados Unidos y Australia, incluyendo un total de 2.001 pacientes, de los cuales 1.973 fueron elegibles para el estudio. La respuesta a la pregunta del primer objetivo (tras una mediana de seguimiento de 59,5 meses) fue que ciertamente la BGC no mejora la supervivencia de los pacientes respecto a la observación (SG 87,1 % frente al 86 %, p = 0,4), aunque si sólo comparamos la supervivencia entre el grupo con GC positivo tras la BGC a los que se les realizó la linfadenectomía inmediata y los pacientes que sufrieron una recidiva en el ganglio y fueron entonces tratados con la LT, las diferencias sí fueron estadísticamente significativas (SG 69,8 % frente al 57,2 %, p = 0,01). Sin embargo este último análisis ha sido ampliamente criticado, ya que desde el punto de vista estadístico no está claro que las dos poblaciones sean del todo comparables.
Resultados y objetivos del Multicenter Selective Lymphadenectomy Trial-I
| Objetivo principal | p |
| La BGC y la LCI ¿incrementan la SG respecto a la LT? | No |
| Objetivos secundarios | |
| La BGC y la LS ¿incrementan la SLE respecto a la LT? | Síp=0,0065 |
| El estado patológico del GC ¿tiene significado pronóstico independiente? | Sí p= 0,0001 |
| La BGC y la LS ¿identifican aquellas metástasis Sí ocultas que desarrollarían una metástasis 19,8 % frente palpable en el grupo de observación? al 20,3% | Si19,8 % frente al 20,3% |
| Para pacientes con GC+, ¿prolonga la LS la SG respecto a los pacientes con metástasis clínicamente palpables a los que se les realiza una LT? | Síp=0,0034 |
BGC: biopsia del ganglio centinela; GC: ganglio centinela; LCI: linfadenectomía completa inmediata; LS: linfadenectomía selectiva; LT: linfadenectomía terapéutica; SG: supervivencia global; SLE: supervivencia libre de enfermedad.
Modificada de Morton DL et al32.
Lo que queda fuera de duda tras este estudio multicéntrico es el valor predictivo del estado histológico del GC en cuanto a que mejoró la SLE para el grupo tratado con la LS tras la BGC (SLE a los 5 años del 78,5 % frente al 73 %, log rank p = 0,006) y a que el estado patológico del GC fueel factor pronóstico independiente más importante (riesgo relativo = 2,66, intervalo de confianza del 95 % = 1,90-3,72). Además, otra de las interpretaciones de estos resultados sugerida por Morton fue que la BGC identifica correctamente a aquellos pacientes con metástasis ocultas que, si se hubieran dejado en el grupo de observación, hubiesen desarrollado metástasis ganglionares clínicamente palpables. Esta afirmación se basa en la observación de que, por una parte, el porcentaje de pacientes con GC positivo tras la BGC y el porcentaje de pacientes que desarrollaban metástasis ganglionares en el grupo de observación eran muy similares (19,8 frente al 20,3), y por otra parte, que la media de ganglios positivos por paciente se incrementaba desde 1,6 tras la BGC hasta 3,4 tras la LT del grupo observación.
Tras estos detallados resultados del MSLT-I, la mayoría de los autores y centros especializados en el manejo de los pacientes con MM defienden que, actualmente, es apropiado realizar la técnica de la BGC a aquellos pacientes con MM que cumplan los criterios para su indicación, informando siempre al paciente de los potenciales riesgos y beneficios de la técnica y de cómo influirá en su manejo la información que nos dé la prueba.
Además, debemos recordar que la BGC se aplica, hasta la fecha, con intención diagnóstica y no terapéutica. Por tanto, su aparente falta de beneficio en términos de SG estaría más relacionada con las limitadas opciones terapéuticas de que disponemos actualmente y que hacen que el diagnóstico en fases más o menos precoces de la enfermedad no se traduzca siempre en tratamientos más eficaces.
En cualquier caso, para que la técnica de la BGC sea realizada con éxito requiere de la interacción de un equipo multidisciplinario con experiencia que incluya a un dermatólogo/oncólogo habituado en la indicación o no de la prueba, un cirujano, un radiólogo de medicina nuclear y un patólogo. Cada uno de los miembros del equipo intervendrá en uno de los cinco pasos de la técnica que analizaremos a continuación: selección de los pacientes, mapeo linfático prequirúrgico, detección intraoperatoria y exéresis del GC, examen microscópico y, en ocasiones, molecular del GC y linfadenectomía radical precoz en aquellos pacientes con ganglio positivo.
Criterios para seleccionar a los pacientes tributarios de la biopsia del ganglio centinelaComo en toda intervención diagnóstica o terapéutica, es importante seleccionar a los pacientes adecuadamente para optimizar los resultados de la misma. Los criterios recomendados para seleccionar a los pacientes con MM tributarios de la BGC se encuentran en constante revisión debido, sobre todo, a que la propia estadificación del melanoma es también un proceso en evolución. En general, la BGC debería recomendarse para todo aquel paciente con MM primario sin evidencia de metástasis regionales ni a distancia en el que el riesgo de metástasis ganglionares estimado fuera del 10 % o superior (estadios clínicos IB y II[A,B,C]) de la sexta clasificación de la AJCC)33. El riesgo de positividad del GC se correlaciona con una serie de factores conocidos del tumor primario como son el grosor (medido a través del índice de Breslow y el nivel de Clark) y la presencia o ausencia de ulceración. Basándonos en estos factores y en la actual clasificación pronóstica para el MM de la AJCC3, la BGC parece estar plenamente justificada y aceptada en aquellos pacientes con un MM primario localizado con un grosor micrométrico de Breslow superior a 1mm, o aquellos casos que, de forma independiente de cual sea su grosor, presentan un nivel de Clark IV-V y/o ulceración.
No está tan aceptada, por el momento, la indicación de la BGC en tumores con un grosor de Breslow inferior a 1mm sobre la base de otros marcadores de agresividad del tumor primario como un índice de Breslow entre 0,75 y 1mm, la presencia de regresión, un elevado índice mitótico, la fase de crecimiento vertical o la expresión de ciertos genes1,5. Estos otros posibles criterios no se encuentran recogidos en la clasificación de la AJCC y/o son difíciles de estandarizar, en especial la presencia de regresión. En este último punto, los trabajos publicados al respecto son contradictorios5,33-35. Algunos autores han demostrado que los tumores delgados con regresión completa (signos de regresión en una zona del tumor en la que no se identifican células de melanoma) que afecte a más de un 50 % de la extensión del MM invasivo se correlacionan con un curso más agresivo y, por tanto, la BGC podría estar indicada en estos casos35.
Por otro lado, antes de indicar la prueba deberemos descartar una serie de factores que pueden haber alterado el drenaje linfático de la zona y provocar que el GC identificado no sea el verdadero: tumor primario extirpado con márgenes amplios (> 1cm), reconstrucción mediante injertos o colgajos, aquellos tumores con cirugía previa o radioterapia sobre el territorio ganglionar a explorar y aquellos con infección aguda de la herida quirúrgica de la exéresis simple del tumor. Otro factor a tener en cuenta puede ser la localización del tumor primario, pues hay ciertas localizaciones como la cabeza y el cuello en las que resulta especialmente complicada la exploración del GC, ya sea por la dificultad en localizar la actividad focal radiactiva cuando el MM drena a la glándula parótida o la dificultad de extirpar un GC intraparotídeo con el riesgo de dañar estructuras vitales como el nervio facial31. Además, en todos los casos se deberán valorar también las condiciones generales del paciente, su edad, su calidad de vida y el riesgo quirúrgico asociado5,12.
Por último, algunos autores defienden también el uso de la técnica de la BGC en el manejo de algunas lesiones melanocíticas de comportamiento incierto como son los tumores de Spitz atípicos36.
Mapeo linfático y detección intraoperatoria del ganglio centinelaAunque en los estudios iniciales se utilizaba sólo la tinta azul para identificar el trayecto aferente directo hasta el territorio ganglionar regional, pronto se observó que el mapeo preoperatorio era más preciso cuando la tinta azul se combinaba con la linfogammagrafía preoperatoria y con el uso intraoperatorio de una sonda detectora de rayos gamma37. Además, la existencia de múltiples GC por territorio ganglionar, de GC aberrantes (fuera de los territorios linfáticos convencionales) o de CG en tránsito (en territorios intermedios como, por ejemplo, de localización poplítea o cubital) tampoco se conocía con precisión hasta la implantación de la linfogammagrafía5,12,19,31.
Con la combinación de la inyección preoperatoria de un coloide marcado con tecnecio-99m (99mTc) y la inyección intraoperatoria de colorante azul, la mayoría de los autores reportan unas tasas de identificación del GC excelentes (en torno al 98-100 %), lo que significaría que, en prácticamente todos los pacientes, se ha identificado como mínimo un GC. Pero esto no garantiza que todos los GC de aquel paciente en concreto se hayan extraído. No está muy claro cuántos ganglios deberían considerarse como verdaderos centinelas, pero parece que el número es mayor de lo que se pensaba inicialmente. Además, no existe aún un acuerdo unánime respecto a la definición exacta de GC en base a su radiactividad. Con la experiencia acumulada se sabe que el GC no es necesariamente el ganglio más cercano al tumor (como inicialmente describió Morton16), ni tampoco el que primero aparece en la imagen de la linfogammagrafía precoz. No todos los ganglios que muestran radiactividad son centinelas ni tampoco todos los ganglios centinelas son radiactivos. A su vez, no todos los ganglios «azules» (teñidos con la tinta azul tras su inyección) son centinelas ni todos los centinelas son «azules». Lo más aceptado es considerar como GC a todo ganglio que in vivo muestra un número de cuentas al menos dos veces superior al fondo del campo quirúrgico y ex-vivo al menos 10 veces superior al fondo12. El grupo del Sunbelt Melanoma Trial ha definido «la regla del 10 %» que propugna considerar como centinela a cualquier ganglio azul y a aquellos que muestren una radiactividad ex vivo superior al 10% de la radiactividad del ganglio que más capte38. Con esta definición se minimiza la posibilidad de olvidarse algún GC y no se incrementa de forma exagerada el número de ganglios que se extraen. Además, es el mismo criterio utilizado para las BGC en el caso del cáncer de mama.
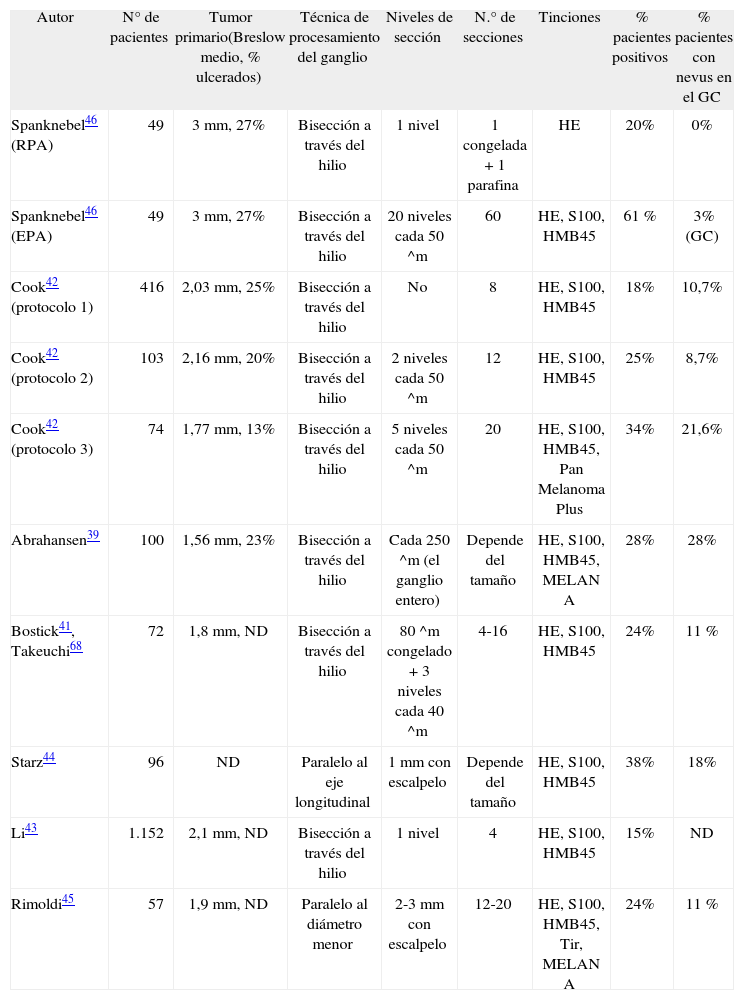
Evaluación anatomopatológica del ganglio centinelaLas técnicas de muestreo y la introducción de la inmunohistoquímicaCon la introducción de la BGC se abrió un escenario perfecto para un diagnóstico rápido y preciso del estado anatomopatológico del territorio ganglionar. Sin embargo, las recomendaciones actuales para el análisis histopatológico del GC distan bastante de ser rápidas y fácilmente estandarizables. Debido a que el estudio histológico completo de todo el ganglio es imposible, cada grupo de estudio ha diseñado su propio protocolo. En la tabla 4 aparecen algunos de los protocolos más usados para el muestreo y el análisis histopatológico posterior. Los diferentes protocolos propuestos comparten algunos aspectos, pero en otros divergen de forma significativa39-46.
Protocolos de muestreo y tinciones de hematoxilina-eosina e inmunohistoquímica más usados
| Autor | N° de pacientes | Tumor primario(Breslow medio, % ulcerados) | Técnica de procesamiento del ganglio | Niveles de sección | N.° de secciones | Tinciones | % pacientes positivos | % pacientes con nevus en el GC |
| Spanknebel46 (RPA) | 49 | 3mm, 27% | Bisección a través del hilio | 1 nivel | 1 congelada + 1 parafina | HE | 20% | 0% |
| Spanknebel46 (EPA) | 49 | 3mm, 27% | Bisección a través del hilio | 20 niveles cada 50 ^m | 60 | HE, S100, HMB45 | 61 % | 3% (GC) |
| Cook42 (protocolo 1) | 416 | 2,03mm, 25% | Bisección a través del hilio | No | 8 | HE, S100, HMB45 | 18% | 10,7% |
| Cook42 (protocolo 2) | 103 | 2,16mm, 20% | Bisección a través del hilio | 2 niveles cada 50 ^m | 12 | HE, S100, HMB45 | 25% | 8,7% |
| Cook42 (protocolo 3) | 74 | 1,77mm, 13% | Bisección a través del hilio | 5 niveles cada 50 ^m | 20 | HE, S100, HMB45, Pan Melanoma Plus | 34% | 21,6% |
| Abrahansen39 | 100 | 1,56mm, 23% | Bisección a través del hilio | Cada 250 ^m (el ganglio entero) | Depende del tamaño | HE, S100, HMB45, MELAN A | 28% | 28% |
| Bostick41, Takeuchi68 | 72 | 1,8mm, ND | Bisección a través del hilio | 80 ^m congelado + 3 niveles cada 40 ^m | 4-16 | HE, S100, HMB45 | 24% | 11 % |
| Starz44 | 96 | ND | Paralelo al eje longitudinal | 1mm con escalpelo | Depende del tamaño | HE, S100, HMB45 | 38% | 18% |
| Li43 | 1.152 | 2,1mm, ND | Bisección a través del hilio | 1 nivel | 4 | HE, S100, HMB45 | 15% | ND |
| Rimoldi45 | 57 | 1,9mm, ND | Paralelo al diámetro menor | 2-3mm con escalpelo | 12-20 | HE, S100, HMB45, Tir, MELAN A | 24% | 11 % |
EPA: análisis patológico exhaustivo; GC: ganglio centinela; HE: hematoxilina-eosina; ND: no disponible; RPA: análisis patológico de rutina; Tir: tirosinasa.
Por ejemplo, la mayoría de los grupos están de acuerdo en la baja precisión del estudio intraoperatorio del material congelado, ya que así ha sido demostrado en múltiples ocasiones con una sensibilidad para la detección de metástasis de tan solo un 47 %47. En cambio, los distintos protocolos no están tan de acuerdo en cómo de exhaustivo debe ser el análisis anatomopatológico del GC. De acuerdo con la hipótesis de Cochran48 los melanomas típicamente metastatizan en el espacio subcapsular a lo largo del plano central del ganglio. Por ello, estos autores propugnan realizar no más de 10 cortes cada 2-4 micras de cada cara central de un ganglio seccionado por su mitad longitudinal. Sin embargo, ha sido ampliamente demostrado que cuanto más se profundiza en el nivel de corte existe una mayor probabilidad de encontrar una metástasis. Por esta razón otros autores son partidarios de realizar cortes alternos, cortando el ganglio cada 1-2mm, y entonces estudiar un número variable de secciones (entre 3 y 20) de cada corte40,42,44.
En cuanto a la técnica de tinción utilizada, de forma general se acepta que la tinción con hematoxilina-eosina (HE) convencional permite la detección de una célula de MM entre 104-105 células, mientras que con la tinción inmunohistoquímica (IHQ) se consigue detectar una célula de melanoma entre 105-106 células. Por esta razón, la mayoría de los autores recomiendan usar tinciones adicionales de IHQ en las secciones contiguas a la analizada con HE, si no se observan células metastásicas tras el estudio con HE47. Además, la IHQ puede ayudar a diferenciar entre células de melanoma y otras células benignas presentes en el ganglio. La mayoría de los estudios de IHQ usan el anticuerpo de la proteína S100 citoplasmática (anti-S100 policlonal), altamente sensible para la detección de células de melanoma, aunque poco específico. Por ello se recomienda siempre completar el estudio IHQ del GC con inmunomarcadores más específicos de célula melanocítica como el marcador molecular HMB45 (HMB45 monoclonal), anticuerpo dirigido contra la proteína Pmel 17/gp100, expresada en los melanosomas inmaduros. Otros autores prefieren el anticuerpo dirigido contra la proteína MELAN-A, otra proteína hallada en los melanosomas inmaduros, ya que es más sensible e igual de específico que el marcador HMB45. En el mercado también existen cocktails de anticuerpos melanocíticos (los denominados «panmelanomas» que permiten la detección de HMB45, MART1 y tirosinasa, entre otros, en una sola reacción)1.
Con la combinación del estudio de multisecciones y el uso de HE e IHQ en cada corte, la precisión del estudio anatomopatológico se incrementa hasta un 15 % con respecto al estudio únicamente con HE de las caras centrales de cada mitad del ganglio, pero el problema es que es muy laborioso y poco práctico por su elevado coste42,46.
Diagnóstico diferencial ante la sospecha de células de melanoma en el ganglio centinelaEn el ganglio linfático existen a menudo grupos celulares que pueden ser difíciles de diferenciar de las células metastásicas de melanoma. Por ejemplo, no es infrecuente observar en el ganglio linfático células dendríticas paracorticales, macrófagos, células de Schwann de los nervios intraganglionares y paraganglionares o células ganglionares, todas ellas S100 positivas, que pueden ser erróneamente diagnosticadas como células de melanoma cuando no lo son47. También la presencia de pigmento que provenga de un tatuaje o de antracita puede resultar engañosa, sobre todo en el estudio macroscópico de la pieza49.
Pero existe una dificultad añadida en el estudio de las metástasis de melanoma en el ganglio: la observación de la presencia de células melanocíticas benignas (no-melanoma) en los ganglios linfáticos. La incidencia real de nevus intraganglionares, como así se ha denominado a los agrupamientos de estas células, es desconocida y las tasas que aparecen en la literatura son muy variables, encontrándose cifras tan dispares como que entre el 1 y el 30 % de los pacientes con MM presentan nevus en alguno de sus ganglios44,50-52. También en los territorios de drenaje de otros tumores malignos, como el cáncer de mama, o en lesiones benignas, como son los nevus azules, se ha descrito la presencia de células névicas en los ganglios, aunque la incidencia es notablemente menor50,51. Es interesante la observación de que las células névicas hayan sido descritas exclusivamente en los ganglios localizados en territorios de drenaje de la piel y no en otros ganglios localizados más en profundidad como son los intraabdominales50.
Existen dos teorías que intentan explicar el fenómeno de los nevus intraganglionares: una migración embriológica aberrante de los melanocitos (teoría embriológica) y una transferencia de células por embolismo a través de los vasos linfáticos desde un nevus cutáneo hasta el correspondiente ganglio linfático (teoría de las metástasis benignas). Dos factores apoyan esta última teoría: el hecho de que las células de nevus son más frecuentes en los GC que en los ganglios no centinelas y que son más frecuentes en ganglios de melanomas asociados a nevus que en melanomas que aparecen de novo47.
Significado pronóstico de la presencia de células de melanoma en el ganglio centinela. La importancia de la carga metastásicaUna vez seguros de que lo que estamos viendo en el GC es una célula de melanoma, el paciente es sometido a una linfadenectomía completa. Sin embargo, como ya hemos comentado, no todos los pacientes con metástasis en el GC evolucionan por igual. Este hecho sugiere la posibilidad de que no todas las metástasis en el GC tengan implicación pronóstica para el paciente. Una vez más no existe aún un acuerdo unánime sobre qué tamaño mínimo o carga metastásica mínima en el GC debería ser considerada como una metástasis real con significado pronóstico para el paciente con melanoma. En otros tumores sólidos como el cáncer de mama sí que existe evidencia científica suficiente para diferenciar entre la presencia de células aisladas (depósitos menores de 0,2mm, muchas veces sólo vistos con IHQ), la presencia de micrometástasis (definidas como depósitos de células menores de 2mm) y la presencia de macrometástasis (depósitos mayores de 2mm). Sólo estas últimas, las macrometástasis, han demostrado tener un significado pronóstico para el paciente, y así lo recoge la clasificación TNM para el cáncer de mama, según la cual la linfadenectomía completa tan sólo está indicada en los casos de macrometástasis53.
En el MM existen algunos estudios que intentan medir el tamaño tumoral o la carga metastásica con el objetivo de correlacionarlo con la evolución clínica, aunque de momento dicho concepto no queda reflejado en la actual clasificación de la AJCC, excepto en la distinción entre macrometástasis (ganglio metastásico clínicamente palpable o con invasión extracapsular) y micrometástasis (todas aquellas observadas tras el estudio histológico) y en el número de ganglios afectados (mayor o menor de 3)3.
Hace algunos años, Startz et al44 propusieron una nueva clasificación, el estadio S, para estratificar la afectación ganglionar del GC basado en los parámetros n (el número de secciones de 1mm en las que se observan las células de melanoma) y d (la distancia máxima de las células tumorales desde la cápsula hasta el interior). Este método de estadificación se correlacionaba bien con otros factores pronósticos conocidos como el índice micrométrico de Breslow del tumor primario o el número de ganglios positivos para metástasis. Además, en el análisis multivariante de factores pronósticos, el estadio S3, definido como una d > 1mm podía ser considerado como el factor pronóstico negativo más importante. Siguiendo este estudio, Carlson et al54 publicaron otra serie de 104 GC positivos y los clasificaron según otro método: depósitos aislados de células en el espacio subcapsular o en la zona interfolicular, micrometástasis (consideradas como focos de células ≤ 2mm) y macrometástasis si eran > 2mm. Carlson encontró que sólo los pacientes con macrometástasis tenían una supervivencia significativamente peor que el resto.
Recientemente se han usado programas de análisis asistidos por ordenador para determinar el área relativa de la metástasis dentro del GC y predecir según ésta la existencia de otros ganglios positivos y la supervivencia55,56. Sin embargo, estos métodos no son factibles, por el momento, en el procedimiento diagnóstico habitual3,47.
Las técnicas moleculares en el estudio del ganglio centinela. Los marcadores más empleados: cuáles y cuántos hemos de utilizarLos métodos moleculares constituyen una alternativa al estudio anatomopatológico ya que tienen la capacidad de detectar cantidades muy pequeñas de moléculas de origen tumoral en diferentes tejidos, permitiendo a su vez ser analizados en su totalidad. Smith et al57 fueron los primeros en publicar el uso de la técnica de transcripción inversa y reacción en cadena de la polimerasa (RT-PCR) para la detección de células metastásicas en la sangre de los pacientes con MM. Poco después, Wang et al58 adaptaron dicha técnica para la detección de las células de melanoma en el tejido ganglionar y, desde entonces, numerosos grupos han publicado su experiencia en la detección molecular de células de melanoma en los ganglios centinelas41,43,59-69. Cabe destacar, sin embargo, que el uso de las técnicas moleculares permanece en investigación y no está aún reconocido como un método válido para la práctica diagnóstica habitual70. Uno de los principales problemas a tener en cuenta a la hora de interpretar los resultados de estos estudios es la variabilidad metodológica entre los distintos laboratorios, tanto en lo que se refiere a la cantidad y tipo de tejido utilizado (tejido incluido en parafina o en fresco), al método de amplificación (PCR simple, PCR anidada –nested PCR–o PCR cuantitativa en tiempo real) como a los marcadores usados. En conjunto los distintos marcadores moleculares más validados y usados para la detección de células de MM en los GC se pueden clasificar en dos grupos: proteínas relacionadas con la melanogénesis (MRP) y los antígenos cáncer testis (CTA).
Entre las MRP la mayoría de los grupos usan la tirosinasa, que es la enzima clave para la síntesis de la melanina. El gen MART-1 es también muy usado como marcador para las células de melanoma. Fue inicialmente descrito como el principal antígeno de melanoma reconocido por los linfocitos T71 y se ha implicado también en la síntesis de los melanosomas (regulación de Pmel 17), por lo que tanto las células de melanoma como los melanocitos benignos pueden expresarlo.
Entre los marcadores del grupo de los CTA, llamados así ya que sólo se ha encontrado expresión en los tumores y el tejido testicular y placentario, los más usados son los genes de los antígenos de melanoma (MAGE).
Recientemente, el grupo de Hoon ha publicado dos nuevos marcadores para la detección de células de melanoma en el GC: Gal Nac (Beta1–4–N–acetylgalactosaminyl–transferase) y Pax3 (paired-box homeotic gene transcription factor 3)68. Gal es una enzima implicada en la síntesis del gangliósido GM2/GD2 y se detecta en melanomas y neuroblastomas. Pax3 tiene un importante papel en la regulación de la síntesis de la melanina, pero también está implicado en otras vías como la migración o la antiapoptosis celular.
Relevancia clínica del estudio molecular del ganglio centinela. Estudios y series más importantesEn la literatura existen numerosos trabajos sobre la utilidad de los métodos moleculares para la detección de enfermedad oculta en los GC de pacientes con MM. Entre ellos hemos identificado los 13 estudios más importantes, con series independientes de pacientes, que buscan el posible significado pronóstico de dicha detección (tabla 5)41,43,59-69.
Principales series publicadas que evalúan la detección molecular de distintos marcadores en el ganglio centinela y su significado pronóstico
| Autor | N.° de pacientes | Seguimiento (meses) | % recidivas | Tipo de muestra | Método molecular | Marcadores | % PCR + | p = Histo –/PCR + frente a Histo – | |||||
| Total (período de inclusión) | Histo – | Histo + (%) | Histo + | Histo – | Histo + | Histo – | SLE | SG | |||||
| Takeuchi68 | 215 (1992-1996) | 162 | 53 (24%) | 60,4 | 60 | 24 | Parafina | qRT-PCR | MART1/PAX/GAL/MAGEA3 | 79/74/70/47 | 6/17/17/5 | < 0,0001 (≥ 2 frente a ≤ 1 marcador) | < 0,0001 (≥ 2 frente a ≤ 1 marcador) |
| Bostick41 | 72 (ND) | 55 | 17 (24%) | 12 | 29 | 5 | Congelado | Single PCR | Tir/MART1/MAGEA3 | 80/100/80 | 29/36/44 | < 0,02 (≥2 frente a ≤1 marcador) | ND |
| Kuo62 | 77 (ND) | 40 | 37 (48%) | 55 | 62 | 53 | Parafina | RT-PCR y ECL* | Tir/MART1/TRP-1/TRP-2 | 89/92/35/43 | 62/43/10/10 | < 0,09 (≥2 frente a ≤ 1 marcador) | |
| Kammula61 | 112 (1996-1997) | 97 | 15 (13%) | 67 | 53 | 14 | Congelado Bisección | Nested PCR | Tir | 100 | 52 | > 0,05 | > 0,05 |
| Ulrich69 | 322 (1998-2002) | 288 | 34 (10%) | 37 | 44 | 10 | Congelado Bisección | PCR | Tir | 100 | 14 | < 0,0001 | ND |
| Ribuffo64 | 134 (ND) | 119 | 15 (11 %) | 42 | 73 | 7,5 | Congelado Bisección | Nested PCR | Tir | 100 | 58 | 0,01 | ND |
| Goydos60 | 175 (ND) | 141 | 34 (19%) | 34 | 50 | 20,6 | Congelado Bisección | Nested PCR | Tir | 100 | 48 | 0,008 | 0,02 |
| Blaheta59 | 116 (1996-1998) | 101 | 15 (13%) | 19 | 67 | 12,8 | Congelado Bisección | Nested PCR | Tir | 100 | 35 | 0,01 | ND |
| Schivers67 | 114 (ND) | 91 | 17 (24%) | 28 | 61 | 8 | Congelado | Nested PCR | Tir | 100 | 52 | 0,02 | ND |
| Li43 | 233 (1995-1997) | 181 | 52 (22%) | 20 | 34 | 6,6 | Bisección | 94 | 63 | 0,06 | |||
| Giese66 | 139 (1999-2002) | 114 | 25 (18%) | 29 | 36 | 3,5 | Congelado Bisección | qRT-PCR | Tir/MART1 | 92 | 34 | 0,01 | ND |
| Mangas63 | 180 (1998-2003) | 142 | 38 (21 %) | 45 | 31 | 7 | Congelado Bisección Cortes alternos | Nested PCR | Tir | 92 | 60 | > 0,05 | > 0,05 |
| Scoggins65 | 1.446 (1997-2003) | 1.446 | ND | 30 | ND | 20 (aprox.) | Congelado Bisección Cortes alternos | PCR | Tir/MART1/MAGEA3/gp100 | ND | 43* | > 0,05 | > 0,05 |
Definido positivo como positivo para tirosinasa + positivo a cualquiera de los otros tres marcadores. ECL: electroquimioluminiscencia (con biotina marcada); Histo: tras el estudio anatomopatológico, en negrita: series independientes de enfermos; ND: no disponible; PCR: reacción en cadena de polimerasa; qRT-PCR: PCR en tiempo real cuantitativa; SG: supervivencia global; SLE: supervivencia libre de enfermedad; Tir: tirosinasa.
A pesar de que la mayoría de los trabajos encuentran un significado pronóstico en la detección de la tirosinasa mediante nested PCR, se trata de estudios con escaso tiempo de seguimiento (inferior a 3 años)41,43,59,60,67,69. Sin embargo, como apuntan Kammula et al61, y como demuestra también nuestra serie63, sería muy interesante observar qué pasaría en la mayoría de estos trabajos en torno al significado pronóstico de la detección molecular en el GC si el período de seguimiento fuera mayor. Tanto en el trabajo de Kammula como en el nuestro, el incremento del tiempo de seguimiento significó una pérdida de significación en referencia al riesgo de recidiva entre ambos grupos de pacientes (pacientes positivos y negativos para el estudio molecular). En este sentido, si comparamos el porcentaje de recidiva de los pacientes con GC negativo tras el estudio anatomopatológico entre las distintas series, observamos que a mayor tiempo de seguimiento mayor número de recidivas: el riesgo de recidiva en este grupo de pacientes aumenta desde alrededor de un 10 % tras tres años de seguimiento hasta un 25 % con 5 años de seguimiento. Como consecuencia, el éxito o fracaso en la búsqueda de significado pronóstico de la detección molecular en el GC puede también variar a lo largo del tiempo.
Lo que sorprende sin duda en todos estos estudios moleculares (incluyendo nuestra propia experiencia) con un solo marcador molecular, tirosinasa, es su exceso de sensibilidad con unas tasas de positividad entre los pacientes con GC negativo tras el estudio anatomopatológico que varían desde un 25 a un 31 %, lo que traduce un alto porcentaje de falsos positivos70. Ante estos resultados, varios grupos, entre los que figura también el nuestro (datos no publicados), optaron por el método de RT-PCR cuantitativa en tiempo real y la combinación de distintos marcadores, con lo que se consigue mejorar la especificidad respecto a la detección de la tirosinasa mediante nested PCR y, a su vez, ofrecer un método más objetivo y reproducible66,68.
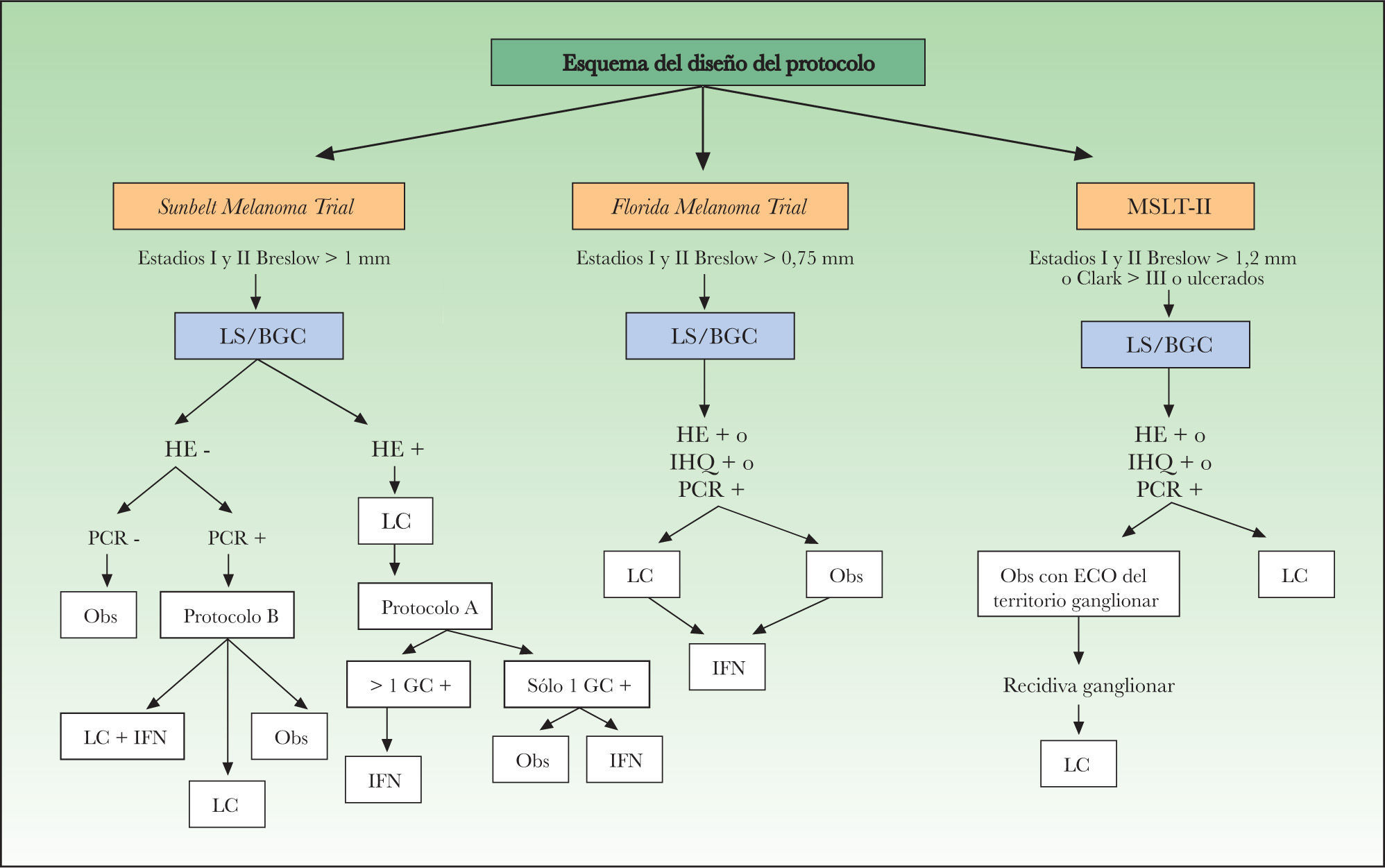
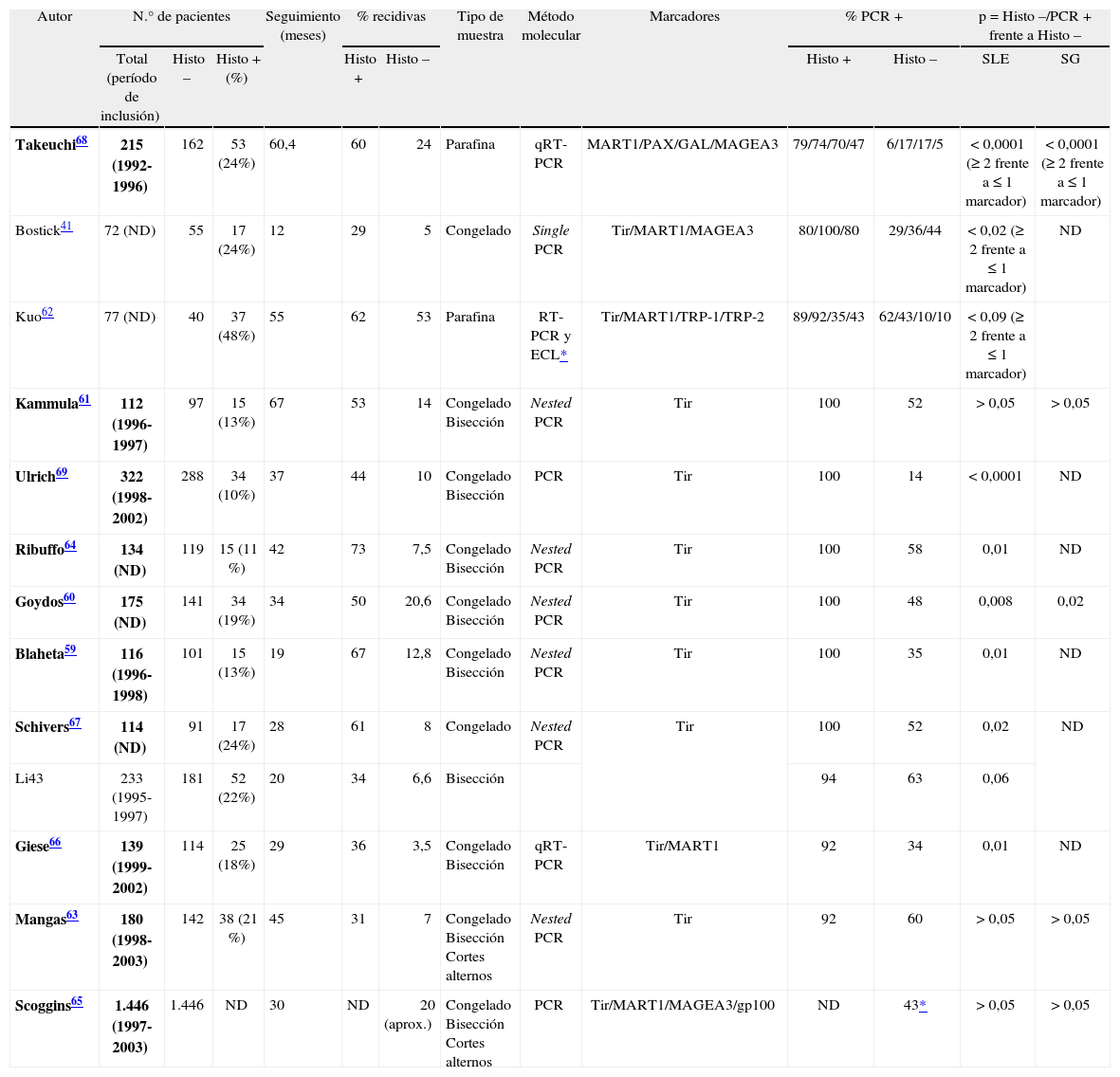
Como resultado de todos estos estudios moleculares, se han iniciado diferentes ensayos multicéntricos prospectivos en los que se investiga el posible valor pronóstico de la detección molecular. En la figura 1 se esquematiza el diseño de dichos estudios. El primero de ellos fue el Sunbelt Melanoma Trial, cuyo objetivo central era averiguar si el tratamiento con interferón (IFN) alfa 2b junto con la linfadenectomía es más efectivo que la linfadenectomía sola para prolongar la SLE y la SG de los pacientes con GC positivo. Entre los objetivos secundarios, el estudio Sunbelt fue el pionero en incluir el resultado molecular como criterio para decidir el tratamiento a aplicar, ya que a los pacientes con GC positivos tras el estudio molecular se les aleatorizaba en dos grupos: observación o linfadenectomía. El período de inclusión de los pacientes finalizó en el año 2004 y reciente mente se han publicado los resultados del estudio molecular65. Se incluyeron un total de 1.446 pacientes con el GC negativo tras el estudio histológico, de los cuales 620 pacientes (42,8 %) fueron positivos para el marcador tirosinasa y uno o varios de los otros tres (MART1, MAGEA3 o gp100). Además, también se analizó la sangre periférica de 820 pacientes, con el mismo método molecular. Tras una mediana de seguimiento de 30 meses el citado análisis molecular de los GC no consiguió detectar a aquellos pacientes con mayor riesgo de recidiva. El estudio de la sangre periférica sí mostró una diferencia significativa, aunque sólo respecto al período libre de enfermedad, siendo peor para los pacientes positivos a dos o más marcadores (p = 0,006).
Esquema del diseño de los estudios multicéntricos en marcha sobre la detección molecular en el ganglio centinela en pacientes con melanoma. BGC: biopsia del ganglio centinela; ECO: ecografía; GC: ganglio centinela; HE: hematoxilina-eosina; IFN: interferón; IHQ: inmunohistoquímica; LC: linfadenectomía completa; LS: linfadenectomía selectiva; MSLT-II: Multicenter Selective Lymphadenectomy Trial; Obs: observación; PCR: reacción en cadena de polimerasa.
Siguiendo el estudio Sunbelt se iniciaron otros dos estudios multicéntricos con un diseño similar. El FMT (Florida Melanoma Trial) que engloba a 10 instituciones cubriendo a 3.200 pacientes con MM reclutados desde el año 1992 al año 2002. A diferencia del Sunbelt, en el FMT a los pacientes con GC positivo tras el estudio histológico y/o tras el estudio molecular con nested PCR para tirosinasa se les aleatoriza en dos brazos: linfadenectomía junto con IFN o IFN sólo72.
Por último, la segunda parte del Multicenter Selective Lymphadenectomy Trial (MSLT-II), todavía con un período de inclusión abierto, recoge pacientes de los mayores centros de referencia de Estados Unidos, Australia y Europa para determinar, por una parte, el posible efecto terapéutico de la BGC per se y, por otra, evaluar entre los pacientes con GC negativo el uso de las técnicas moleculares como criterio para aleatorizar a los pacientes en dos brazos: observación o linfadenectomía19.
Limitaciones de la biopsia del ganglio centinela: falsos negativos y positivos que ofrece el estudio histopatológico y molecular del ganglio centinelaComo hemos podido ir descubriendo a lo largo de esta revisión, el potencial predictivo de la BGC para identificar a aquellos pacientes con mayor riesgo de recidiva es indiscutible, pero también debe reconocerse que el procedimiento tiene un límite. Este límite no es despreciable, sobre todo si lo definimos en ambos sentidos: subestimar la incidencia real de metástasis (los considerados falsos negativos) o sobreestimarlas (los que podríamos llamar «falsos positivos»).
La existencia de falsos positivos debidos a la técnica de estudio se refiere sobre todo al estudio molecular, más que al anatomopatológico, y puede atribuirse a diferentes causas como la contaminación de la muestra durante el proceso de la BGC (uso del mismo material quirúrgico para la incisión cutánea y para la manipulación del ganglio), a la contaminación en el laboratorio (menos frecuente) o a la presencia de células no neoplásicas en el interior del ganglio que también expresen los marcadores utilizados73,74. Sin embargo, dichas eventualidades se pueden minimizar con una metodología cuidadosa.
En lo que se refiere a los falsos negativos, desde un punto de vista estricto, la definición exacta de un resultado falso negativo de la BGC en el MM debería incluir sólo a aquellos pacientes que presentan metástasis en ganglios no centinelas de un territorio ganglionar en el que, en el mismo momento, se les ha diagnosticado un GC negativo. Estos falsos negativos así definidos, también conocidos como skip metastasis, se identificaron durante los primeros estudios destinados a validar la efectividad de la técnica de la BGC y su frecuencia se cifró en torno al 2 % de los pacientes17-19. Sin embargo, es poco probable que dichos estudios se sigan realizando dado la morbilidad asociada a la LE y su aparente falta de beneficio para el paciente27-30.
Por este motivo, y para facilitar la comparación de los resultados de las distintas series, algunos autores han propuesto otros métodos para calcular la tasa de posibles falsos negativos de la BGC5,34. En el sentido más amplio del término podemos definir un falso negativo como todo aquel paciente que tras un GC negativo sufre una recidiva de la enfermedad, sea cual sea el lugar de recidiva, y que llega a ser de un 24 % en las series con seguimiento más largo34,68.
Sin embargo, también es cierto que no podemos pretender que la BGC sea capaz de predecir en cualquier sentido cómo va a comportarse el tumor, ya que no deja de ser una técnica de estadificación exclusivamente ganglionar. Para la mayoría de los grupos que han publicado sus resultados en torno a la BGC, sólo aquellos casos con recidiva ganglionar en el mismo territorio estudiado con la BGC, tanto si es el único lugar de recidiva como si es de forma simultánea con otros lugares, deberían ser considerados como los verdaderos falsos negativos de la técnica34. Según este último criterio, el porcentaje de falsos negativos desciende hasta la mitad, en torno a un 10 % en la mayoría de las series (tabla 6).
Tasas de éxito y de recidivas ganglionares de las principales series publicadas de pacientes con melanoma y biopsia del ganglio centinela
| Autor | Año | N.° de pacientes totales | N.° de pacientes con GC- | Seguimiento mediana | N.° de recidiva ganglionares* | Tasa de fallo (%) | Tasa de falsos negativos (%) |
| Gershenwald77 | 1998 | 322 | 243 | 35 | 10 | 4,1 | 16 |
| Essner85 | 1999 | 267 | 225 | 45 | 11 | 4,8 | 20,7 |
| Gadd86 | 1999 | ND | 89 | 23 | 7 | 8 | ND |
| Clary78 | 2001 | 308 | 252 | 24 | 11 | 4,4 | 16,4 |
| Cascinelli27 | 2000 | 787 | 646 | 29 | 40 | 6 | 24,8 |
| Statius Muller87 | 2001 | 263 | 204 | 42 | 3 | 0 | 7 |
| Jansen88 | 2000 | 199 | 151 | 32 | 6 | 4 | 11 |
| Harlow89 | 2001 | 329 | 297 | 36 | 10 | 3,3 | 20,4 |
| Doting90 | 2002 | 200 | 150 | 47 | 6 | 4 | 10 |
| Chao91 | 2002 | 1.183 | 950 | 16 | 14 | 1,5 | 7,1 |
| Vidal-Sicart92 | 2003 | 435 | 358 | 26 | 7 | 1,9 | 8,9 |
| Morton93 | 2003 | 1.599 | 1.277 | ND | 33 | 2,6 | 9,2 |
| Nowecki94 | 2003 | 726 | 579 | 34 | 27 | 4,7 | 13,6 |
| Yee34 | 2005 | 991 | 836 | 42 | 22 | 2,6 | 13,2 |
| Berck95 | 2005 | 274 | 221 | 30 | 10 | 4,5 | 20,4 |
| Rex96 | 2005 | 240 | 147** | 31 | 8 | 5,4 | 13,8 |
| Wagner97 | 2003 | 408 | 323 | 31,4 | 11 | 3,4 | 11,5 |
| Mangas63 | 2006 | 138 | 103** | 45 | 4 | 3,8 | 10,2 |
| Morton32 | 2006 | 769 | 603** | 59,8 | 26 | 4,3 | 17,6 |
| Van Akkooi40 | 2006 | 262 | 185 | 23 | 6 | 3,2 | 7,2 |
Se considera recidiva ganglionar a todo aquel paciente que presenta, como primer lugar de recidiva, una recidiva en el territorio de drenaje de la biopsia del ganglio centinela asociado o no a otros lugares.
Diferencia entre los pacientes iniciales y los que se siguen: tasa de fallo: n.° de recidivas ganglionares/n.° de pacientes con GC -; tasa de falsos negativos: n.° de recidivas ganglionares/n.° de pacientes con GC + más n.° de recidivas ganglionares. GC: ganglio centinela. Modificada de Yee et al34.
En cualquier caso dichos falsos negativos, definidos en uno u otro sentido, serán consecuencia de uno de los tres mecanismos, o de la combinación de los mismos, detallados a continuación.
Defectos técnicosNos referimos a ellos cuando el ganglio que se biopsia no corresponde al verdadero GC, ya sea por defecto de la técnica quirúrgica per se y/o de la linfogammagrafía previa. También pueden ocurrir tras una alteración en el patrón de drenaje del MM primario como consecuencia de la exéresis amplia del MM primario o por la inflamación o infección alrededor de la herida quirúrgica de la biopsia/exéresis. Para comprobar que, una vez el presunto GC ha sido extraído, realmente se trata del «centinela» se han desarrollado recientemente dos métodos distintos: el método de la tinta de carbón y la medición de partículas de antimonio75,76. Ambos métodos, sin embargo, han sido criticados, el primero porque el uso del carbón puede dificultar o enmascarar la presencia de células de melanoma en el ganglio, a veces muy difíciles de encontrar, y el segundo porque permite un chequeo retrospectivamente pero no en el momento de la BGC12. Además, ninguno de los dos métodos permite al cirujano en la sala de operaciones estar más seguro de que aquél es el GC y de que no se deja ningún GC por extraer. Así, a pesar de un resultado negativo tras la biopsia de un verdadero GC, otros centinelas pueden haber quedado en el territorio de drenaje y ser la causa de posteriores recidivas. Estos casos son cada vez menos numerosos, ya que la definición de GC es ahora menos estricta y los radiocoloides usados son también de menor tamaño5,38.
Defectos del estudio anatomopatológicoEntendemos como tales aquellos casos en los que ha pasado desapercibida una micrometástasis en el examen anatomopatológico o, menos frecuentemente molecular, de un ganglio correctamente identificado como GC. Ocurre sobre todo como consecuencia de un estudio insuficiente de la muestra del ganglio, ya que el estudio rutinario de éste sólo analiza una pequeña porción. Inicialmente se creyó que éste era el principal mecanismo para explicar los fallos del estudio del GC. Sin embargo, con la introducción de la IHQy la técnica de multisecciones la sensibilidad del estudio anatomopatológico ha mejorado notablemente, pero el problema es que son protocolos muy laboriosos (tabla 4)42. En este sentido, se ha observado que el reanálisis de los pacientes con supuestos GC negativos tras un primer estudio anatomopatológico con HE pero que experimentan recidiva ganglionar en el mismo territorio de drenaje, permite detectar un mayor número de ganglios metastásicos justificando así los falsos negativos del estudio anatomopatológico inicial. Gershenwald et al77 y Clary et al78 encontraron que el 80-90% de los pacientes con recidiva ganglionar tras un primer análisis negativo del GC tenían células metastásicas en el GC tras el reanálisis más detallado. Sin embargo, otros autores como Li et al43 o Yee et al34 encontraron metástasis en los GC tras el reanálisis en sólo un 30 % de los casos. En este contexto, las técnicas de diagnóstico molecular, que constituyen una herramienta de gran ayuda para complementar el análisis anatomopatológico del ganglio, dependerán en gran medida de la sensibilidad del estudio histológico previo42,46,47.
En cuanto a los posibles falsos negativos del estudio molecular, deberíamos incluir los errores de muestreo o las muestras en las que el ARN se haya podido degradar y aquellas en las que la reacción de RT-PCR haya podido ser ineficaz74. Sin embargo, existen controles que se realizan de forma rutinaria en el laboratorio, como es la incorporación de un gen de control endógeno que será proporcional a la cantidad de ARN depositado y el uso de ARN de referencia como control del correcto funcionamiento de la reacción de transcripción inversa. Además, otra posible explicación de los falsos negativos moleculares sería el de la heterogeneidad tumoral. Numerosos estudios han demostrado que no existe un marcador que detecte el 100 % de los tumores primarios, sin embargo, el grado de heterogeneidad de las micrometástasis en el ganglio no ha sido tan profundamente estudiado. El enfoque actual de utilizar una combinación de marcadores moleculares, en vez de un solo marcador como anteriormente se hacía, solventa en gran medida dicho problema73,74.
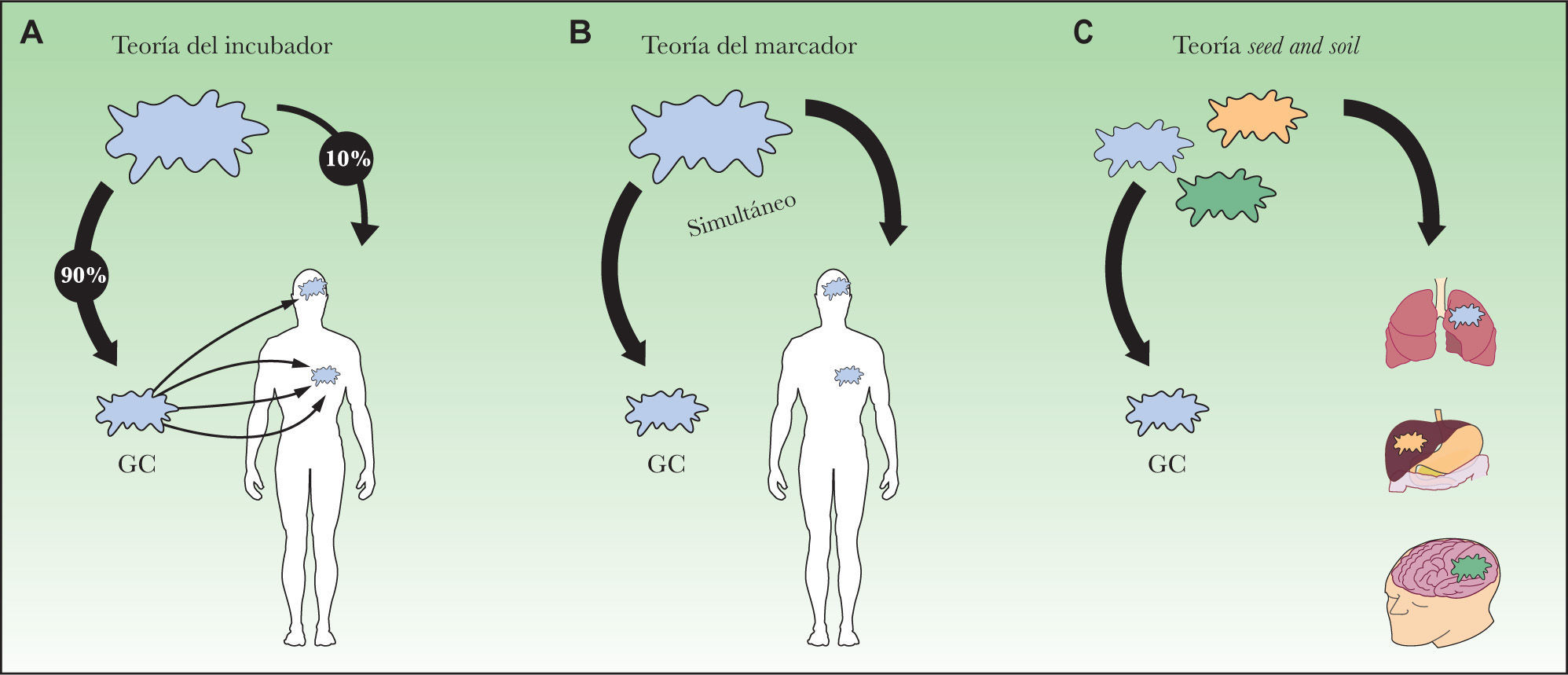
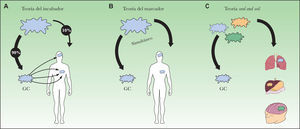
Defectos biológicosA ellos nos referimos para explicar aquellos casos que pueden deberse a una biología de la diseminación del MM diferente a la que se contempla bajo la hipótesis de la diseminación de las metástasis en la que se fundamenta el estudio del GC (fig. 2A). Dicha hipótesis, llamada «la teoría del incubador», defendida por Morton y Cochran79, se basa en la idea de la diseminación ordenada o secuencial de las metástasis. Según esta teoría, para la gran mayoría de los tumores la metástasis primero se desarrollaría en el GC y sólo entonces se diseminaría en una primera fase al resto de los ganglios del territorio para luego ganar la capacidad de dirigirse hacia lugares más distantes79. Tanto la observación de que el tamaño metastásico en el GC como el número de ganglios afectados son factores pronósticos de la afectación ganglionar serían acordes con dicha teoría. Por el contrario, la falta aparente de efecto terapéutico de la detección precoz de las metástasis ganglionares, ya sea mediante la BGC o la LE, no se explicaría con dicha hipótesis. Otro modelo alternativo defiende que la diseminación ocurre de forma simultánea tanto por vía linfática como hemática, la llamada «teoría del marcador» representada en la figura 2B24. En este caso, la presencia de metástasis ganglionares actuaría como marcador irrevocable de afectación a distancia, y esto, como ya se ha comentado, tampoco siempre es así. Frente a estas dos teorías (en parte consideradas como opuestas), otros autores propugnan otro modelo de diseminación en el cáncer que se caracterizaría por la existencia de diferentes vías de diseminación según las características de cada tumor10,80,81. Según este modelo, en cierto modo basado en la teoría de seed and soil (fig. 2C) propuesta por Paget en 188982, algunos tumores, independientemente de los clásicos factores pronósticos, no tendrán nunca la capacidad biológica de formar metástasis, y en cambio otros, a pesar de no mostrar los factores pronósticos desfavorables conocidos en el momento del diagnóstico, guardarán la capacidad final de asentarse y crecer en tejidos concretos (ganglio linfático, pulmón, hígado, cerebro, etc.)80.
Por último, otro factor biológico a tener en cuenta a la hora de interpretar los resultados de la BGC sería aquellas células metastásicas que pueden permanecer en el territorio linfático, fuera del ganglio, en el momento de la BGC. Bajo este concepto se englobaría a aquellas metástasis regionales consecuencia de la extensión de la enfermedad a partir de la existencia de enfermedad local o en tránsito inaparente, desde el punto de vista clínico, en el momento de realizar la BGC. En esta circunstancia la negatividad del GC extirpado refleja únicamente el estatus anatomopatológico del GC en aquel momento, es decir, cuando se practicó la biopsia. Se había sugerido que la propia técnica de la BGC acentuaría este fenómeno al observar, en algunas series de enfermos, que el porcentaje de pacientes con metástasis en tránsito se incrementaba entre los pacientes sometidos a esta prueba83. Sin embargo, la literatura es confusa en este sentido y los últimos estudios publicados no confirman dicha observación84.
AgradecimientosAl fondo de Investigaciones Sanitarias por las becas PI/443 y PI/0933. A los Dres. Manel Fraile, Antoni Alastrué, M.a Teresa Fernández-Figueras y a todo el servicio de Dermatología de Can Ruti.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.