La asociación clínica o histológica de un melanoma con un nevo melanocítico previo varía entre las series previamente publicadas de forma prominente. Esta variación se produce tanto en función de si se tienen en cuenta los restos histológicos (4-72%) como en función de la presencia de una lesión clínicamente evidente (42-85%). La asociación histológica con un nevo se ha correlacionado con factores pronósticos favorables, mientras que la asociación clínica por el contrario lo hace con factores desfavorables. Esta revisión pretende abordar las características vinculadas con el melanoma asociado a nevo, en relación con: la teoría de las vías divergentes para el desarrollo de un melanoma cutáneo de Whiteman, los factores vinculados a nevogenicidad y la genética y biología molecular del melanoma y sus lesiones precursoras. Adicionalmente, basado en el análisis agregado de un total de 16.162 pacientes publicados en la literatura hasta la fecha, se ha calculado la proporción total de melanomas histológicamente asociados a nevo melanocítico, cifrándose en el 29,8%.
The association of melanoma with a preexisting melanocytic nevus varies considerably between series, depending on whether the association is based on histological signs (4%-72%) or a clinically evident lesion (42%-85%). Histological association with a nevus correlates with favorable prognostic factors, whereas a clinical association correlates with unfavorable factors. In this review, we discuss the characteristics of nevus-associated melanoma from different perspectives: Whiteman's divergent pathway hypothesis for the development of cutaneous melanoma; and the factors involved in nevogenicity, including both the genetic and molecular factors involved in the development of the melanoma and its precursor lesions. Finally, a cumulative analysis of the 16 162 cases reported in the literature revealed that 29.8% of melanomas are histologically associated with a melanocytic nevus.
Mishima predijo en 1967 que se hablaría de 2 tipos diferenciados de melanoma: los llamados «melanocitomas malignos» y «nevocitomas malignos», en función de su desarrollo a partir de un lentigo senil o de un nevo melanocítico, respectivamente1. Desde entonces se ha logrado avanzar de manera prominente en la biología molecular de las neoplasias melanocíticas. Aunque esta hipótesis no ha quedado refutada, contribuye a resaltar la importancia de las lesiones potencialmente precursoras de melanoma, entre las que destacan los nevos melanocíticos.
Siguiendo la teoría de algunos autores, los nevos melanocíticos provendrían de la expansión clonal de un melanocito. Esta se produciría de forma espontánea o secundaria a estímulos externos como la fotoexposición, y daría lugar a una proliferación generalmente uniforme y simétrica histológicamente, con mutaciones genéticas homogéneas en la mayor parte de las células constituyentes2. Múltiples estudios apoyan este carácter clonal de los nevocitos3–5, aunque otras publicaciones han tenido hallazgos discordantes6,7, y permiten definir los nevos melanocíticos como clones de melanocitos que han alcanzado la senescencia5,8,9. Las mutaciones genéticas que se encuentran en algunos nevos son también consideradas fundamentales en el desarrollo de un melanoma. Por ello, se ha propuesto que los nevos podrían ser verdaderas lesiones precursoras de melanoma, el cual terminaría por desarrollarse como consecuencia de una acumulación progresiva de mutaciones genéticas adicionales10. Bastian et al., en función del análisis de una serie de 37 casos de melanoma que incluía lesiones melanocíticas adyacentes, observaron un gradiente en la cantidad y tipo de mutaciones encontradas entre las lesiones benignas, intermedias pero probablemente benignas, intermedias pero probablemente malignas y malignas11.
Por tanto, se podría asumir que existe un proceso evolutivo por el cual un melanocito sufre una expansión clonal con una ulterior transición a un nevo melanocítico y finalmente a un melanoma. Sin embargo, este modelo melanocito-nevo-melanoma se limitaría a determinados casos de melanoma, puesto que en la práctica habitual la mayoría de los melanomas no tienen una lesión melanocítica adyacente y, por lo tanto, se consideran de aparición de novo. Este hecho es más evidente en los melanomas con subtipo histológico lentigo maligno melanoma o melanoma lentiginoso acral. Asimismo, tampoco resulta demostrable histológicamente en todos los casos en los que clínicamente se podría sospechar un melanoma asociado a nevo (MAN).
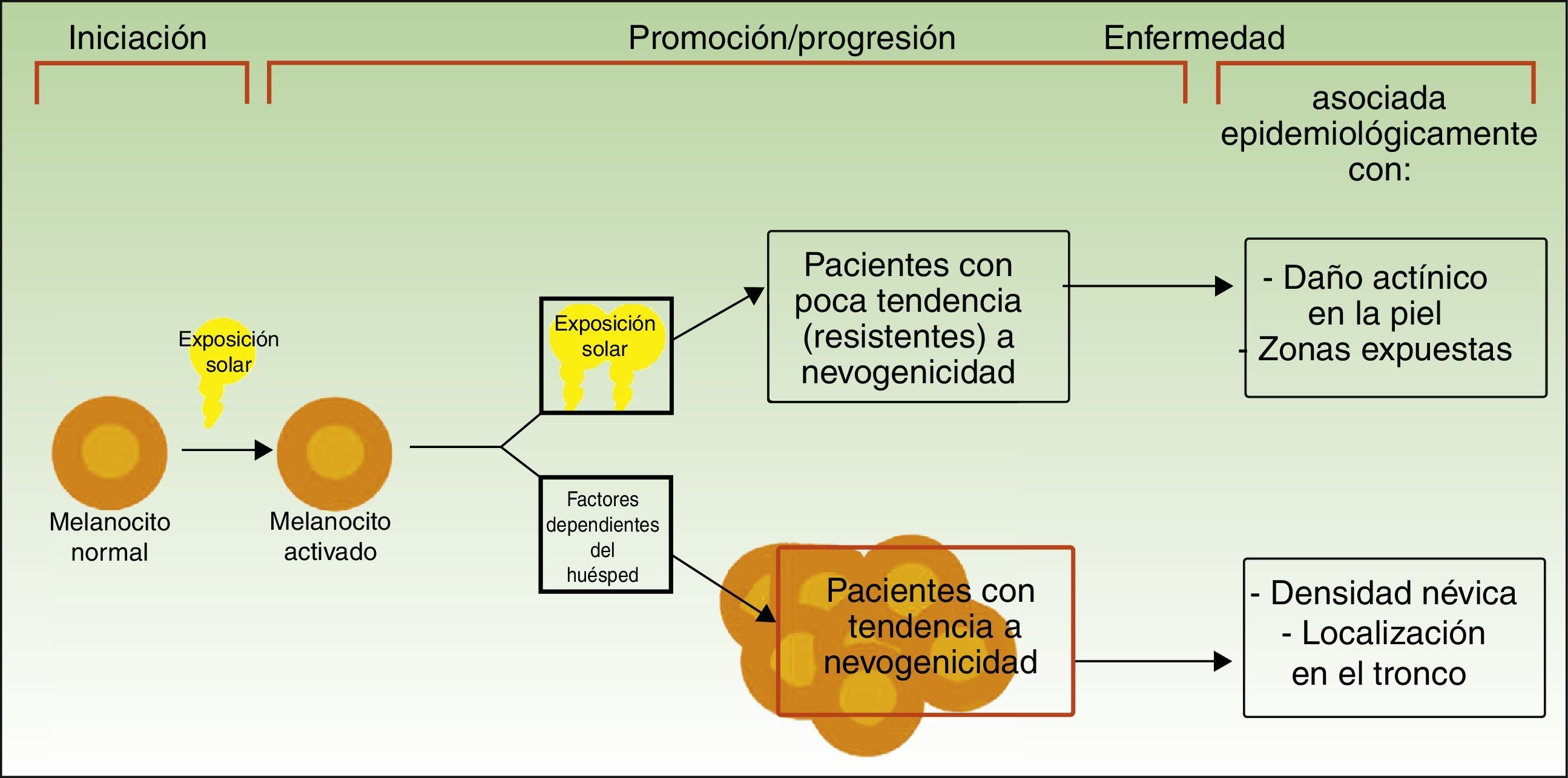
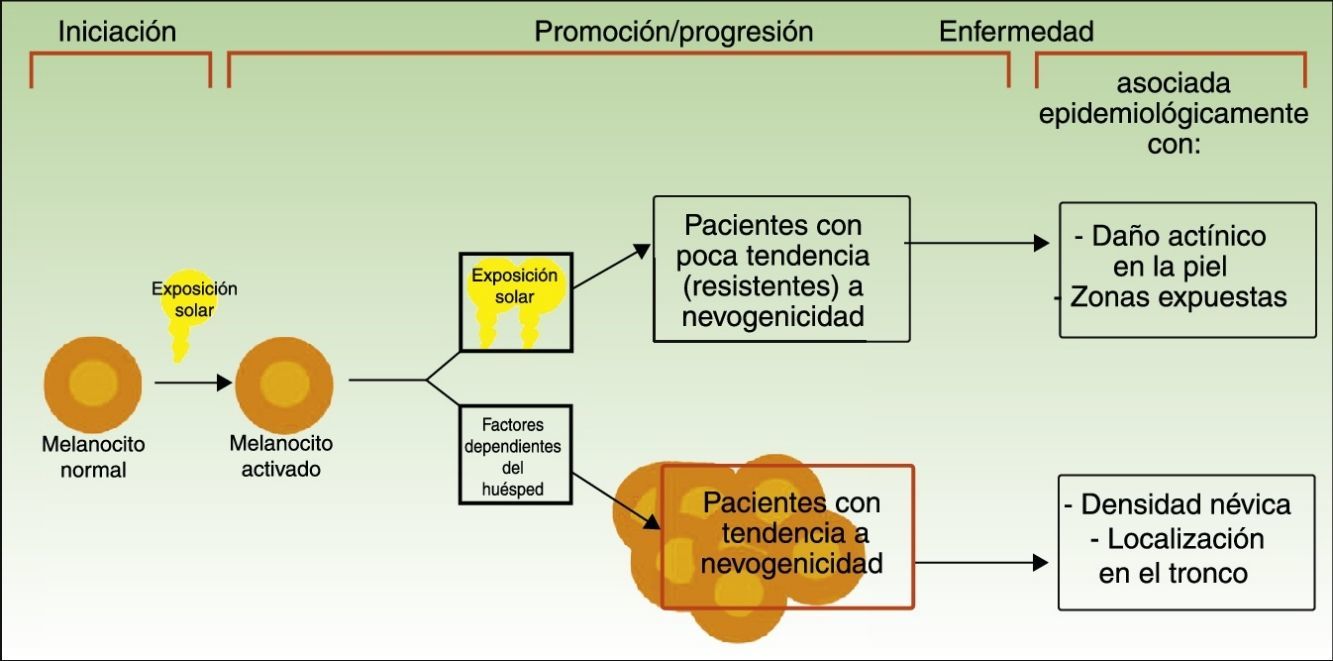
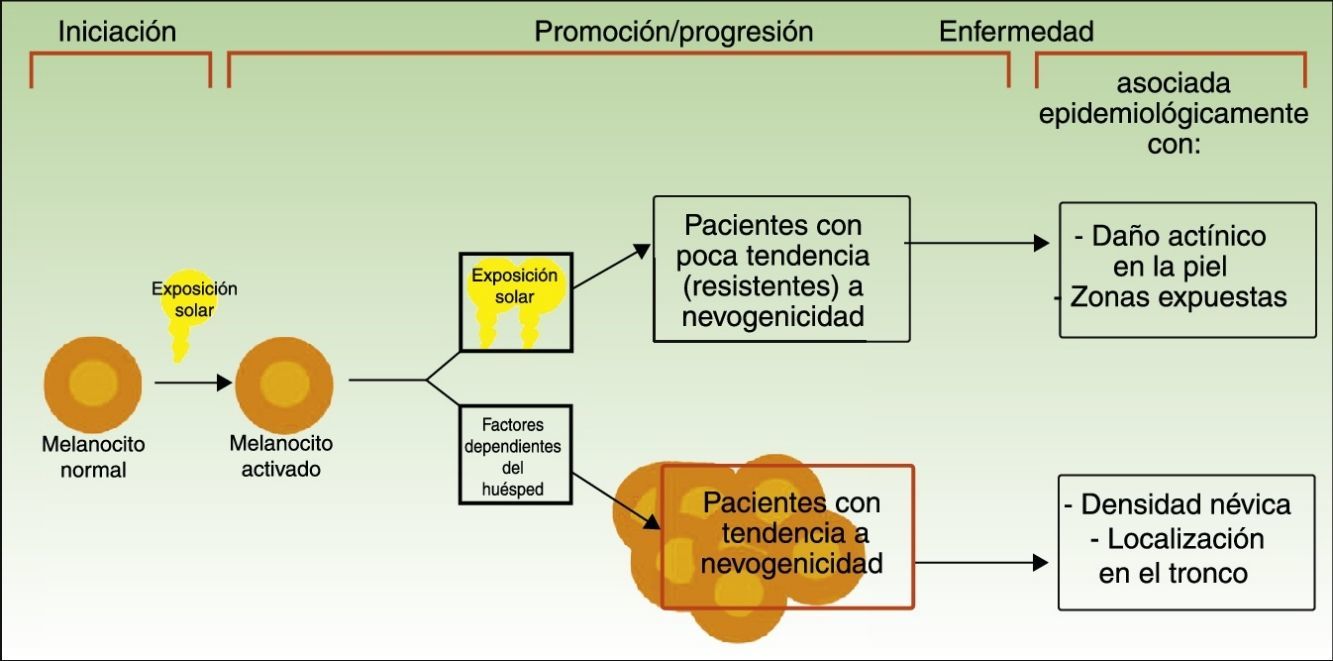
Vías divergentes en el desarrollo del melanomaEl modelo patogénico que asume que el melanoma se desarrolla a partir de un nevo melanocítico como consecuencia de una acumulación de eventos genéticos parece encajar en la vía de la inestabilidad melanocítica, una de las 2 vías para el desarrollo del melanoma cutáneo postuladas por Whiteman: la de los pacientes de la vía de la inestabilidad melanocítica. La hipótesis de las 2 vías, propuesta en 1998 y confirmada en diferentes estudios posteriores (entre los que se incluyen uno del mismo grupo de investigación12 y un metaanálisis13), plantea que existen al menos 2 vías etiopatogénicas principales para el desarrollo del melanoma cutáneo no acral (fig. 1).
Vías para el desarrollo del melanoma de acuerdo a la exposición y a la predisposición del paciente.
Fuente: modificada de Whiteman et al.12.
Por un lado, estaría la vía marcada por la fotoexposición crónica en la que el melanoma es una consecuencia de la acumulación de mutaciones producidas por la radiación ultravioleta en el melanocito. Esta vía es característica de pacientes de edad avanzada, con una mayor sensibilidad constitutiva a los efectos nocivos del sol (fototipo bajo), un daño actínico marcado y con antecedentes de cáncer cutáneo no-melanoma. Los melanomas producidos por esta vía se desarrollarían principalmente en la cara, el cuello o las extremidades inferiores.
Por otro lado, estaría la vía «nevogénica», también denominada de inestabilidad de las células pigmentarias, en la que hay una mayor tendencia —genéticamente determinada— a la proliferación melanocítica. En esta vía, la exposición solar en la infancia —y en menor medida en la edad adulta— finalmente sería responsable, por la producción de nuevas mutaciones, de la progresión de células melanocíticas, genéticamente predispuestas a la proliferación a células tumorales12,14. Esta vía afectaría a pacientes más jóvenes, que expresan su facilidad para la proliferación melanocítica con un número elevado de nevos melanocíticos y que desarrollarían melanomas en zonas de fotoexposición intermitente como el tronco.
Del nevo melanocítico al melanoma: factores genéticos y moleculares en su desarrolloEn los últimos años se han producido importantes avances en el conocimiento de los factores genéticos, epigenéticos y moleculares implicados en la nevogénesis y el desarrollo del melanoma. Dichos avances han permitido no solo una mejor comprensión de la biología y curso natural de estas lesiones, sino también la introducción y desarrollo de terapias anti-diana, con respuestas terapéuticas sin precedentes.
Las neoplasias melanocíticas comprenden anomalías genéticas en forma de eventos oncogénicos primarios (habitualmente activación de protooncogenes en oncogenes) y secundarios (generalmente supresión de la expresión de genes implicados en la pigmentación cutánea y en los procesos de senescencia celular)2. Adicionalmente, contribuyen al desarrollo de estas lesiones la interacción constante de los agregados de células melanocíticas con el microambiente epitelial. Se ha descrito, por ejemplo, la influencia de fenómenos inflamatorios15, hipoxia16 e intercambios paracrinos17, entre otros, en la progresión del melanoma. Esta interacción se modifica, además, por otros factores, tales como la radiación ultravioleta18.
Atendiendo a las anomalías genéticas, el grupo de Curtin et al.19 mostró que el perfil mutacional de los melanocitos de un melanoma puede estar determinado por el patrón de fotoexposición. De este modo, propusieron la clasificación del melanoma en 4 grupos, establecidos en función de la localización de los melanomas y de la importancia del daño actínico en su desarrollo —creciente del primer al cuarto grupo—, que incluirían —en el caso del tercero y el cuarto— la posibilidad de lesiones intermedias o precursoras:
- 1)
Melanoma mucoso: localizado en las mucosas, con una exposición solar inexistente.
- 2)
Melanoma acral: situado en zonas acras, con una fotoexposición limitada.
- 3)
Melanoma de localización en áreas fotoexpuestas pero sin signos de daño actínico crónico (sin elastosis solar histológica), entre los que también se incluyen los melanomas spitzoides. Consideran que parte de estos melanomas se podrían desarrollar a partir de lesiones precursoras benignas e intermedias (entre las que se incluyen los nevos adquiridos, los nevos displásicos, los nevos de Spitz y los tumores de Spitz atípicos).
- 4)
Melanoma de localización en áreas de fotoexposición crónica y daño actínico evidente (elastosis solar), incluidos los melanomas desmoplásicos para el que se ha propuesto que su lesión precursora podría ser el «lentigo solar inestable»19,20.
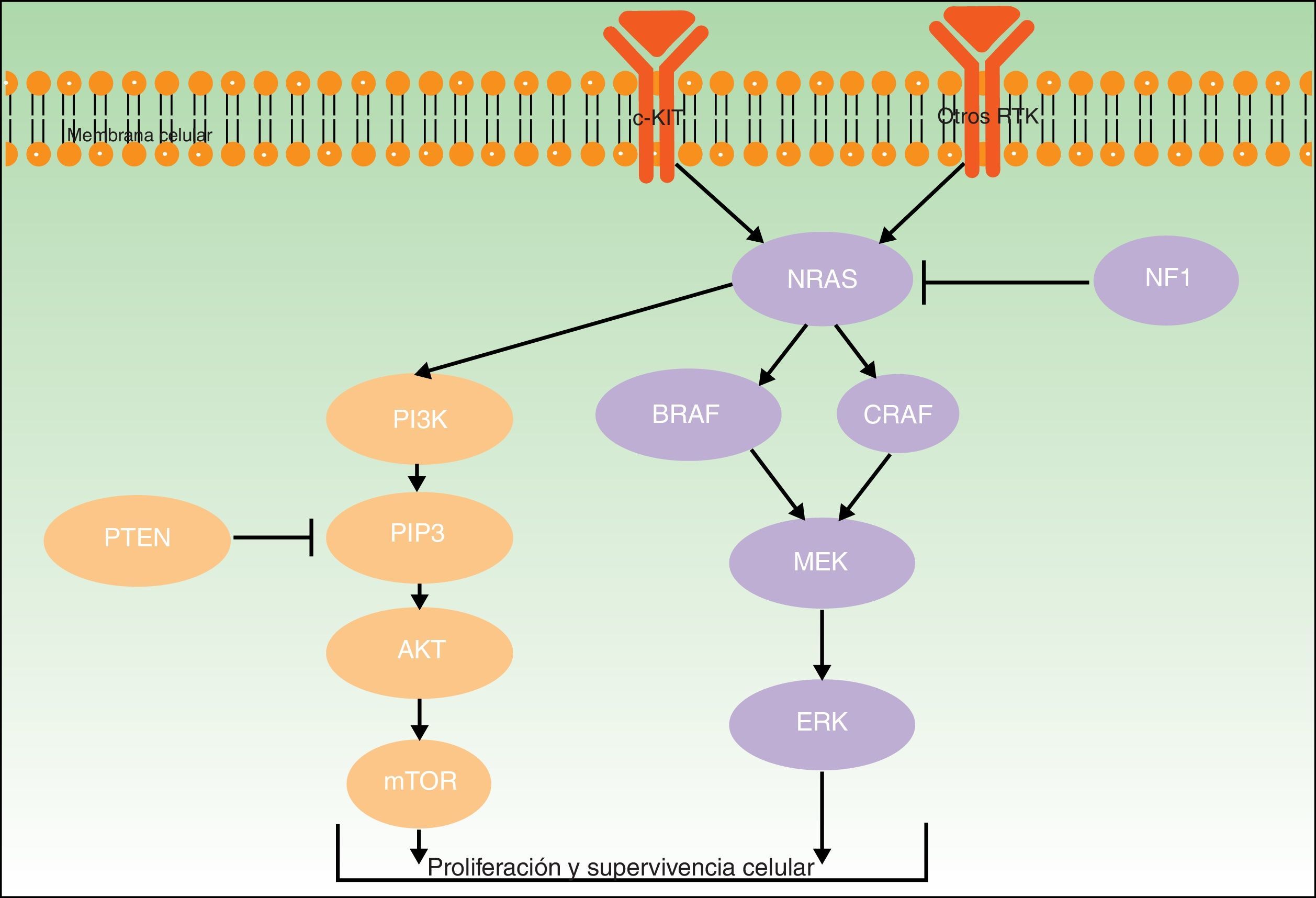
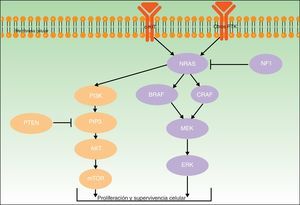
Para todos estos melanomas se han descrito una serie de mutaciones patogénicas consideradas iniciadoras o driver, que contribuyen a su desarrollo. En la figura 2 se ilustran las principales vías involucradas en el melanoma: la vía de señalización de la proteína quinasa activada por mitógenos (MAPK) y la vía de fosfatidilinositol-3-quinasa/proteína quinasa B/diana mecanística de la rapamicina (PI3K/AKT/mTOR).
Ambos genes codifican para proteínas activadoras a diferentes niveles de la vía MAPK, que regula la transducción de señales desde la superficie melanocítica para la transcripción de factores que median en la proliferación, crecimiento, supervivencia y apoptosis celular19,23. La proporción de mutaciones somáticas activadoras en los genes BRAF y NRAS en lesiones melanocíticas varía ampliamente entre series.
BRAF está mutado con más frecuencia en los pacientes de la vía de inestabilidad de células pigmentarias24. Las mutaciones de BRAF se han encontrado en más del 80% de los nevos melanocíticos comunes10,25–27. En cuanto a su frecuencia en melanomas, se detectan en cerca del 40-50% de los casos de melanoma primario (más habitualmente de extensión superficial, en áreas de fotoexposición intermitente y en los MAN)27,28.
Las mutaciones en NRAS son menos frecuentes. Se encuentran hasta en el 56% de los nevos melanocíticos congénitos27, y de forma mucho menos frecuente (<5%) en nevos adquiridos27,29. No obstante, la dificultades existentes para distinguir entre nevo común adquirido y nevo congénito de pequeño tamaño podría falsear parte de los resultados publicados30. Las mutaciones en NRAS se observan en un 20-30% de los melanomas (especialmente en melanomas nodulares en zonas de fotoexposición crónica)28,31.
Se considera que las mutaciones en BRAF y NRAS tendrían un papel en la iniciación de la proliferación de los melanocitos constituyentes de las lesiones pigmentadas8 y en las primeras fases del desarrollo de un melanoma10. No obstante, resultan insuficientes para la transformación maligna de un nevo, que requeriría la aparición de mutaciones adicionales10,25–27.
NF1Gen supresor tumoral codificante de la neurofibromina, que tiene una función reguladora en la vía MAPK. La presencia de mutaciones somáticas inactivadoras, que puede verse en diferentes tipos de cánceres, genera la resistencia de RAS a ser regulado negativamente, con la activación secundaria de ERK. En el melanoma la mutación en NF1 se ha involucrado en el inicio de su desarrollo, pero también en la resistencia a los inhibidores de RAF a través del mecanismo descrito32,33.
TERTCodificante de la transcriptasa de telomerasa inversa, esencial para evitar el acortamiento de los extremos de los cromosomas, tanto en líneas somáticas como germinales. Interviene en fenómenos de senescencia celular y carcinogénesis. La expresión de la telomerasa se encuentra inhibida en la mayor parte de células después del nacimiento, pero no en las células cancerosas, donde la actividad enzimática de la telomerasa aumenta. Las mutaciones somáticas en el promotor de TERT habitualmente tienen la firma típica de las causadas por la radiación ultravioleta (generación de dímeros de pirimidina)34,35. Se han identificado en cerca de un 40% de melanomas, más frecuentemente en áreas fotoexpuestas36. Implican un peor pronóstico, al tener características más agresivas que condicionan una menor supervivencia tanto libre de enfermedad como específica relacionada con el melanoma37. Se han asociado además a una mayor velocidad de crecimiento, sobre todo si coexisten con mutaciones en BRAF o NRAS38.
KIT y PTENEl oncogén KIT codifica para la proteína tirosina-quinasa transmembrana c-Kit (que actúa en el crecimiento y la proliferación de los melanoblastos embrionarios)39, que interviene tanto en la vía PI3KT/AKT como en la vía MAPK40 (fig. 2). PI3K genera fosfatidil-inositol-trifosfato, el cual activa las proteínas AKT (que influyen en la regulación del ciclo celular, proliferación, supervivencia y transformación neoplásica) y mTOR (que intervienen en la tumorogénesis)41. Al abordar la vía PI3K/AKT/mTOR hay que mencionar el gen supresor tumoral del homólogo de fosfatasa y tensina (PTEN), cuya función fundamental es la de inhibir la activación de AKT (degradando fosfatidil-inositol-trifosfato a través de su actividad fosfatasa)42.
Las mutaciones en la vía PI3K/AKT/mTOR son heterogéneas, involucran diferentes genes y también pueden coexistir con mutaciones en BRAF (17%) y NRAS (9%)43. Las mutaciones somáticas en KIT se detectan globalmente en un 2% de melanomas; parecen tener relevancia fundamentalmente en melanomas acrales (un 14% de melanomas lentiginosos acrales tienen mutaciones en KIT) y mucosos (entre los cuales un 23% tienen el gen KIT mutado)41. Las mutaciones somáticas de PTEN se detectan en hasta un 22% de casos de melanoma43.
CDKN2ALocalizado en el brazo corto del cromosoma 9, este gen codifica para 2 proteínas supresoras tumorales que tienen un papel fundamental en la proliferación y la senescencia celular. La primera es p14-ARF, que controla la proliferación celular mediante la estabilización de p53, que a su vez induce la expresión de p21, un inhibidor de ciclina dependiente de quinasa. La segunda es p16-INK4A, que efectúa el mismo papel mediante la inhibición de la asociación de las ciclinas dependientes de quinasas (CDK4/6) y la ciclina D1 (CCND1)44–46. CDKN2A es el locus conocido más frecuente en los casos de melanoma familiar. Se han identificado mutaciones en línea germinal en CDKN2A que alteran la función de una o 2 de las proteínas codificadas. En nuestro medio están presentes en el 15% de los casos de melanoma familiar47,48. Se han descrito diferentes alteraciones somáticas por las cuales su función se ve disminuida o perdida (deleciones homocigotas, mutaciones o silenciación epigenética por metilación) en casi un 90% de los melanomas49. Su aparición se ha involucrado con la capacidad invasiva del melanoma10,33. Las mutaciones somáticas en CDKN2A no están presentes en los nevos melanocíticos comunes y se encuentran en un 10% de los nevos displásicos49.
Un estudio incluyendo la secuenciación exómica de nevos melanocíticos displásicos y melanoma ha permitido observar que los nevos melanocíticos tienen genomas relativamente estables con menos alteraciones, y que la progresión a melanoma requeriría la aparición de mutaciones en genes supresores tumorales clave50. De igual manera, un modelo para lesiones de determinadas localizaciones ha propuesto la existencia de un continuum genético-molecular de las neoplasias melanocíticas a través del cual las lesiones benignas podrían, por la acumulación progresiva de mutaciones (en BRAF, NRAS, TERT, CDKN2A, entre otros, como los codificantes de las subunidades SWI/SNF y de p53) en el contexto de factores ambientales (de forma destacada, la exposición solar), evolucionar a lesiones «intermedias», e ir deviniendo en melanomas in situ, invasores y metastásicos11.
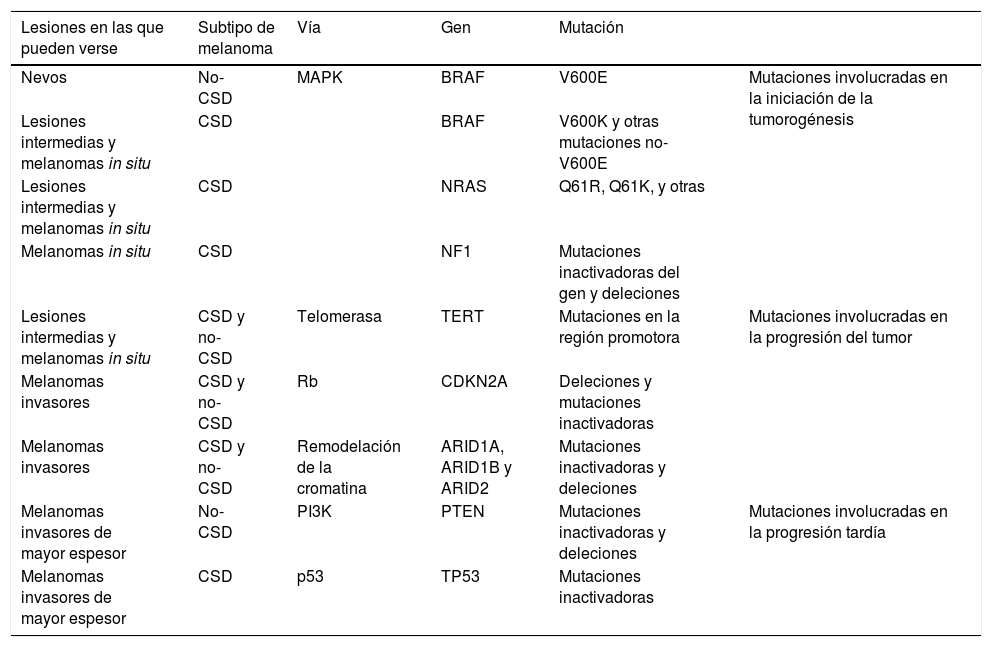
Así pues, existen alteraciones genéticas compartidas entre nevos melanocíticos y melanoma que se presentan de forma acumulativa desde las lesiones «precursoras» (benignas o de «malignidad intermedia») hasta las neoplásicas con capacidad metastatizante. En la tabla 1 se resumen las alteraciones genéticas que actualmente son consideradas más importantes en este proceso33.
Mutaciones genéticas frecuentes en las neoplasias melanocíticas y su papel en la progresión hacia el melanoma
| Lesiones en las que pueden verse | Subtipo de melanoma | Vía | Gen | Mutación | |
|---|---|---|---|---|---|
| Nevos | No-CSD | MAPK | BRAF | V600E | Mutaciones involucradas en la iniciación de la tumorogénesis |
| Lesiones intermedias y melanomas in situ | CSD | BRAF | V600K y otras mutaciones no-V600E | ||
| Lesiones intermedias y melanomas in situ | CSD | NRAS | Q61R, Q61K, y otras | ||
| Melanomas in situ | CSD | NF1 | Mutaciones inactivadoras del gen y deleciones | ||
| Lesiones intermedias y melanomas in situ | CSD y no-CSD | Telomerasa | TERT | Mutaciones en la región promotora | Mutaciones involucradas en la progresión del tumor |
| Melanomas invasores | CSD y no-CSD | Rb | CDKN2A | Deleciones y mutaciones inactivadoras | |
| Melanomas invasores | CSD y no-CSD | Remodelación de la cromatina | ARID1A, ARID1B y ARID2 | Mutaciones inactivadoras y deleciones | |
| Melanomas invasores de mayor espesor | No-CSD | PI3K | PTEN | Mutaciones inactivadoras y deleciones | Mutaciones involucradas en la progresión tardía |
| Melanomas invasores de mayor espesor | CSD | p53 | TP53 | Mutaciones inactivadoras |
A pesar de la creciente aceptación de que este modelo evolutivo dinámico de las neoplasias melanocíticas puede explicar el desarrollo de una proporción de melanomas, es un hecho que la mayoría de los melanomas aparecen de novo (MDN), y que solo en un porcentaje variable de melanomas se observan restos histológicos de un nevo melanocítico (MAN).
Proporción de melanomas asociados a nevoEl riesgo de transformación de un nevo cualquiera en melanoma se considera generalmente limitado. Se ha estimado que el riesgo de desarrollo de melanoma sobre cualquier nevo individual acumulado hasta los 80 años sería del 0,03% (uno de cada 3.164 nevos) en hombres y del 0,009% (uno de cada 10.800) en mujeres52.
En cuanto a la proporción de melanomas cutáneos en la población caucásica clínica o histológicamente asociados con un nevo melanocítico preexistente, las series la sitúan entre 4-85%. Estas cifras son generalmente menores cuando se tienen en cuenta los restos histológicos (4-72%)53–82, y mayores si lo que se consideran son aquellos casos en los que el paciente recuerda una lesión clínicamente evidente (42-85%)83,84. En las siguientes líneas únicamente se tendrá en cuenta la asociación histológica objetiva para la definición de MAN.
En 1988 Ackerman afirmó que el MDN es más frecuente. Lo hizo basándose en la experiencia acumulada en su serie de más de 75.000 melanomas en pacientes de raza caucásica, de los que solo el 20% eran MAN85. Este hallazgo no era aplicable a los melanomas en raza negra y asiática, donde aparece mayoritariamente como MDN en las palmas, las plantas y el aparato ungueal85. Posteriormente, se han publicado una amplia variedad de estudios que, por una parte, han elevado en su mayoría la proporción estimada de MAN y, por otra parte, han puesto en evidencia que los MAN también pueden aparecer en raza no-caucásica86. Es relevante tener en cuenta que tanto el conocimiento de la biología de las neoplasias melanocíticas como la evolución de los criterios diagnósticos, especialmente de las lesiones «limítrofes», han podido justificar una parte de las diferencias encontradas entre trabajos. Adicionalmente, existen diferencias metodológicas entre estudios, que implican la posibilidad de sesgos de clasificación. Dada la baja concordancia diagnóstica interobservador en el análisis histopatológico cuando se evalúan las lesiones pigmentadas clínicamente atípicas87 o los melanomas in situ, algunos dermatopatólogos expertos recomiendan considerar solo los casos de MAN invasor88.
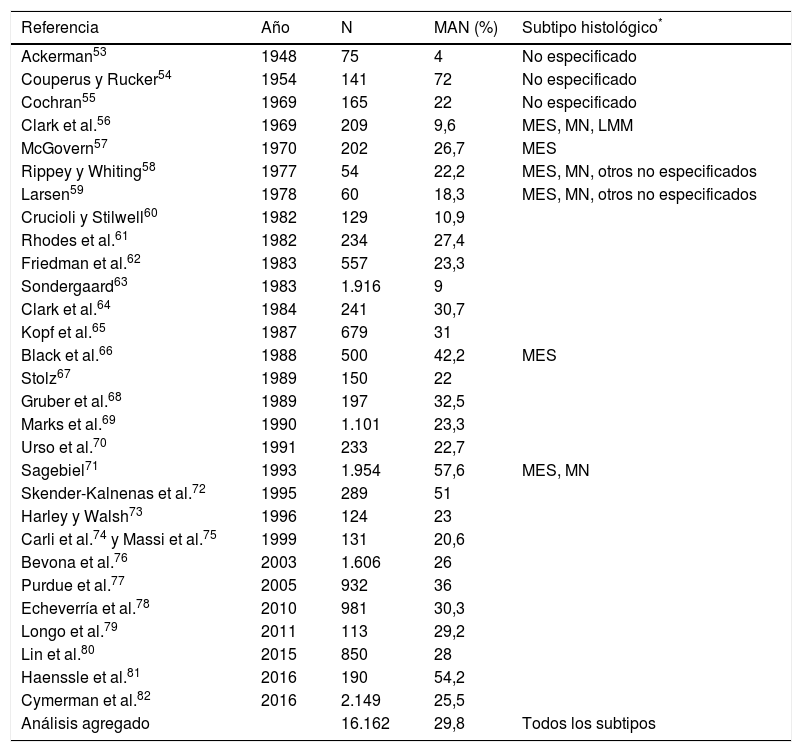
Un metaanálisis publicado en el año 2015 cifró la proporción de MAN en un 36%, incluyendo un total de 10.102 pacientes, y en un 32% si no se consideraban en el análisis aquellos estudios que se limitaban a incluir melanomas de extensión superficial80. Cabe, no obstante, hacer mención a sus limitaciones: incluía en él algunas referencias que no establecían claramente en el texto el número de pacientes con melanoma estudiados y la proporción de los cuales tenía un MAN85,89,90; además, dejaba de incluir varias referencias previas (y, como es lógico, algunas más recientes). Por este motivo, y de cara a definir mejor la proporción estimada de melanomas histológicamente asociados a nevo, hemos llevado a cabo una revisión exhaustiva de la literatura para incluir, además, otros estudios no incluidos en dicho metaanálisis. Se ha hecho siguiendo una metodología similar a la del artículo referenciado80: en la base de datos Pubmed se procedió a una búsqueda empleando los términos melanoma, nevi, precursor y pathology, que encontró un total de 169 referencias (a fecha 7 de febrero de 2017). Se revisaron los resúmenes de todas las referencias y se excluyeron aquellos artículos de revisión y editoriales que no presentaran nuevos datos. También se incluyeron aquellos artículos originales con mención a nevus-associated melanomas en el título o resumen encontrados entre las referencias de estos artículos. Finalmente, se calculó la proporción de MAN entre los 16.162 pacientes publicados en un total de 29 referencias, que queda reflejada en la tabla 2.
Proporción de melanomas asociados histológicamente a nevo en la bibliografía. Estimación de la literatura publicada
| Referencia | Año | N | MAN (%) | Subtipo histológico* |
|---|---|---|---|---|
| Ackerman53 | 1948 | 75 | 4 | No especificado |
| Couperus y Rucker54 | 1954 | 141 | 72 | No especificado |
| Cochran55 | 1969 | 165 | 22 | No especificado |
| Clark et al.56 | 1969 | 209 | 9,6 | MES, MN, LMM |
| McGovern57 | 1970 | 202 | 26,7 | MES |
| Rippey y Whiting58 | 1977 | 54 | 22,2 | MES, MN, otros no especificados |
| Larsen59 | 1978 | 60 | 18,3 | MES, MN, otros no especificados |
| Crucioli y Stilwell60 | 1982 | 129 | 10,9 | |
| Rhodes et al.61 | 1982 | 234 | 27,4 | |
| Friedman et al.62 | 1983 | 557 | 23,3 | |
| Sondergaard63 | 1983 | 1.916 | 9 | |
| Clark et al.64 | 1984 | 241 | 30,7 | |
| Kopf et al.65 | 1987 | 679 | 31 | |
| Black et al.66 | 1988 | 500 | 42,2 | MES |
| Stolz67 | 1989 | 150 | 22 | |
| Gruber et al.68 | 1989 | 197 | 32,5 | |
| Marks et al.69 | 1990 | 1.101 | 23,3 | |
| Urso et al.70 | 1991 | 233 | 22,7 | |
| Sagebiel71 | 1993 | 1.954 | 57,6 | MES, MN |
| Skender-Kalnenas et al.72 | 1995 | 289 | 51 | |
| Harley y Walsh73 | 1996 | 124 | 23 | |
| Carli et al.74 y Massi et al.75 | 1999 | 131 | 20,6 | |
| Bevona et al.76 | 2003 | 1.606 | 26 | |
| Purdue et al.77 | 2005 | 932 | 36 | |
| Echeverría et al.78 | 2010 | 981 | 30,3 | |
| Longo et al.79 | 2011 | 113 | 29,2 | |
| Lin et al.80 | 2015 | 850 | 28 | |
| Haenssle et al.81 | 2016 | 190 | 54,2 | |
| Cymerman et al.82 | 2016 | 2.149 | 25,5 | |
| Análisis agregado | 16.162 | 29,8 | Todos los subtipos |
Año: año de publicación; LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MN: melanoma nodular; N: número de pacientes incluidos.
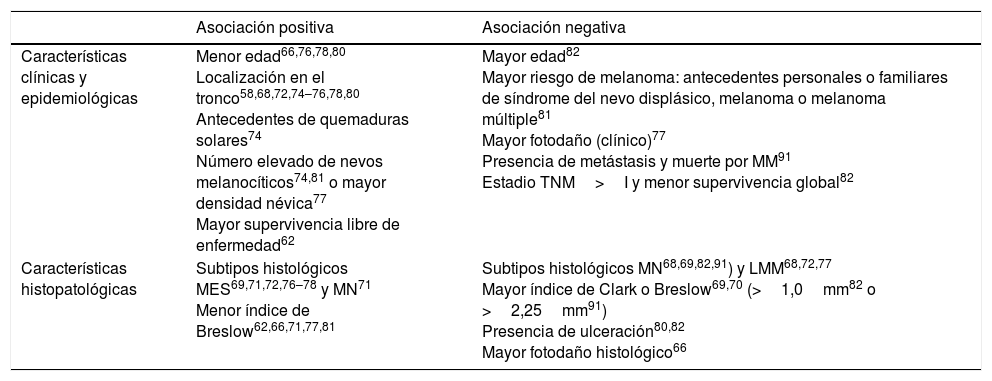
La evidencia actual indica que los MAN, independientemente del tipo de lesión melanocítica benigna sobre los que asienten, se asocian con determinadas características (tabla 3).
Características asociadas a los MAN
| Asociación positiva | Asociación negativa | |
|---|---|---|
| Características clínicas y epidemiológicas | Menor edad66,76,78,80 Localización en el tronco58,68,72,74–76,78,80 Antecedentes de quemaduras solares74 Número elevado de nevos melanocíticos74,81 o mayor densidad névica77 Mayor supervivencia libre de enfermedad62 | Mayor edad82 Mayor riesgo de melanoma: antecedentes personales o familiares de síndrome del nevo displásico, melanoma o melanoma múltiple81 Mayor fotodaño (clínico)77 Presencia de metástasis y muerte por MM91 Estadio TNM>I y menor supervivencia global82 |
| Características histopatológicas | Subtipos histológicos MES69,71,72,76–78 y MN71 Menor índice de Breslow62,66,71,77,81 | Subtipos histológicos MN68,69,82,91) y LMM68,72,77 Mayor índice de Clark o Breslow69,70 (>1,0mm82 o >2,25mm91) Presencia de ulceración80,82 Mayor fotodaño histológico66 |
La asociación histológica de un melanoma con un nevo se vincula a una edad más joven en el diagnóstico66,76,78,80, a la presencia de un número elevado de nevos melanocíticos en el tegumento74,81 (o mayor densidad névica)77 y a antecedentes de quemaduras solares74. Los MAN suelen localizarse principalmente en el tronco y en zonas de exposición solar intermitente58,68,72,74–76,78,80 (ello explica por qué presentan menos frecuentemente signos de daño actínico crónico tanto clínico77 como histológico66). Son fundamentalmente melanomas de extensión superficial69,71,72,76–78 y guardan unas características histológicas de mejor pronóstico (menor Breslow62,66,71,77,81 y ausencia de ulceración80,82).
Estas características de los MAN contrastan con las asociadas a esta entidad si se considera la asociación clínica a nevo previo (en lugar de la evidencia histológica de nevo). Un estudio observó un mayor espesor de Breslow (con 377 pacientes con melanoma, de los cuales el 42% eran melanomas con antecedente clínico de lesión pigmentada previa) cuando la definición de MAN se hizo en función del antecedente clínico, aunque este hallazgo no implicó una peor supervivencia de los MAN84. Sin embargo, otra publicación española siguiendo una metodología similar (incluyendo 165 pacientes con melanoma, de los que el 49% refería un nevo previo) no corroboró esta relación entre el MAN clínico y el espesor83.
Así pues, la asociación histológica de un melanoma con un nevo melanocítico supone, en líneas generales, hallazgos clínicos e histopatológicos más favorables. Si bien la mayor parte de publicaciones específicamente dirigidas a estudiar los pacientes con MAN no han encontrado diferencias significativas en sus tasas de supervivencia al compararlos con los melanomas de novo, hay referencias que apuntan a que estas características de mejor pronóstico estarían vinculadas con una mayor supervivencia. Así, una publicación de 1983 (examinando 557 pacientes con melanoma, de los cuales 130 tenían MAN) constató mayor supervivencia libre de enfermedad entre los pacientes con MAN62. Y, finalmente, otro estudio de 2016 (incluyendo 2 cohortes de 2 períodos temporales de 1.024 y 1.125 pacientes con melanoma, de las cuales 198 —19,3%— y 349 —31,0%—, respectivamente, tenían MAN) puso de manifiesto que los MAN tenían una mejor supervivencia global incluso tras el ajuste con los factores pronósticos clásicos82. Por otra parte, un estudio multicéntrico reciente (sobre 2.184 pacientes con melanoma, sin analizar específicamente los MAN) mostró que los pacientes que tienen múltiples nevos parecen tener una mejor supervivencia específica asociada al melanoma92.
ConclusionesBasándonos en el análisis agregado de las series previamente publicadas, incluyendo un total de 16.162 pacientes, puede afirmarse que cerca de un 30% de los melanomas se encuentran histológicamente asociados a un nevo melanocítico. La asociación histológica de un nevo con un melanoma se ha vinculado con factores pronósticos más favorables. Sin embargo, la mayor parte de artículos previamente publicados no han encontrado diferencias significativas en la supervivencia una vez ajustados para los parámetros pronósticos habituales.
Como se ha abordado, existen no solo diferencias en la proporción numérica de MAN, sino también una baja concordancia entre el diagnóstico clínico e histológico de melanoma asociado a nevo melanocítico previo. Ello podría explicarse por diferentes motivos:
- -
La probable existencia de slow-growing melanomas (melanomas de crecimiento lento) con apariencia clínica benigna93.
- -
El posible comportamiento de algunos melanomas que, en su crecimiento, obliterarían y reemplazarían de forma completa los restos névicos. En línea con referencias previas84, se hipotetiza qué pasaría sobre todo en aquellos tumores de mayor tamaño, lo que implicaría que aquellas series que incluyen melanomas de menor espesor tendrían una proporción mayor de MAN.
- -
La consideración de «proliferación melanocítica atípica» a los márgenes del melanoma en las primeras publicaciones, lo cual explicaría por qué la proporción de MAN es relativamente mayor en series más recientes.
- -
La posibilidad de no encontrar el resto histológico de nevo al no ser frecuente que se realice de rutina un análisis sistemático del 100% de la pieza histológica, además de que puede ocurrir que la orientación de la pieza en el procesamiento pueda no haber incluido la porción névica, lo cual podría causar un infradiagnóstico de MAN.
En cualquier caso, la información disponible actualmente apunta a que los pacientes con MAN padecen estos melanomas con una edad más joven y localizados predominantemente en el tronco, y tienen, además de antecedentes de quemaduras solares, una mayor densidad y número de nevos melanocíticos. Por lo tanto, parece razonable recomendar una especial atención a los cambios en nevo previos en pacientes con múltiples nevos, tal y como ya se hace de manera habitual en las unidades de lesiones pigmentadas en nuestro medio.
Quedan múltiples incógnitas por dilucidar en la biología del melanoma y sus lesiones precursoras, así como de su impacto en la supervivencia. Aunque la mayoría de estudios apuntan a que los MAN tienen un comportamiento menos agresivo, no queda del todo claro si esto es exclusivamente debido a sus características histológicas de mejor pronóstico o a sus características biológicas. Parecen necesarios nuevos trabajos de diseño más específico que aborden este tema para tenerlo en consideración en el seguimiento y tratamiento de los pacientes con melanoma.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.