Omalizumab es un anticuerpo monoclonal recombinante humanizado anti-IgE actualmente aprobado para el tratamiento del asma grave y de la urticaria crónica espontánea refractarios a otros tratamientos. Su empleo en el manejo de las urticarias crónicas inducibles (aquellas que se desencadenan ante determinados estímulos), si bien está contemplado en algunas guías de consenso, sigue siendo un uso «fuera de indicación». El objetivo de esta revisión es reunir los casos y series de casos publicados de este tipo de urticarias tratadas con omalizumab, analizando las características más relevantes y los resultados terapéuticos. Los resultados parecen posicionar a omalizumab como una potencial alternativa eficaz y segura en el tratamiento de algunos casos de urticaria crónica inducible.
Omalizumab is a recombinant humanized monoclonal antibody that inhibits immunoglobulin E. It has been approved for the treatment of severe asthma and chronic spontaneous urticaria refractory to other treatments. Its use in the management of chronic inducible urticaria (a type triggered by certain stimuli) is still considered off-label, although this use has been discussed in some consensus papers. This review brings together case reports and case series describing the use of omalizumab to treat chronic inducible urticaria. We analyze the most important aspects of the cases and the outcomes reported. The results seem to position omalizumab as a potentially effective, safe treatment alternative in some cases of chronic inducible urticaria.
Omalizumab es un anticuerpo monoclonal recombinante humanizado anti-IgE. Ejerce su efecto mediante su unión con la molécula de IgE en la región destinada al receptor de las células diana, reduciendo así la presencia de IgE libre en plasma y disminuyendo de forma indirecta el número de receptores de IgE de alta afinidad del basófilo y del mastocito1,2.
Inicialmente aprobado para tratar el asma bronquial moderada-grave, su uso en el tratamiento de la urticaria crónica espontánea (UCE) ha sido aprobado en 2014 por la U. S. Food and Drug Administration y la European Medicines Agency. En las actuales guías de consenso de la European Academy of Allergology and Clinical Immunology, la Global Allergy and Asthma European Network, el European Dermatology Forum y la World Allergy Organization, omalizumab se incluye como tratamiento de tercera línea de la urticaria crónica en aquellos pacientes sin respuesta a dosis escalada de antihistamínicos3.
En el tratamiento de la UCE ha demostrado una alta eficacia terapéutica con un buen perfil de seguridad. Las reacciones anafilácticas, su efecto adverso más grave, han sido excepcionalmente descritas, existiendo un sistema establecido de vigilancia posterior a su administración para minimizar los riesgos1,4.
El empleo de omalizumab en el tratamiento de la urticaria crónica inducible (UCIn), aquella que aparece en respuesta a determinados estímulos –mayoritariamente físicos–, sigue siendo un empleo «fuera de indicación», pero cada vez hay más casos clínicos publicados en los que se utiliza esta alternativa terapéutica. Los distintos tipos de UCIn se exponen en la tabla 1.
Tipos de urticaria crónica inducible
| UCIn físicas | UCIn no físicas |
|---|---|
| Urticaria crónica por frío Urticaria solar Urticaria por presión retardada Urticaria dermográfica o facticia Urticaria crónica por calor Urticaria vibracional | Urticaria colinérgica Urticaria acuagénica Urticaria por contacto |
UCIn: urticaria crónica inducible.
El objetivo de esta revisión es resumir y analizar las características y los resultados de aquellos casos publicados de UCIn tratados con omalizumab. El análisis se realiza individualizado para cada subtipo de UCIn. La búsqueda de casos se realizó utilizando la base de datos MEDLINE mediante el sistema PubMed y el motor de búsqueda ClinicalKey®. La búsqueda de ensayos clínicos en curso se realizó en ClinicalTrials.gov.
Urticaria crónica por fríoLa urticaria crónica por frío o urticaria a frígore (UCF) aparece tras la exposición de la piel a bajas temperaturas, pudiendo también aparecer tras la ingesta de alimentos fríos5. Constituye aproximadamente un 3% de los casos de urticaria crónica6.
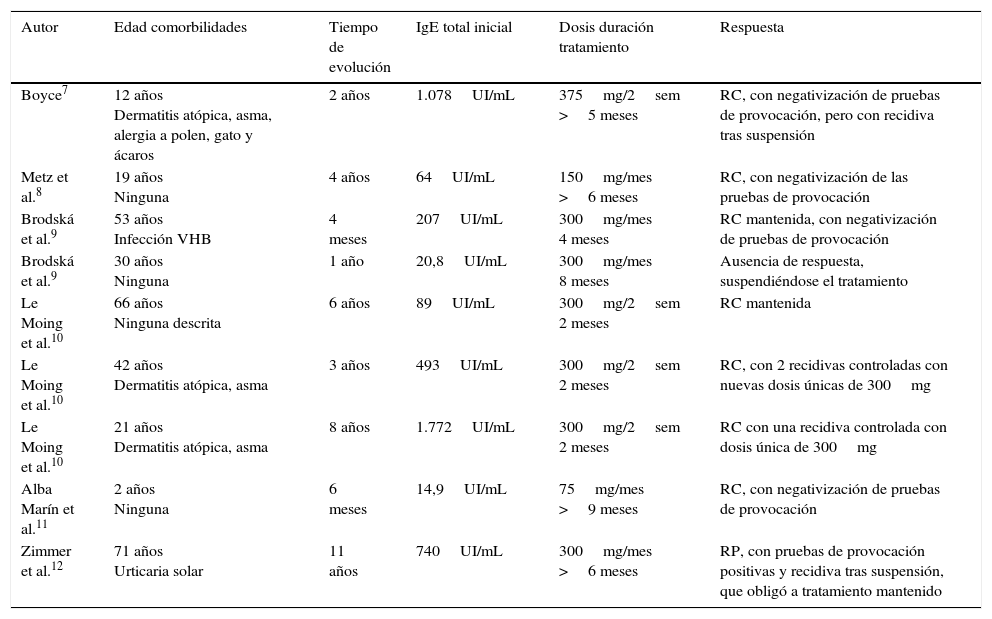
En la tabla 2 aparecen 9 casos publicados de UCF tratados con omalizumab. A estos casos habría que añadir los incluidos en las series de Metz et al.13 y Sussman et al.14, que añaden 5 y 6 casos, respectivamente, con un total de 20 pacientes publicados. De estas series, solo se dispone de datos respecto al tratamiento y la respuesta, salvo por algunos casos aislados presentados previamente por sus autores.
Urticaria crónica por frío tratada con omalizumab
| Autor | Edad comorbilidades | Tiempo de evolución | IgE total inicial | Dosis duración tratamiento | Respuesta |
|---|---|---|---|---|---|
| Boyce7 | 12 años Dermatitis atópica, asma, alergia a polen, gato y ácaros | 2 años | 1.078UI/mL | 375mg/2sem >5 meses | RC, con negativización de pruebas de provocación, pero con recidiva tras suspensión |
| Metz et al.8 | 19 años Ninguna | 4 años | 64UI/mL | 150mg/mes >6 meses | RC, con negativización de las pruebas de provocación |
| Brodská et al.9 | 53 años Infección VHB | 4 meses | 207UI/mL | 300mg/mes 4 meses | RC mantenida, con negativización de pruebas de provocación |
| Brodská et al.9 | 30 años Ninguna | 1 año | 20,8UI/mL | 300mg/mes 8 meses | Ausencia de respuesta, suspendiéndose el tratamiento |
| Le Moing et al.10 | 66 años Ninguna descrita | 6 años | 89UI/mL | 300mg/2sem 2 meses | RC mantenida |
| Le Moing et al.10 | 42 años Dermatitis atópica, asma | 3 años | 493UI/mL | 300mg/2sem 2 meses | RC, con 2 recidivas controladas con nuevas dosis únicas de 300mg |
| Le Moing et al.10 | 21 años Dermatitis atópica, asma | 8 años | 1.772UI/mL | 300mg/2sem 2 meses | RC con una recidiva controlada con dosis única de 300mg |
| Alba Marín et al.11 | 2 años Ninguna | 6 meses | 14,9UI/mL | 75mg/mes >9 meses | RC, con negativización de pruebas de provocación |
| Zimmer et al.12 | 71 años Urticaria solar | 11 años | 740UI/mL | 300mg/mes >6 meses | RP, con pruebas de provocación positivas y recidiva tras suspensión, que obligó a tratamiento mantenido |
RC: respuesta completa; RP: respuesta parcial; VHB: virus de la hepatitis B.
Al analizar los 9 pacientes expuestos en la tabla 2 encontramos que las comorbilidades más frecuentes son el asma y la atopia, sin diferencias aparentes en la posterior respuesta al tratamiento. De igual forma, las cifras de IgE previas al tratamiento son variables y sin una clara correlación con los resultados terapéuticos. Las dosis de omalizumab oscilan entre los 75mg/mes en un paciente pediátrico y los 375mg/2 semanas. El 78% (7/9) presentaron una respuesta completa con resolución de la sintomatología. En aquellos casos con recidiva tras la suspensión del tratamiento se adoptaron 2 actitudes: la administración de nuevas dosis aisladas o la reinstauración pautada del tratamiento; ambas obtuvieron la nueva resolución de los síntomas. Como caso anecdótico se incluye la paciente presentada por Zimmer et al.12, que tenía 2 tipos de UCIn: por frío y solar. En esta paciente, el control de ambos cuadros fue solo parcial, si bien se refiere una importante mejora en su calidad de vida.
En la serie de Metz et al.13, que incluye uno de los pacientes de la tabla 2 publicado previamente, un 50% (3/6) de los casos presentaron una respuesta completa al tratamiento con dosis de omalizumab de 150mg/mes, salvo un paciente, que precisó dosis de 150mg/semana para alcanzar el mismo efecto. En la serie de Sussman et al.14, los 6 pacientes tratados presentaron una respuesta completa, con dosis de 150mg/mes en 4 de ellos y dosis de 300mg/mes en los 2 restantes.
De la totalidad de los casos publicados, un 75% (15/20) presentaron una respuesta completa al tratamiento con omalizumab.
En ninguno de los casos se refieren efectos adversos relevantes. Solo uno de los publicados por Brodská y Schimd-Grendelmeier9 presentó astenia y somnolencia, lo que, asociado a la falta de respuesta, justificó su suspensión.
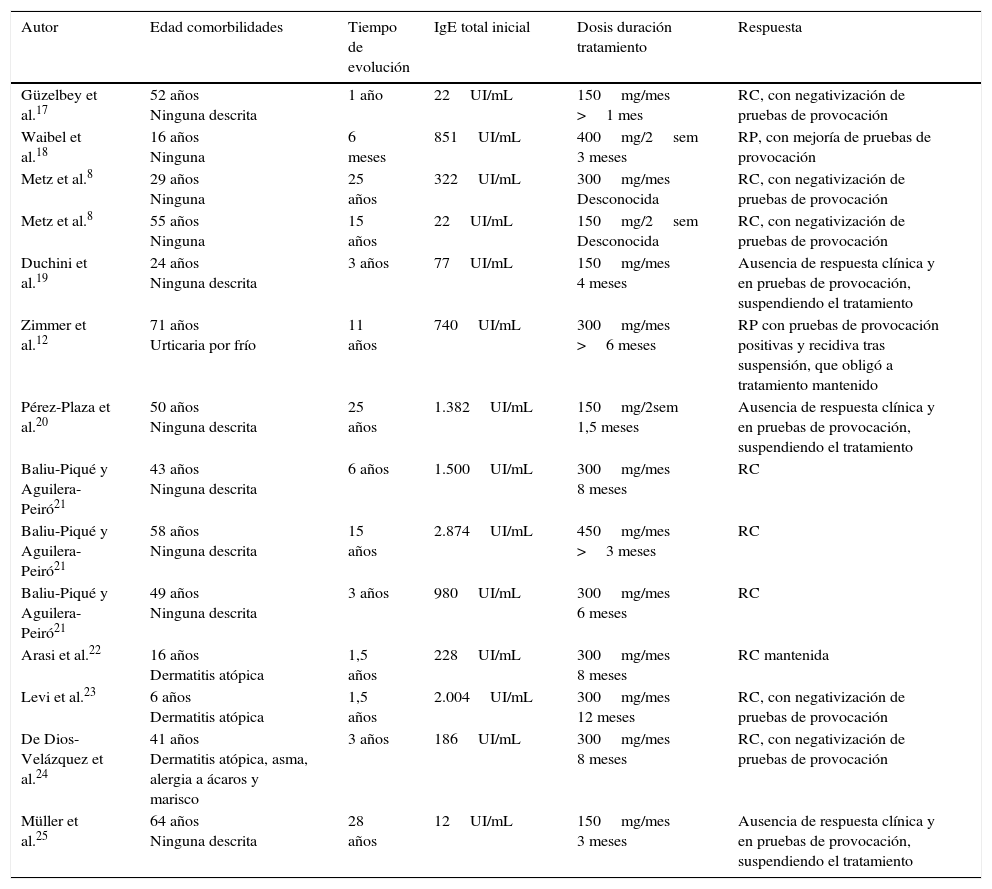
Urticaria solarLa urticaria solar (US) es un proceso poco común caracterizado por la aparición de habones tras la exposición a la radiación solar, luz visible o radiación ultravioleta. Dada la infrecuencia de la enfermedad no se dispone de datos epidemiológicos15,16. En la tabla 3 aparecen los 14 casos publicados de US tratados con omalizumab. A estos casos, de nuevo, habría que añadir 2 más incluidos en la serie de Metz et al.13, de la cual solo se dispone de datos respecto al tratamiento y la respuesta.
Urticaria solar tratada con omalizumab
| Autor | Edad comorbilidades | Tiempo de evolución | IgE total inicial | Dosis duración tratamiento | Respuesta |
|---|---|---|---|---|---|
| Güzelbey et al.17 | 52 años Ninguna descrita | 1 año | 22UI/mL | 150mg/mes >1 mes | RC, con negativización de pruebas de provocación |
| Waibel et al.18 | 16 años Ninguna | 6 meses | 851UI/mL | 400mg/2sem 3 meses | RP, con mejoría de pruebas de provocación |
| Metz et al.8 | 29 años Ninguna | 25 años | 322UI/mL | 300mg/mes Desconocida | RC, con negativización de pruebas de provocación |
| Metz et al.8 | 55 años Ninguna | 15 años | 22UI/mL | 150mg/2sem Desconocida | RC, con negativización de pruebas de provocación |
| Duchini et al.19 | 24 años Ninguna descrita | 3 años | 77UI/mL | 150mg/mes 4 meses | Ausencia de respuesta clínica y en pruebas de provocación, suspendiendo el tratamiento |
| Zimmer et al.12 | 71 años Urticaria por frío | 11 años | 740UI/mL | 300mg/mes >6 meses | RP con pruebas de provocación positivas y recidiva tras suspensión, que obligó a tratamiento mantenido |
| Pérez-Plaza et al.20 | 50 años Ninguna descrita | 25 años | 1.382UI/mL | 150mg/2sem 1,5 meses | Ausencia de respuesta clínica y en pruebas de provocación, suspendiendo el tratamiento |
| Baliu-Piqué y Aguilera-Peiró21 | 43 años Ninguna descrita | 6 años | 1.500UI/mL | 300mg/mes 8 meses | RC |
| Baliu-Piqué y Aguilera-Peiró21 | 58 años Ninguna descrita | 15 años | 2.874UI/mL | 450mg/mes >3 meses | RC |
| Baliu-Piqué y Aguilera-Peiró21 | 49 años Ninguna descrita | 3 años | 980UI/mL | 300mg/mes 6 meses | RC |
| Arasi et al.22 | 16 años Dermatitis atópica | 1,5 años | 228UI/mL | 300mg/mes 8 meses | RC mantenida |
| Levi et al.23 | 6 años Dermatitis atópica | 1,5 años | 2.004UI/mL | 300mg/mes 12 meses | RC, con negativización de pruebas de provocación |
| De Dios-Velázquez et al.24 | 41 años Dermatitis atópica, asma, alergia a ácaros y marisco | 3 años | 186UI/mL | 300mg/mes 8 meses | RC, con negativización de pruebas de provocación |
| Müller et al.25 | 64 años Ninguna descrita | 28 años | 12UI/mL | 150mg/mes 3 meses | Ausencia de respuesta clínica y en pruebas de provocación, suspendiendo el tratamiento |
RC: respuesta completa; RP: respuesta parcial.
En los 14 pacientes expuestos encontramos que la comorbilidad más frecuente, de la misma manera que en otros tipos de UCIn, es la atopia, sin diferencias aparentes en la posterior respuesta al tratamiento. Sin embargo, respecto a las cifras de IgE basales y a pesar de ser variables, parece existir una tendencia en cuanto a una mayor respuesta en pacientes con cifras de IgE basales elevadas, respondiendo de forma completa un 63% (5/8) en este subgrupo. Las dosis de omalizumab oscilan entre los 150 y los 800mg/mes. El 64% (9/14) de los pacientes presentaron una respuesta completa con resolución de la sintomatología. Se mantuvo el tratamiento en 8 de ellos, siendo descrita por Metz et al.8 la recidiva de los síntomas en uno de sus casos al suspender el tratamiento, lo que propició la reinstauración del mismo con nuevo control total. El 14% (2/14) presentaron una respuesta parcial y el 21% (3/14) una ausencia total de respuesta al tratamiento. Destaca, de nuevo, la paciente presentada por Zimmer et al.12, con 2 tipos de UCIn: por frío y solar, y en la que el control de ambos cuadros fue solo parcial.
Por otro lado, los 2 pacientes añadidos por la serie de Metz et al.13 presentaron una respuesta completa uno y una respuesta parcial el otro.
De la totalidad de los casos publicados, un 62,5% (10/16) presentaron una respuesta completa al tratamiento con omalizumab, sin referirse ningún efecto adverso importante. Destaca, además, su uso con seguridad en 2 pacientes en edad pediátrica, de 6 y 16 años, a dosis de 300mg/mes, con respuesta completa en ambos y un tercero, de 16 años, con respuesta parcial.
Recientemente, Aubin et al.26 han publicado un estudio en fase ii en el que se trató con omalizumab (300mg/mes durante 2 meses; 3 dosis en total) a 10 pacientes con US estudiados mediante fototest y fotoprovocación (espectros de acción: ultravioleta A, B y espectro solar policromático). La variable principal fue la proporción de pacientes con control de las lesiones de US tras la provocación con una dosis de radiación ultravioleta 10 veces mayor que la dosis urticarial mínima basal a la semana 12 de tratamiento. Aproximadamente un 40% presentó mejoría clínica inicial, pero los resultados de eficacia según la variable principal no fueron estadísticamente significativos. No obstante, el estudio tiene las limitaciones derivadas de la ausencia de un grupo placebo y del pequeño número de pacientes incluidos.
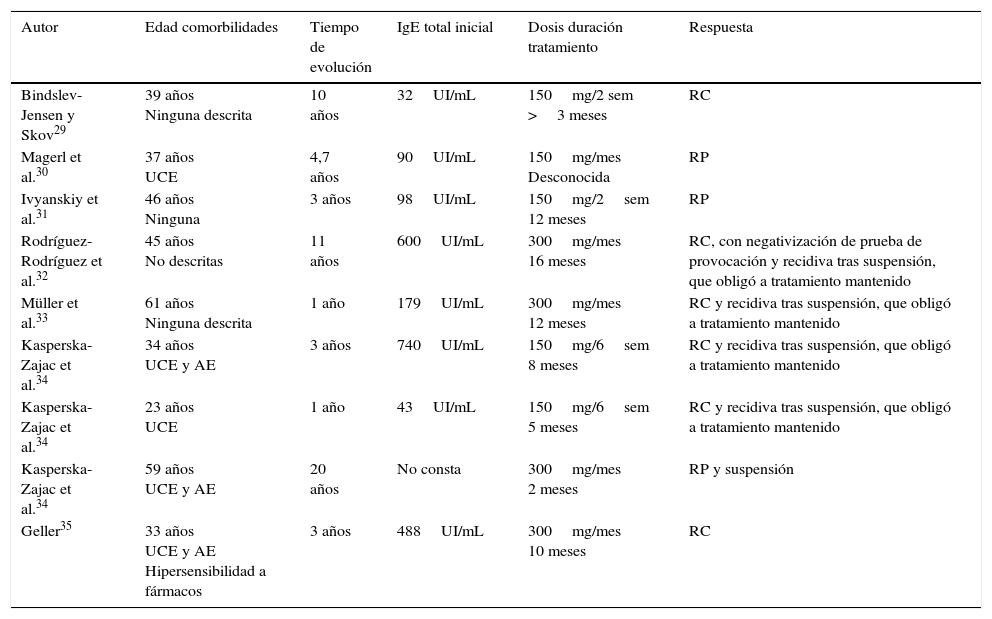
Urticaria por presión retardadaLa urticaria por presión retardada es una urticaria inducible rara, cuyas lesiones aparecen típicamente entre 4 y 6h después de aplicar una presión variable sobre la piel, como al permanecer sentado o usar ropa apretada. Hasta en el 37% de los casos puede asociarse a UCE, aunque en ocasiones pase desapercibida dado su inicio retardado27,28. En la tabla 4 aparecen los 9 casos publicados de urticaria por presión retardada tratados con omalizumab. A estos casos, de nuevo, habría que añadir 8 incluidos en la serie de Metz et al.13, de la cual solo se dispone de datos parciales.
Urticaria por presión retardada tratada con omalizumab
| Autor | Edad comorbilidades | Tiempo de evolución | IgE total inicial | Dosis duración tratamiento | Respuesta |
|---|---|---|---|---|---|
| Bindslev-Jensen y Skov29 | 39 años Ninguna descrita | 10 años | 32UI/mL | 150mg/2 sem >3 meses | RC |
| Magerl et al.30 | 37 años UCE | 4,7 años | 90UI/mL | 150mg/mes Desconocida | RP |
| Ivyanskiy et al.31 | 46 años Ninguna | 3 años | 98UI/mL | 150mg/2sem 12 meses | RP |
| Rodríguez-Rodríguez et al.32 | 45 años No descritas | 11 años | 600UI/mL | 300mg/mes 16 meses | RC, con negativización de prueba de provocación y recidiva tras suspensión, que obligó a tratamiento mantenido |
| Müller et al.33 | 61 años Ninguna descrita | 1 año | 179UI/mL | 300mg/mes 12 meses | RC y recidiva tras suspensión, que obligó a tratamiento mantenido |
| Kasperska-Zajac et al.34 | 34 años UCE y AE | 3 años | 740UI/mL | 150mg/6sem 8 meses | RC y recidiva tras suspensión, que obligó a tratamiento mantenido |
| Kasperska-Zajac et al.34 | 23 años UCE | 1 año | 43UI/mL | 150mg/6sem 5 meses | RC y recidiva tras suspensión, que obligó a tratamiento mantenido |
| Kasperska-Zajac et al.34 | 59 años UCE y AE | 20 años | No consta | 300mg/mes 2 meses | RP y suspensión |
| Geller35 | 33 años UCE y AE Hipersensibilidad a fármacos | 3 años | 488UI/mL | 300mg/mes 10 meses | RC |
AE: angioedema; RC: respuesta completa; RP: respuesta parcial; UCE: urticaria crónica espontánea.
Respecto a los pacientes expuestos en la tabla 4, encontramos que la comorbilidad más frecuente, de manera superior a lo descrito en la literatura, es la UCE con o sin angioedema, que presentaban un 55% (5/9) de los pacientes, sin diferencias aparentes en la posterior respuesta al tratamiento; y, de nuevo, las cifras de IgE previas al tratamiento son muy variables y tampoco muestran correlación con la respuesta terapéutica. Destaca el caso descrito por Müller et al.33 al presentar una forma de urticaria ampollosa. Las dosis de omalizumab oscilan entre los 150mg/6 semanas y los 300mg/mes, siendo inferiores a las utilizadas en otros tipos de UCIn. El 67% (6/9) de los pacientes presentaron una respuesta completa con resolución de la sintomatología, refiriéndose en casi todos ellos una mejoría completa en solo 48h tras la primera inyección. En el caso de los pacientes de Kasperska-Zajac et al.34, se espaciaron las dosis de omalizumab hasta la reaparición de la clínica, dada la rapidez del efecto, optimizando así el tratamiento.
Por otro lado, los 8 pacientes de la serie de Metz et al.13 presentaron un 88% (7/8) de respuesta completa sin disponerse de más datos.
De la totalidad de casos publicados, un 76% (13/17) presentaron una respuesta completa y un 24%(4/17) una respuesta parcial al tratamiento con omalizumab, sin referirse ningún caso de ausencia total de respuesta ni ningún efecto adverso importante.
Urticaria dermográficaLa urticaria dermográfica, también denominada dermografismo sintomático o urticaria facticia, es una UCIn física poco frecuente, caracterizada por la aparición de habones pruriginosos al frotar o rascar la piel36.
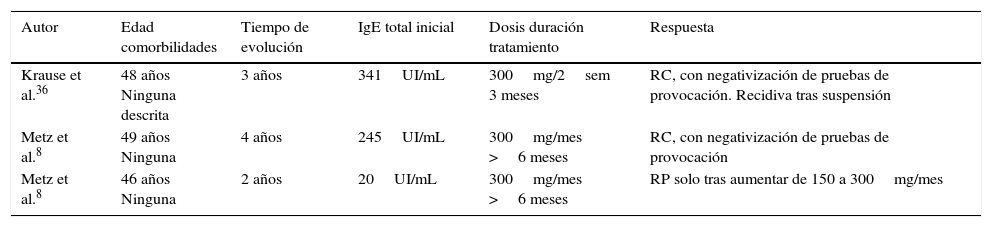
En la tabla 5 se muestran las características de los 3 casos tratados con omalizumab publicados individualmente. En los 3 pacientes expuestos, hay un 66% (2/3) con respuesta completa. El paciente restante presentó una respuesta parcial y solo tras el incremento de la dosis inicial. Curiosamente, este paciente era el único con una IgE basal no elevada8. Las dosis empleadas fueron 300mg cada 2 o 4 semanas. No se describen efectos adversos.
Urticaria dermográfica tratada con omalizumab
| Autor | Edad comorbilidades | Tiempo de evolución | IgE total inicial | Dosis duración tratamiento | Respuesta |
|---|---|---|---|---|---|
| Krause et al.36 | 48 años Ninguna descrita | 3 años | 341UI/mL | 300mg/2sem 3 meses | RC, con negativización de pruebas de provocación. Recidiva tras suspensión |
| Metz et al.8 | 49 años Ninguna | 4 años | 245UI/mL | 300mg/mes >6 meses | RC, con negativización de pruebas de provocación |
| Metz et al.8 | 46 años Ninguna | 2 años | 20UI/mL | 300mg/mes >6 meses | RP solo tras aumentar de 150 a 300mg/mes |
RC: respuesta completa; RP: respuesta parcial.
A los 2 casos descritos por Metz et al.8 hay que añadir 5 pacientes publicados en la serie del mismo autor13 (los primeros también se incluyen en los resultados finales de dicha serie). Estos 5 casos presentaron todos una respuesta completa.
En resumen, del total de pacientes con urticaria dermográfica un 87,5% (7/8) presentó una respuesta completa al tratamiento, un paciente presentó respuesta parcial y no hay casos publicados de fracaso terapéutico.
Urticaria crónica por calorLa urticaria crónica por calor es una UCIn física rara y de difícil manejo, que se desencadena por la aplicación local de calor en distintas formas: agua caliente, objetos calientes o exposición al calor solar (zonas expuestas y no expuestas) o artificial37.
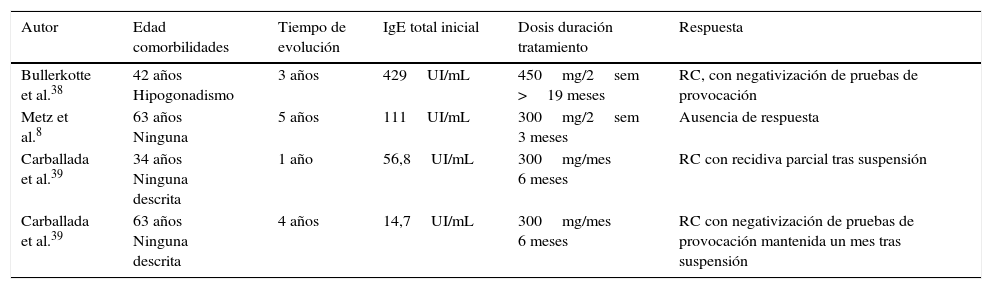
En la tabla 6 se exponen los 4 únicos casos publicados de urticaria crónica por calor tratada con omalizumab. El 75% (3/4) presentaron una respuesta completa. El paciente restante no presentó ninguna mejoría, salvo por un discreto aumento (2°C) en la temperatura aplicada necesaria para obtener un test de provocación positivo8. Los pacientes no presentaban en este caso comorbilidades destacables, reseñándose solo un caso de hipogonadismo asociado, sin relevancia clínica para los autores38. Las cifras basales de IgE no parecen tener relación con la respuesta. Las dosis de omalizumab empleadas oscilan entre 300mg/mes y 450mg/2 semanas. De nuevo, no se describen efectos adversos relevantes.
Urticaria crónica por calor tratada con omalizumab
| Autor | Edad comorbilidades | Tiempo de evolución | IgE total inicial | Dosis duración tratamiento | Respuesta |
|---|---|---|---|---|---|
| Bullerkotte et al.38 | 42 años Hipogonadismo | 3 años | 429UI/mL | 450mg/2sem >19 meses | RC, con negativización de pruebas de provocación |
| Metz et al.8 | 63 años Ninguna | 5 años | 111UI/mL | 300mg/2sem 3 meses | Ausencia de respuesta |
| Carballada et al.39 | 34 años Ninguna descrita | 1 año | 56,8UI/mL | 300mg/mes 6 meses | RC con recidiva parcial tras suspensión |
| Carballada et al.39 | 63 años Ninguna descrita | 4 años | 14,7UI/mL | 300mg/mes 6 meses | RC con negativización de pruebas de provocación mantenida un mes tras suspensión |
RC: respuesta completa; RP: respuesta parcial.
La urticaria por vibración es una de las UCIn físicas menos frecuentes. Se caracteriza por la aparición de habones o angioedema tras la exposición a estímulos vibratorios. Desencadenantes típicos son correr, montar en motocicleta, emplear maquinaria (taladros, etc.) e incluso tocar determinados instrumentos musicales. Solo se encuentra un caso publicado de urticaria por vibración tratado con omalizumab. Se trata de una mujer de 36 años con sintomatología de 20 años de evolución, sin comorbilidades referidas y con una IgE basal de 13UI/mL. Tras realizar tratamiento durante 3 meses con omalizumab 300mg/mes no presentó ninguna mejoría clínica. Sin embargo, experimentó una respuesta parcial tanto clínica como en pruebas de provocación (apoyo del antebrazo sobre un mezclador de vórtice durante intervalos progresivos) tras iniciar tratamiento con ketotifeno. No se describen efectos adversos en toda la evolución40.
Urticaria colinérgicaLa urticaria colinérgica es una UCIn considerada no física, causada por el aumento de la temperatura corporal, ya sea por el ejercicio físico, la exposición a un ambiente caluroso o el estrés emocional. Constituye aproximadamente el 5% de las urticarias crónicas41.
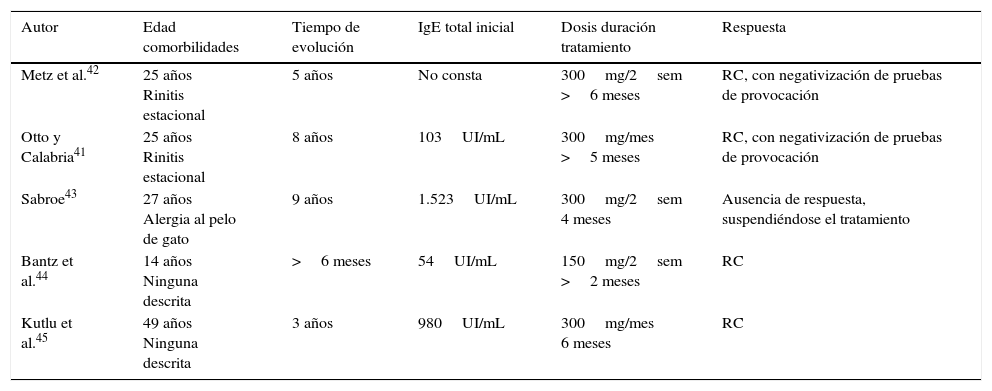
En la tabla 7 se resumen las características de los 5 casos publicados individualmente en la literatura de pacientes con urticaria colinérgica tratados con omalizumab. Siguiendo el patrón de otras urticarias inducibles, las comorbilidades predominantes eran de tipo alérgico (rinitis estacional, alergia a pelo de gato) y las cifras de IgE libre basal eran muy variables, ambos parámetros sin aparente influencia sobre el resultado del tratamiento. El 80% (4/5) de los pacientes tratados con omalizumab presentaron una respuesta completa, con fracaso terapéutico en solo uno de ellos. Las dosis empleadas oscilaban entre los 300mg/cada 2 o 4 semanas.
Urticaria colinérgica tratada con omalizumab
| Autor | Edad comorbilidades | Tiempo de evolución | IgE total inicial | Dosis duración tratamiento | Respuesta |
|---|---|---|---|---|---|
| Metz et al.42 | 25 años Rinitis estacional | 5 años | No consta | 300mg/2sem >6 meses | RC, con negativización de pruebas de provocación |
| Otto y Calabria41 | 25 años Rinitis estacional | 8 años | 103UI/mL | 300mg/mes >5 meses | RC, con negativización de pruebas de provocación |
| Sabroe43 | 27 años Alergia al pelo de gato | 9 años | 1.523UI/mL | 300mg/2sem 4 meses | Ausencia de respuesta, suspendiéndose el tratamiento |
| Bantz et al.44 | 14 años Ninguna descrita | >6 meses | 54UI/mL | 150mg/2sem >2 meses | RC |
| Kutlu et al.45 | 49 años Ninguna descrita | 3 años | 980UI/mL | 300mg/mes 6 meses | RC |
RC: respuesta completa; RP: respuesta parcial.
La serie publicada por Metz et al.13 añade 7 casos, de los cuales 4 presentaron una respuesta completa, uno parcial y 2 no presentaron ninguna mejoría.
En resumen, del total de pacientes con urticaria colinérgica tratados con omalizumab, un 67% (8/12) presentó una respuesta completa al tratamiento sin efectos adversos relevantes referidos.
Urticaria acuagénicaLa urticaria acuagénica es una forma infrecuente de UCIn no física. Sus síntomas aparecen tras la exposición al agua, independientemente de su temperatura. Generalmente, no se relaciona con la ingesta de agua. Probablemente debido a la baja prevalencia de esta afección, solo encontramos un caso publicado de urticaria acuagénica tratado con omalizumab. Se trata de una paciente de 34 años, sin comorbilidades, con una historia de esta dolencia de 2 años de evolución, que presentó resolución completa de la sintomatología tras 2 meses de tratamiento a dosis de 300mg/4 semanas. No se dispone de las cifras previas de IgE en sangre y no se describen efectos adversos46.
DiscusiónEn los últimos años hemos asistido a la ampliación en las indicaciones de omalizumab, un anticuerpo monoclonal anti-IgE, incluyendo su reciente aprobación para el tratamiento de la UCE. En relación con el tratamiento de la UCIn, varios autores han defendido el posible efecto terapéutico de este fármaco basándose en un hipotético papel de la IgE en la patogenia de este tipo de urticaria o en la acción del mismo sobre la inmunidad celular1,8.
Actualmente, solo disponemos de casos aislados y pequeñas series de casos como material publicado para conocer los resultados y las características del tratamiento de la UCIn con omalizumab. Esto plantea serias limitaciones, al poder existir un sesgo de selección en los casos publicados.
Otra limitación fundamental es la falta de parámetros de respuesta objetivos que permitan homogeneizar el análisis del efecto terapéutico. De hecho, hasta hace poco tiempo, y al contrario de lo que ocurría en la UCE, en el seguimiento de la UCIn no existían instrumentos de evaluación clínica como el UAS o el UAS7. En 2014, Weller et al.47 diseñaron un cuestionario, el Urticaria Control Test, adaptado transculturalmente al castellano48, que permite, junto con la determinación de umbrales, un seguimiento clínico y una monitorización del control de la enfermedad más adecuados49,50. Sin embargo, estas herramientas no se emplearon en la gran mayoría de los artículos revisados, lo que supone una limitación en el análisis de las respuestas clínicas.
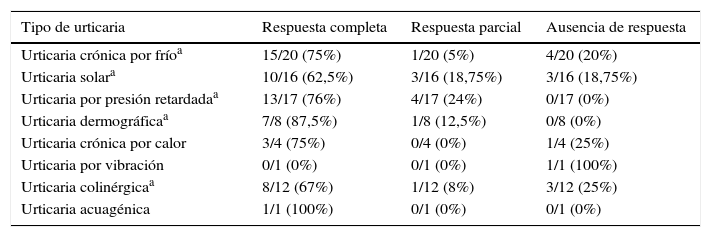
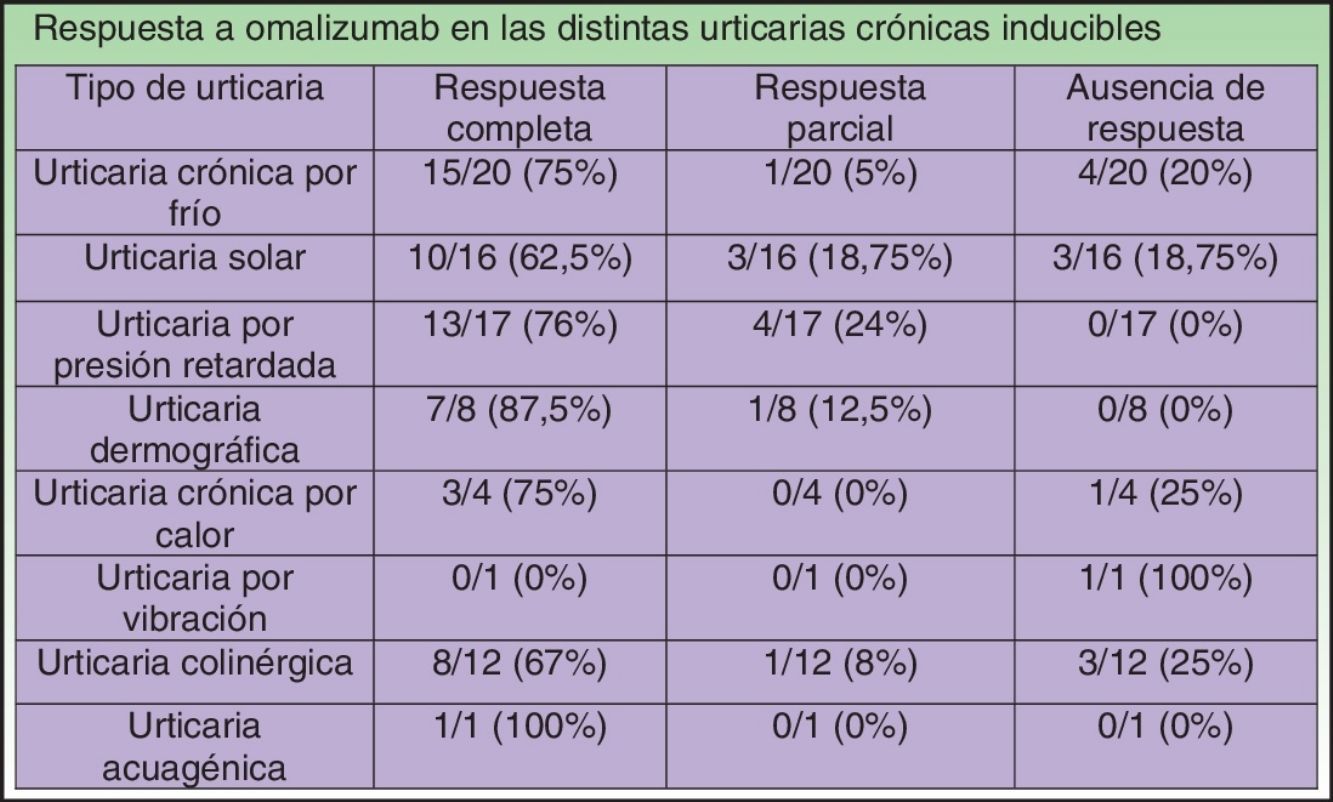
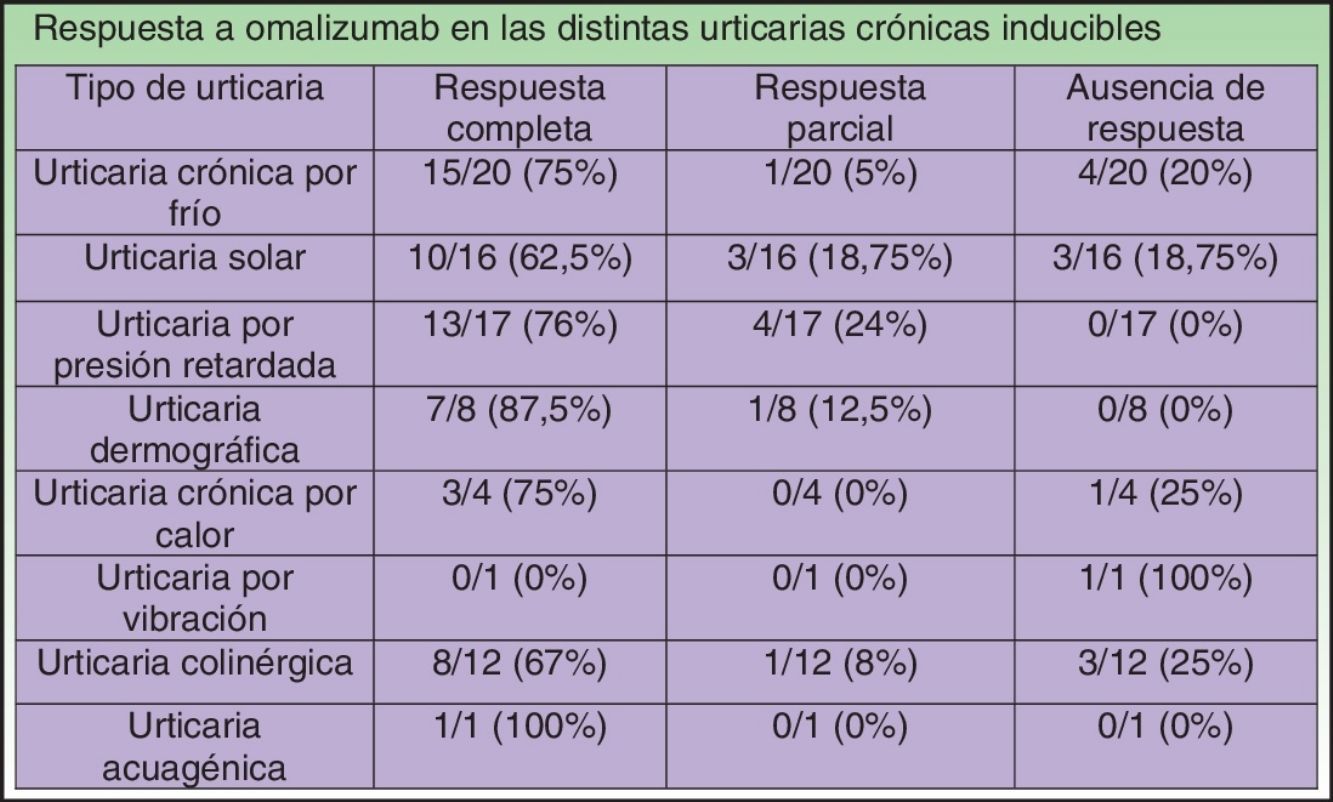
En nuestra revisión, y como ya ocurría en alguna de las series de casos incluidas13, los pacientes que más parecen beneficiarse de este tratamiento son aquellos que padecen urticaria dermográfica o urticaria por presión retardada, con un 87,5 y un 76%, respectivamente, de respuestas completas al tratamiento y sin casos de ausencia de este. El peor resultado, que corresponde a los casos de US, no deja de ser prometedor, con un 62,5% de respuestas completas. En la tabla 8 se resumen las respuestas al tratamiento con omalizumab en las distintos tipos de UCIn.
Respuesta a omalizumab en las distintas urticarias crónicas inducibles
| Tipo de urticaria | Respuesta completa | Respuesta parcial | Ausencia de respuesta |
|---|---|---|---|
| Urticaria crónica por fríoa | 15/20 (75%) | 1/20 (5%) | 4/20 (20%) |
| Urticaria solara | 10/16 (62,5%) | 3/16 (18,75%) | 3/16 (18,75%) |
| Urticaria por presión retardadaa | 13/17 (76%) | 4/17 (24%) | 0/17 (0%) |
| Urticaria dermográficaa | 7/8 (87,5%) | 1/8 (12,5%) | 0/8 (0%) |
| Urticaria crónica por calor | 3/4 (75%) | 0/4 (0%) | 1/4 (25%) |
| Urticaria por vibración | 0/1 (0%) | 0/1 (0%) | 1/1 (100%) |
| Urticaria colinérgicaa | 8/12 (67%) | 1/12 (8%) | 3/12 (25%) |
| Urticaria acuagénica | 1/1 (100%) | 0/1 (0%) | 0/1 (0%) |
Por otra parte, en los casos revisados parece que las cifras de IgE total basal, al contrario de lo que ocurre en el tratamiento del asma, no tienen relación con la respuesta al tratamiento y, de hecho, se objetivan respuestas completas de igual forma en pacientes con cifras de IgE normales o elevadas. Este hecho ya fue destacado por Metz et al.13 y parece respaldado por nuestra revisión. Como ya se ha comentado, solo en el caso de la US parece encontrarse una tendencia a la mayor eficacia terapéutica cuando las cifras de IgE están elevadas.
En relación con la dosificación empleada, las pautas son, por lo general, muy variables en todos los subtipos de UCIn. La posología empleada, en ocasiones sigue los esquemas establecidos en el tratamiento del asma (dependiente de IgE y peso) y, en otros casos, se decide de forma empírica o basándose en las recomendaciones para la UCE. Como señalan Francés et al.1, la dosis óptima probablemente se encuentre entre 150-300mg/2-4 semanas.
Respecto a la duración del tratamiento, es imposible por el momento recomendar una pauta concreta debido a la gran variabilidad entre los casos y los factores externos condicionantes en estos, al ser tratamientos «fuera de indicación». No obstante, basándonos en nuestra revisión y en otro análisis retrospectivo que también incluía pacientes con UCE51, la reintroducción de omalizumab en pacientes que respondieron inicialmente parece segura y mantiene la eficacia.
Es importante destacar la ausencia de efectos adversos relevantes en la totalidad de los casos, encontrando únicamente un caso cuya paciente con UCF refería, como ya hemos reseñado, astenia y somnolencia9.
En un futuro cercano, probablemente tendremos mucha más información respecto a resultados del tratamiento con omalizumab en este tipo de urticarias, ya que actualmente hay en curso distintos ensayos clínicos: CUN-OMAL-UCOL52, CUTEX53 y UFO54, dirigidos a estudiar omalizumab en el tratamiento de urticaria colinérgica, UCF y urticaria dermográfica, respectivamente. De hecho, recientemente se ha publicado un estudio en fase ii referente a la US, como ya se ha comentado al hablar de este tipo de urticaria26. La publicación de estas investigaciones tal vez nos permita establecer de una forma más concreta indicaciones, dosis y duración del tratamiento.
Por el momento, omalizumab se posiciona como una potencial alternativa terapéutica, eficaz y segura, en tercera línea del tratamiento de la UCIn, de igual forma que ya se ha establecido en la UCE.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos Dres. Chicharro y Rodríguez declaran no tener ningún conflicto de intereses. El Dr. de Argila ha sido Clinical Advisor y ha participado en ensayos clínicos promovidos por Novartis.