La carbamazepina (CBZ) es un derivado tricíclico de iminostilbeno comercializado en 1962 para el tratamiento de la neuralgia del trigémino y, años más tarde, como antiepiléptico y como un pilar del tratamiento del trastorno bipolar. En 19671 se describieron por primera vez los efectos secundarios cutáneos asociados al uso de este fármaco. En 1982 se publicaron los tres primeros casos de necrólisis epidérmica tóxica relacionados con su uso2 y en 19853 el primer caso de eccema exfoliativo, estudiado mediante pruebas epicutáneas. Desde el inicio del uso del fármaco se han descrito distintas formas de toxicidad cutánea aunque, sin embargo, hasta la fecha no se ha descrito ningún caso de queratodermia adquirida.
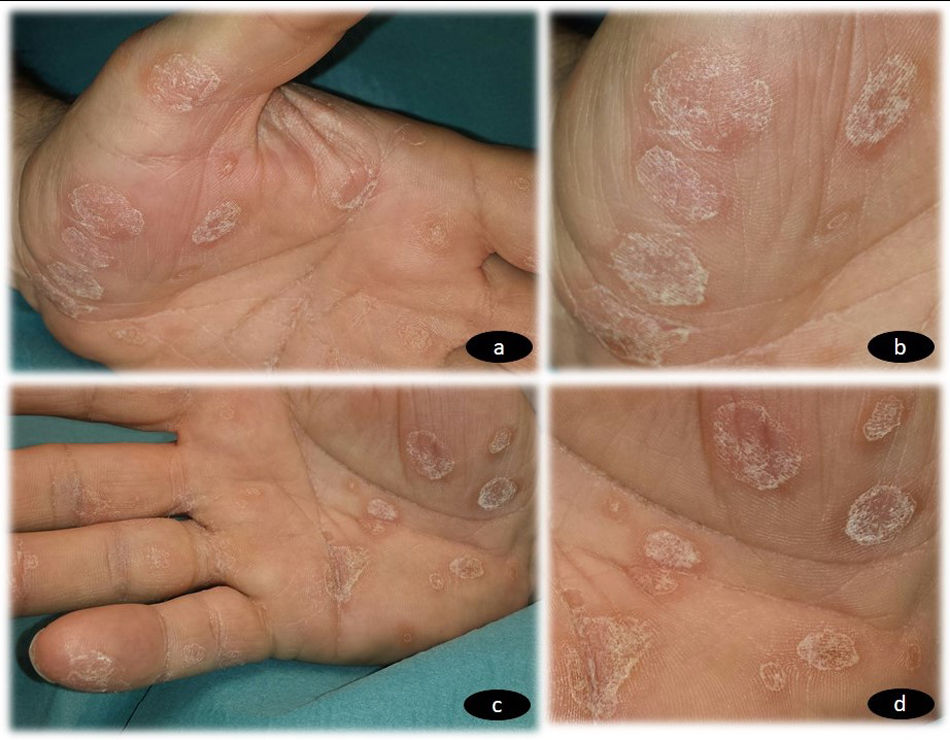
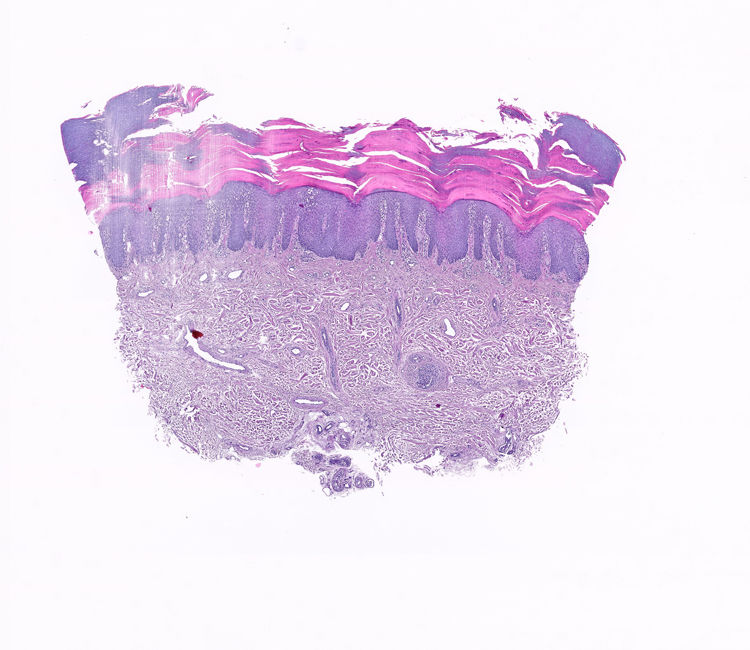
Un varón de 65 años, sin antecedentes personales ni familiares de interés, fue evaluado en nuestra consulta por la aparición progresiva de unas lesiones en ambas palmas de las manos, dos semanas después de iniciar el tratamiento con CBZ a una dosis de 200mg cada 12 horas para una neuralgia del trigémino, de reciente diagnóstico en el Servicio de Neurología. En la exploración física se observó la presencia de unas placas hiperqueratósicas multifocales en ambas manos (fig. 1a-d), asintomáticas, de bordes bien delimitados y no confluyentes. No se observó afectación de mucosas ni de plantas de pies. Los exámenes complementarios realizados, incluyendo hemograma, bioquímica general, reactantes de fase aguda (PCR, VSG) y serología de sífilis, mostraron resultados dentro de la normalidad. No refería procesos vacunales recientes. El estudio histopatológico (fig. 2) fue compatible con queratodermia sin proceso inflamatorio asociado. Se suspendió el fármaco y se cambió por otro de diferente clase terapéutica para el control de su patología neurológica. Las lesiones cutáneas se trataron con emolientes tópicos. La revisión a las 4 semanas mostró un aclaramiento completo de las lesiones.
a) Placas hiperqueratósicas multifocales no confluyentes en palma de mano izquierda. b) Múltiples placas hiperqueratósicas de bordes bien definidos en palma de mano izquierda. c) Placas hiperqueratósicas multifocales no confluyentes en palma de mano derecha. d) Múltiples placas hiperqueratósicas de bordes bien definidos en palma de mano derecha.
Se han descrito en la literatura diferentes formas de toxicidad cutánea relacionada con la CBZ. Se han observado cuadros de menor gravedad como erupciones liquenoides4, lesiones micosis fungoide-like5, dermatosis ampollosa lineal IgA6, pustulosis exantemática generalizada aguda7, liquen plano8, hidradenitis neutrofílica ecrina9, eritema multiforme10, vasculitis11, así como toxicidades cutáneas más graves como necrólisis epidérmica tóxica y síndrome de Steven-Johnson12 o síndrome DRESS13. Hasta la fecha no hemos encontrado en la literatura ningún caso de queratodermia secundaria a su uso.
Recientemente han aparecido varios trabajos que describen los efectos adversos cutáneos por CBZ y su relación con el HLA14,15. Se ha comunicado la asociación entre los alelos HLA-B (B∗15:02 y B58:01) y el exantema maculopapular que provoca. Además, los alelos HLA-B∗15:02 y HLA-B∗15:21 han mostrado una asociación intensa con el síndrome de Stevens Johnson y la necrólisis epidérmica tóxica por CBZ, mientras que el DRESS inducido por CBZ ha mostrado una asociación significativa con el alelo HLA-B∗58:01.
En estudios más recientes también se han proporcionado datos sobre los factores genéticos que predisponen a diferentes fenotipos de reacciones adversas frente a CBZ con una importante fisiopatología inmunitaria. La CBZ provoca reacciones de hipersensibilidad mediadas por células T (CBZ-HR) que incluyen reacciones adversas cutáneas graves (SCAR) y daño hepático (CBZ-DILI) asociadas a HLA-A*31:0116.
La queratodermia comprende un amplio grupo de dermatosis que pueden ser congénitas o adquiridas. Para diferenciar ambos grupos debe tenerse en cuenta la edad de presentación de las lesiones, así como antecedentes familiares positivos que hagan sospechar su componente hereditario. Respecto a las de origen adquirido, la iatrogenia medicamentosa es la causa más frecuente incluyendo verapamilo, litio, venlafaxina, o quinacrina, entre otros. No debemos olvidar asimismo su expresión como manifestación paraneoplásica del cáncer de pulmón, mama, vejiga, o de origen digestivo (tripe palms).
El tratamiento de las queratodermias adquiridas secundarias a fármacos requieren en primer lugar suspender (siempre que sea posible) el fármaco sospechoso. En aquellos pacientes cuya queratodermia sea sintomática o afecte a la calidad de vida del paciente, la indicación de queratolíticos tópicos, retinoides orales o fototerapia, pueden favorecer y acelerar la resolución de las lesiones hiperqueratósicas.
Es importante recordar que aquellos pacientes que van a ser tratados con carbamazepina pueden desarrollar un cuadro de hipersensibilidad al fármaco. Para evitar esta toxicidad grave del fármaco, se recomienda el cribado de HLA-B1502, HLA-B∗58:01 y HLA-A31:01 antes de iniciar el tratamiento, principalmente en aquellos pacientes de ascendencia asiática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.