En la actualidad existe una amplia variedad de tratamientos para el cáncer cutáneo no melanoma (CCNM), como son 5-fluorouracilo, mebutato de ingenol, imiquimod, diclofenaco, terapia fotodinámica (TFD), metotrexato, cetuximab, vismodegib, radioterapia, todos ellos con altas tasas de respuesta clínica e histológica. Sin embargo, algunos tumores no responden al tratamiento, debido a la aparición de resistencias, tanto primarias como adquiridas. El estudio de los procesos de resistencia es un campo extenso de investigación que conlleva ampliar los conocimientos de la naturaleza de cada tumor, las características biológicas que lo hacen resistente y el diseño de nuevas terapias dirigidas contra los mismos. En el presente artículo se revisan las resistencias a los tratamientos tópicos autorizados para el CCNM.
A wide range of treatments is now available for nonmelanoma skin cancer (NMSC), including 5-fluorouracil, ingenol mebutate, imiquimod, diclofenac, photodynamic therapy, methotrexate, cetuximab, vismodegib, and radiotherapy. All are associated with high clinical and histologic response rates. However, some tumors do not respond due to resistance, which may be primary or acquired. Study of the resistance processes is a broad area of research that aims to increase our understanding of the nature of each tumor and the biologic features that make it resistant, as well as to facilitate the design of new therapies directed against these tumors. In this article we review resistance to the authorized topical treatments for NMSC.
Actualmente disponemos de un gran abanico de tratamientos para el cáncer cutáneo no melanoma (CCNM), incluyendo las queratosis actínicas (QA). Esto es importante dado que hay situaciones en las que la cirugía presenta ciertas limitaciones, como cuando estéticamente no es una buena opción o el paciente presenta un número elevado de tumores y/o un área extensa a tratar. En los últimos años, las opciones terapéuticas han aumentado a expensas de los quimioterápicos, obteniéndose altas tasas de respuestas completas. Además, dentro de las ventajas de estas nuevas modalidades de tratamiento destacan la no invasividad, el excelente resultado cosmético, la posibilidad de combinar el tratamiento y de repetirlo. Entre las diversas alternativas no quirúrgicas disponibles en la actualidad para los distintos tipos de CCNM se encuentran los retinoides, el 5-fluorouracilo, el diclofenaco, el imiquimod o la terapia fotodinámica, entre otros (tabla 1)1-13.
Indicaciones de los diferentes tratamientos disponibles para el CCNM, dentro de ficha técnica y en otras patologías fuera de ficha
| Imiquimod 5%1,2 | 5-Fluorouracilo1,3,4 | Gel de diclofenaco tópico al 3% y ácido hialurónico al 2,5%1,5 | Mebutato de ingenol1,6,7 | Terapia fotodinámica1,8 | Vismodegib1,9 | Cetuximab10-11 | QMT intralesionales12-13 | |
|---|---|---|---|---|---|---|---|---|
| Ficha técnica | QA clínicamente típicas, no hiperqueratósicas y no hipertróficas de la cara y cuero cabelludo en pacientes adultos inmunocompetentes | QA hiperquerato¿sica (grado I/II) ligeramente palpable y/o de un grosor moderado en pacientes adultos inmunocompetentes (a la concentración de 5mg de fluorouracilo y 100mg de ácido salici¿lico) QA múltiples a la concentración del 5% | QA | QA no hiperquerato¿sica y no hipertro¿fica en adultos | QA | |||
| CBCs | CBCs | CBCs CBC nodular | CBC metastásico sintomático CBC localmente avanzado y no candidatos para cirugi¿a o radioterapia | |||||
| EB | ||||||||
| Otras patologías | QA en otras localizaciones y en pacientes IMND CBC nodular EB Queratoacantoma Enfermedad de Paget Eritroplasia de Queyrat CCE | EB | EB | CBCs EB | CCE Queratoacantoma Eritroplasia de Queyrat Enfermedad de Paget Síndrome de Gorlin | Síndrome de Gorlin | CCE localmente avanzado, irresecable o metastásico CBC irresecables en monoterapia o asociados a inhibidores de Smo para disminuir sus resistencias | Metotrexato: queratoacantoma, CCE Bleomicina: QA, CBCs y EB Interferon alfa-2, -2a, y -2b: CBC, CEC, y QA Interferon beta and gamma: CBC |
CBC: carcinoma basocelular; CBCs: carcinoma basocelular superficial; CEC: carcinoma de células escamosas; EB: enfermedad de Bowen; INMD: inmunosuprimidos; QA: queratosis actínica; QMT: quimioterapia.
Sin embargo, la efectividad de estas terapias se ve limitada por la resistencia a las mismas. La resistencia de las células tumorales se define como la falta de sensibilidad a tratamientos anticancerígenos, siendo sus causas complejas y multifactoriales. La resistencia a terapias es la principal causa de que los tratamientos no sean efectivos y contribuye, en gran medida, a la progresión tumoral y al mal pronóstico clínico. Aunque lejos de ser entendido, el fenómeno de resistencia ha sido ampliamente estudiado en quimioterapia y radioterapia. Por lo general, el primer tratamiento que se aplica destruye la mayoría de las células tumorales, pero si los tumores no responden adecuadamente a la terapia, se mantienen células cancerosas resistentes que podrían incrementar su agresividad después de varios ciclos de tratamiento14.
En general, la resistencia se puede dividir en 2 tipos: a) intrínseca, en la que preexisten factores que condicionan la respuesta en las células tumorales antes de recibir el tratamiento, y b) adquirida, que se desarrolla como consecuencia del tratamiento en tumores inicialmente sensibles. La resistencia intrínseca surge de una compleja gama de características bioquímicas y moleculares del tumor, que favorece que ciertas células puedan escapar a la muerte. La resistencia adquirida puede ser causada por diferentes factores, incluyendo la cantidad limitada de fármaco o radiación que alcanza el tumor, los que afectan al entorno del mismo, así como potenciales mutaciones en las células tumorales que surgirían durante el tratamiento15.
Deben considerarse también otras respuestas adaptativas, tales como un aumento en la expresión de la diana terapéutica, o la activación de vías de señalización alternativas compensatorias. Asimismo, por lo general, un tumor tras el tratamiento, no se hace resistente únicamente a dicha terapia, sino que puede desarrollar resistencia cruzada a otras, como ocurre en la resistencia a múltiples drogas. A lo anterior, es necesario añadir que los tumores pueden poseer alto grado de heterogeneidad, por lo que en un mismo tumor podemos encontrar células con diferentes características fenoti¿picas, genéticas y/o epigenéticas, lo que implicaría diferentes grados de sensibilidad a una determinada terapia según la zona del tumor16-18.
A continuación, realizamos una revisión de las resistencias encontradas en los tratamientos no quirúrgicos para el CCNM, a través de casos publicados aislados y series de casos, así como de las investigaciones realizadas sobre sus mecanismos. El estudio del proceso de resistencia nos permite conocer mejor la biología del propio tumor y la posibilidad de establecer combinaciones que mejoren la eficacia y reduzcan los efectos adversos19.
En este primer artículo se han revisado los diferentes mecanismos de resistencia que se han publicado tras los tratamientos tópicos disponibles para CCNM: 5-fluorouracilo (5-FU), imiquimod, diclofenaco e ingenol mebutato.
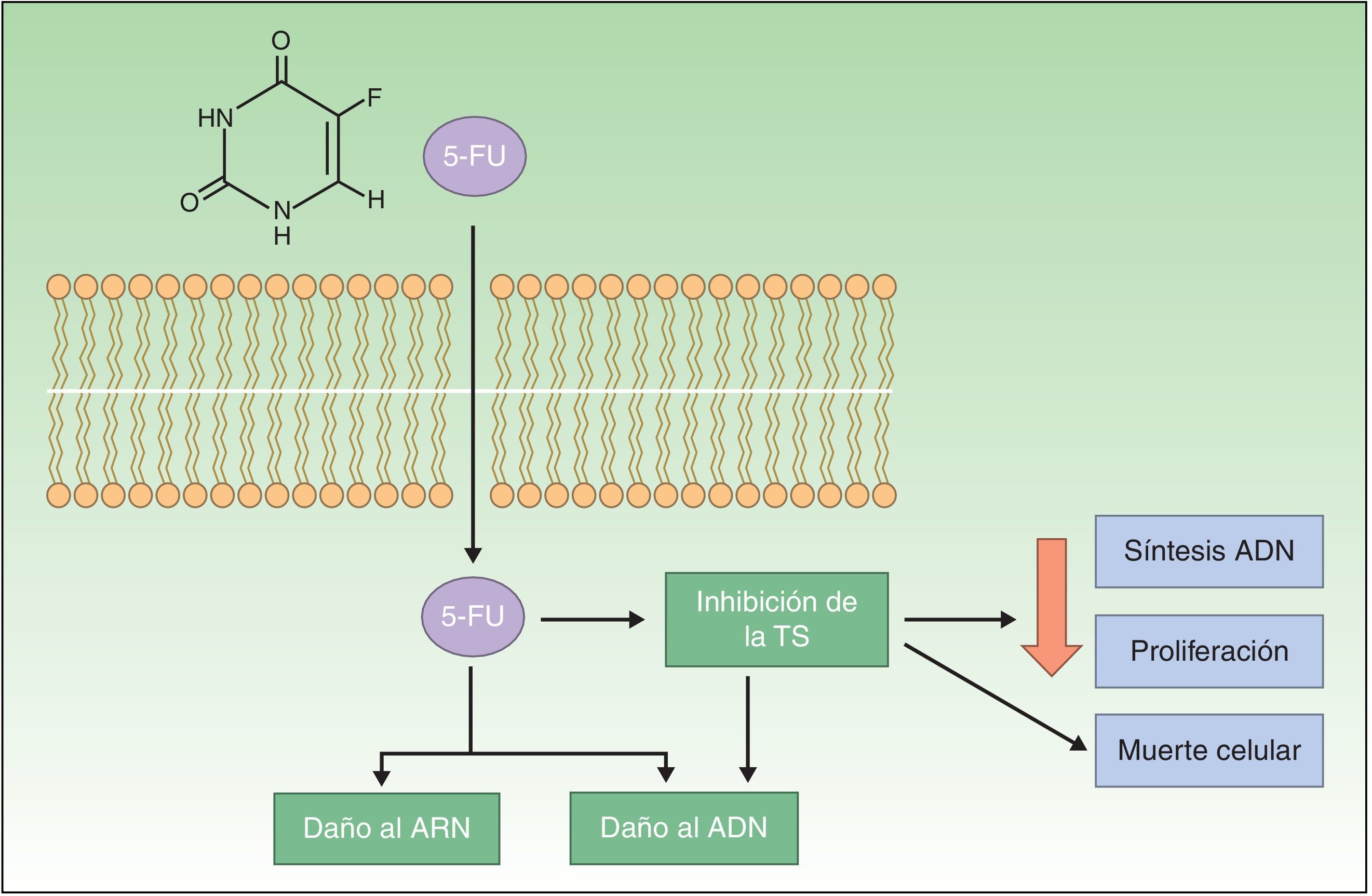
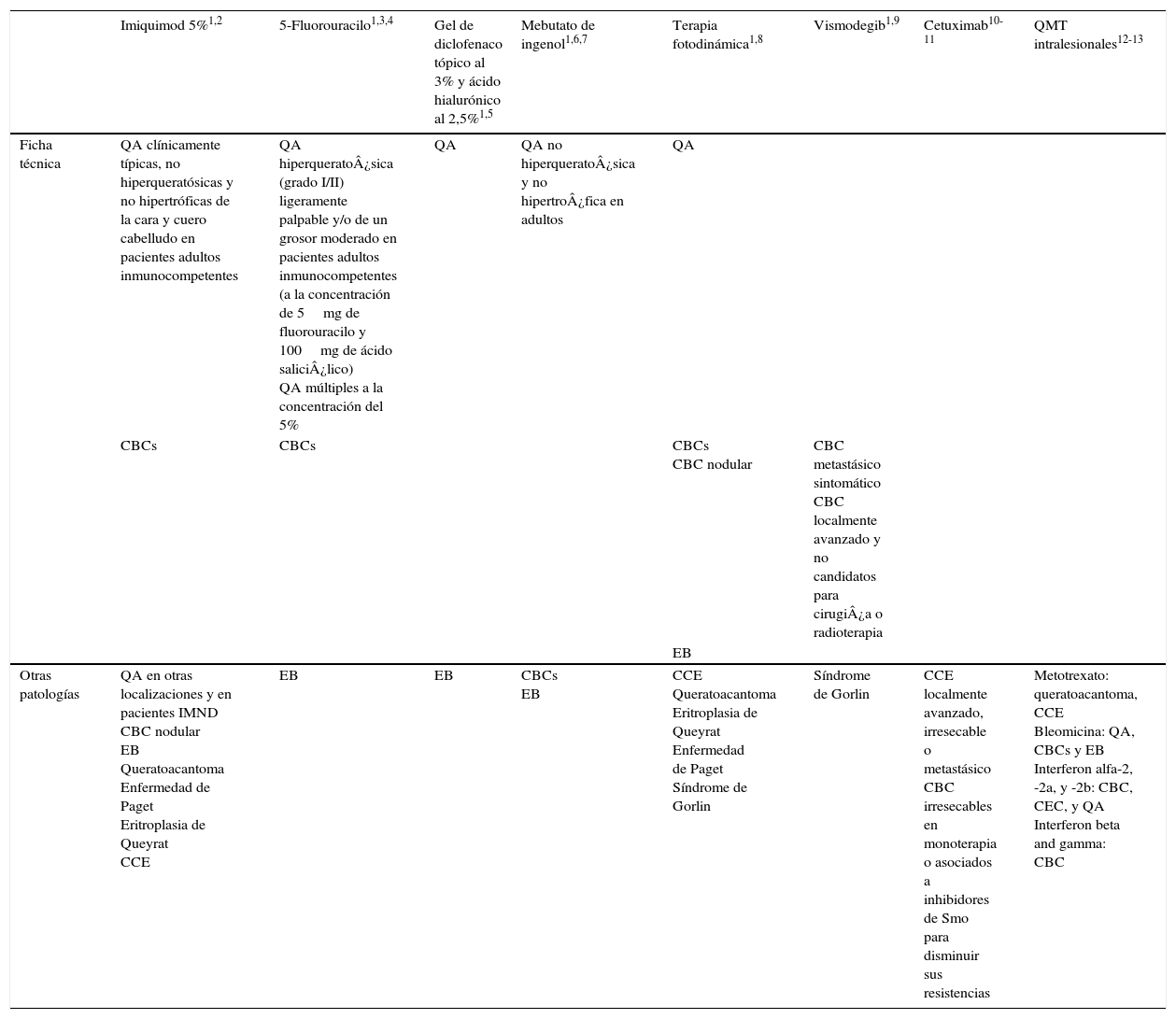
Resistencia a 5-fluorouraciloEl 5-FU es una fluoropirimidina que actúa como un antimetabolito uniéndose a la enzima timidilato sintasa, encargada de la síntesis de nucleótidos. Como resultado, la enzima es inhibida y se produce una reducción en la síntesis de ADN y en la proliferación celular, y se induce la muerte celular. Estos efectos son particularmente evidentes en células con altos índices mitóticos, como en el caso de las células neoplásicas. Esta molécula también es incorporada al ADN o al ARN, inhibiendo su funcionamiento normal (fig. 1)20-22.
El 5-FU tópico está aprobado a concentraciones de 0,5, 1, 2 y 5% para el tratamiento de las QA. En el caso del carcinoma basocelular (CBC) superficial está aprobado a una concentración del 5%, aplicándose 2 veces al día un mínimo de 6 semanas, con una tasa aproximada de curación del 93%. Sin embargo, no está indicado para el tratamiento de la enfermedad de Bowen (EB)22-24.
El 5-FU está aprobado para el tratamiento de CBC superficial. En la serie más larga que respalda su eficacia se observó que la aplicación de 5-FU tópico en 31 CBC superficiales, 2 veces al día durante 11 semanas, obtuvo tasas de curación histológica del 90% a las 3 semanas. Aunque no se realizó un seguimiento a largo plazo, se pudo comprobar que existe una resistencia al tratamiento del 10% de los casos23,25. La eficacia en los CBC nodulares es mucho menor, ya que pocos casos han mostrado un resultado exitoso26.
En el caso de las QA, se tratan durante 2-4 semanas, con una tasa de mejoría clínica del 96% y una tasa de eliminación histológica del 67% cuando el 5-FU se utiliza al 5%. No obstante, se ha descrito una frecuencia de recurrencia del 54% pasado un año de tratamiento27.
A pesar de no estar aprobado para el tratamiento de los carcinomas de células escamosas (CCE), hay algunos estudios realizados al respecto. En uno de ellos se aplicó 5-FU en crema (Efudix®) a 29 pacientes con CCE in situ durante 4 semanas, una vez al día durante la primera semana y 2 veces al día las restantes, obteniéndose una remisión total a los 3 meses del último tratamiento en el 83% de los casos. Tras 12 meses, ya solo el 69% mantenían una curación completa, siendo la tasa de recurrencia de la lesión del 17%28. Otro estudio, realizado sobre 26 casos de EB tratados con 5-FU 5% 2 veces al día hasta 9 semanas, mostró que el 92% de los pacientes presentó una curación completa, con un seguimiento medio de 55 meses26.
Considerando, por tanto, todo lo expuesto, es evidente que numerosas lesiones de CCNM resisten al tratamiento. Es fundamental entender los mecanismos por los que este agente causa la muerte celular y por los que los tumores no responden al mismo, para predecir y superar esa resistencia20.
En uno de los estudios anteriormente citados, se describió un paciente con una deficiencia grave de dihidropirimidina deshidrogenasa (DPD), la primera enzima involucrada en la degradación del 5-FU, que fue tratado con una dosis estándar para CBC, y que desarrolló toxicidad gastrointestinal y hematológica grave. Se ha demostrado que aproximadamente un 10% del 5-FU tópico se absorbe, y más del 80% del 5-FU es inactivado en el hígado por esta enzima, provocando su déficit toxicidad. En el caso de cáncer colorrectal, las personas con cifras bajas de esta enzima presentan mejores respuestas, por lo que un motivo de resistencia al 5-FU podrían ser las alteraciones y polimorfismos en la enzima DPD29.
Por otro lado, se ha observado que la expresión de la proteína Bag-1 está aumentada en el CCE oral asociado a la progresión y metástasis. Esta proteína tiene una función antiapoptótica asociada a la proteína de shock térmico de 70KDa o Hsp70, por lo que un aumento de la expresión de ambas proteínas incrementaría la resistencia a la apoptosis de las células tumorales30. De la misma manera, se ha descrito que la eliminación de Bag-1 en la línea celular de CCE cutáneo SCC-13 sensibilizaba las células a la apoptosis inducida por 5-FU. En este mismo estudio se comprobó la sobrecoexpresión de Bag-1 y Hsp70 en una serie de tumores, lo que les llevó a hipotetizar una resistencia en el CCE a 5-FU a través de un mecanismo citoplasmático dependiente de Hsp7031.
Por último, existe una teoría sobre las células madre cancerígenas en tumores de origen epitelial. Según esta teoría, en el tumor maligno, al igual que en la epidermis normal, existirían unas «células madre» responsables de proliferar y dar lugar a las células tumorales más diferenciadas, que formarían el bulk, o lo que es lo mismo, la masa del tumor. Estas células madre cancerígenas, al igual que las células madre normales, se caracterizan por su ciclo lento. De esta forma, se considera que podrían ser las células responsables de resistencia a los tratamientos quimioterápicos clásicos que afectan sobre todo a las células en proliferación, provocando la resistencia a los mismos32.
Punto clave: variaciones y polimorfismos en la enzima DPD y mayor expresión de Bag-1 y Hsp-70 son factores que podrían influir en la sensibilidad al tratamiento con 5-FU.
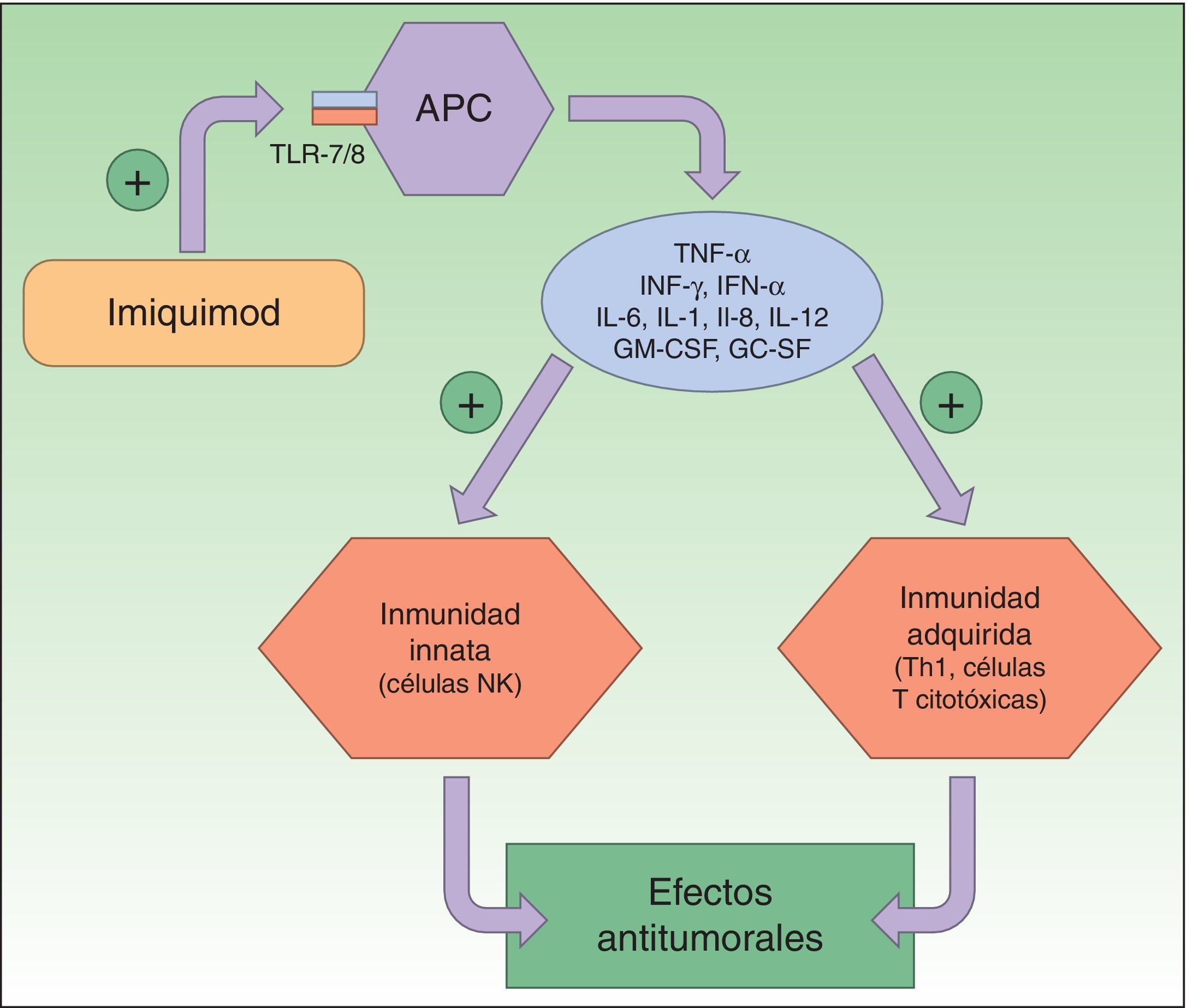
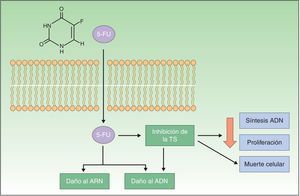
Resistencia a imiquimodImiquimod (IQ) es un compuesto sintético perteneciente a la familia de las imidazoquinolinas que actúa como inmunomodulador estimulando la respuesta inmune innata y la adquirida. La modificación de la respuesta inmune tiene lugar a través de la vía de los receptores tipo Toll 7 y 8 (Toll-like receptor [TLR]), localizados en la superficie de las células presentadoras de antígeno (antigen-presenting cells [APC]), como células dendríticas, macrófagos, células de Langerhans, etc. La activación de estas vías desencadena la producción y liberación de numerosas citoquinas y quimioquinas, el factor de necrosis tumoral α (tumor necrosis factor [TNF]), interferón γ (IFN), determinadas interleucinas (IL) o el factor estimulante de colonias de granulocitos y macrófagos, y la atracción de células natural killer (NK). Así, se produce la estimulación de la respuesta inmune innata y adquirida (fig. 2). Estas características confieren a IQ una potente actividad antiviral y antitumoral, que ha propiciado su aplicación en el campo de la dermatología, particularmente en lesiones cutáneas de carácter maligno2,26,33-37.
Mecanismo de acción de imiquimod; se sabe que actúa bloqueando el receptor Toll-like 7 y 8, lo que conlleva la secreción de citoquinas proinflamatorias y antimicrobianas que provoca tanto la estimulación de la inmunidad innata como de la adquirida, con efectos antitumorales.
APC: antigen-presenting cells; Células NK: células natural killer; Células Th1: células T helper; IL: interleucinas; INF: interferón; GC SF: factor estimulante de colonias de granulocitos; GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; TLR: Toll-like receptor; TNF: tumor necrosis factor.
Numerosos estudios han mostrado que IQ también posee propiedades antiangiogénicas, inhibiendo el crecimiento de nuevos vasos sanguíneos. Particularmente, induce un incremento en los niveles de IL-10 e IL-12 que inhiben la angiogénesis, reducen la producción celular de factores proangiogénicos (como el fibroblast growth factor [FGF] o IL-8), inhiben la motilidad vascular e inducen la apoptosis de células endoteliales26. Además, existen evidencias de que IQ induce la apoptosis de queratinocitos promoviendo la liberación del citocromo c y la activación de la caspasa 338.
Imiquimod 5% en crema está aprobado por la Food and Drug Administration (FDA) en EE.UU. y por la European Medicines Agency (EMA) en Europa para el tratamiento de verrugas genitales externas, CBC superficiales y QA33,39. Se aplica entre 3 y 5 veces por semana durante 4-16 semanas, dependiendo de si se usa para tratar QA o CBC40.
IQ también se ha utilizado para tratar otros tipos de CCNM, incluyendo la EB, la papulosis bowenoide, la enfermedad de Paget extramamaria, el melanoma in situ y el queratoacantoma, entre otros38.
Habitualmente, en el tratamiento de lesiones cutáneas, se obtienen mejores resultados mediante técnicas quirúrgicas que mediante tratamiento tópico, por lo que IQ se utiliza mayoritariamente en pacientes que no pueden ser sometidos a cirugía33.
Gupta et al.41 llevaron a cabo un metaanálisis de 4 estudios (393 pacientes) para evaluar la eficacia de IQ 5% en QA, describiendo que esta era del 70+12%. En un estudio posterior con 479 pacientes, se evaluó también su eficacia, pero utilizando el producto al 2,5 y 3,75%, una vez al día durante 2 periodos de 2 semanas cada uno, separados por 2 semanas sin tratamiento. Tras 8 semanas de seguimiento, la tasa de respuesta completa y parcial fue de 30,6 y 48,1% con IQ al 2,5%, y de 35,6 y 59,4% con IQ al 3,5%, respectivamente42.
Waalboer-Spuij et al.37 realizaron un ensayo clínico con 118 pacientes a los que se les aplicó IQ 5% una vez al día 3 días por semana durante un mes. En el 58% de los casos fue necesario administrar otro ciclo de un mes por falta de respuesta. A las 16 semanas de seguimiento, la tasa de respuesta completa y parcial fue del 46 y 35%, respectivamente.
Dado que no está aprobado, se sabe muy poco sobre la eficacia de IQ en CCE. En un estudio en el que realizaban curetaje y después aplicaban IQ, se obtuvo una tasa de respuesta del 95% a las 12 semanas43. Sin embargo, en otro trabajo en el que solo aplicaban IQ durante 9-12 semanas, se obtuvo una respuesta del 71% en CCE y del 57-80% en EB40.
Por el contrario, existen numerosas publicaciones sobre la aplicación de IQ al 5% en CBCs, con distintos regímenes de aplicación; desde 2 veces al día a 2 a la semana, y revisiones postratamiento de 1 a 5 años, con un rango de tasa de curación entre un 42 y un 100%, siendo lo más efectivo la aplicación del compuesto 2 veces al día. La mayoría de casos de recidivas se dan entre el primer y segundo año tras el tratamiento44-45.
En el caso del CBC nodular, las tasas de curación son inferiores, siendo del 85,6% al año del tratamiento, aplicándolo una vez al día durante 12 semanas46.
Sobre los mecanismos de resistencia que pueden afectar la efectividad del IQ se ha estudiado el gen del receptor TLR 7, localizado en el cromosoma X. Piaserico et al.47 estudiaron en 34 CBC (28 respondedores vs. 6 no respondedores) que la presencia del alelo T para el polimorfismo rs179008 / Gln11Leu en el gen promotor del TLR 7 constituye un probable factor de resistencia a la terapia IQ. Respecto a este polimorfismo, se ha demostrado que los varones hemicigotos que lo presentaban tenían niveles más bajos de TNF-α después de la estimulación con IQ48.
Punto clave: determinados polimorfismos en el gen promotor receptor TLR 7 pueden provocar resistencia a IQ, siendo la disminución del TNF-α uno de los posibles mecanismos implicados.
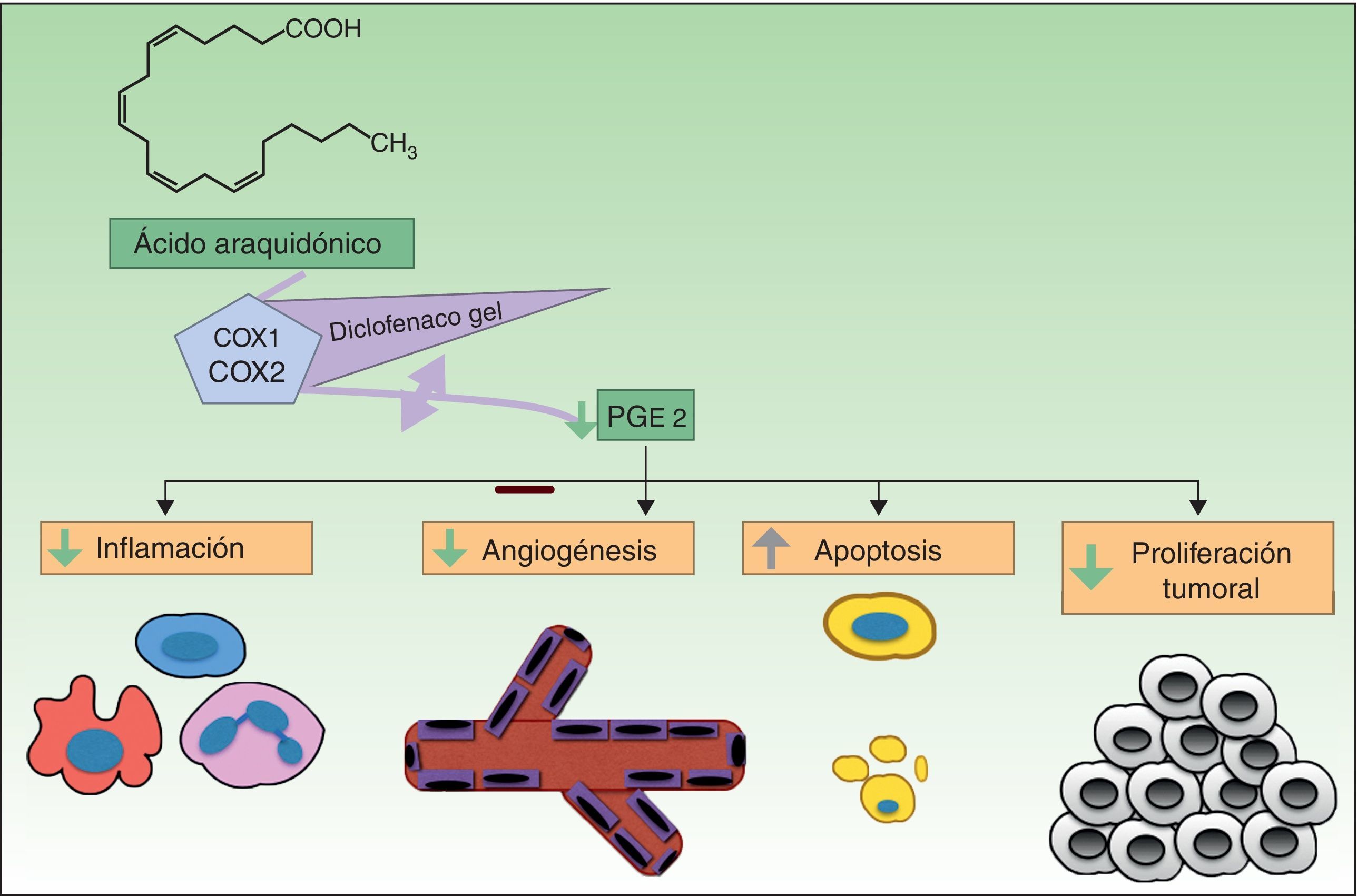
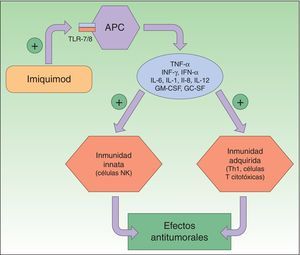
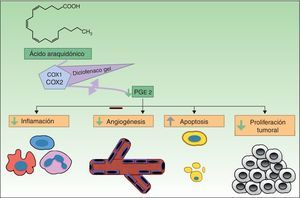
Resistencia a diclofenacoDiclofenaco (DF) es un antiinflamatorio no esteroideo que reduce la producción de prostaglandinas mediante la inhibición de ciclooxigenasa 2 (COX-2) (fig. 3). Hay evidencias de que COX-2 desempeña un papel importante durante el desarrollo y progresión del CCNM. COX-2 permite la formación de PGE2 la cual favorece la proliferación tumoral, la angiogénesis, inhibe la apoptosis y favorece la inflamación. Se piensa que al inhibir esta enzima conseguimos el efecto contrario, sin embargo, su mecanismo de acción en células de cáncer cutáneo es desconocido. El DF al 3% en ácido hialurónico al 2,5% (Solaraze®) ha sido formulado en gel tópico y está autorizado por la FDA y la EMA para el tratamiento de QA. El protocolo de tratamiento consiste en aplicarlo 2 veces al día, durante 60-90 días. Aunque hay trabajos que apoyan su uso tópico para QA49-52, y alguno en enfermedad de Bowen53–54, no hay datos sobre su eficacia en el tratamiento del CBC o el CCE invasivo40.
Inhibición de COX-2 por el diclofenaco, provocando un descenso de la PGE2 y en consecuencia una disminución de sus funciones, como son la angiogénesis, la proliferación tumoral, la inflamación y favoreciendo la apoptosis.
COX-1: ciclooxigenasa 1; COX-2: ciclooxigenasa 2; PGE2: prostaglandina E2.
En relación con las tasas de respuesta completa a DC en QA, estas son muy diferentes según los estudios, oscilando entre el 33 y el 81%, existiendo incluso un estudio con 130 pacientes en el que no encontraron ninguna mejora significativa55-59. Por lo tanto, hay pacientes que no responden completamente al tratamiento y/o aparecen recurrencias.
En cuanto a los posibles mecanismos de la resistencia de las QA al DF, hay que destacar que su mecanismo de acción no está claro. Basado en las similitudes entre las QA y el CCE (p53 mutado y sobreexpresión de COX-2), Rodust et al.60 usaron 4 líneas de CCE como modelo de QA y estudiaron su resistencia a DF. Tres de ellas eran sensibles a los efectos proapoptóticos asociados con activación de las caspasas por parte del DF, mientras que una era resistente. Cuando se trataban las células sensibles al DF, se producía el efecto proapoptótico característico a nivel de proteínas de la familia B-cell lymphoma (2Bcl-2), incremento de Bad (proapoptótico) y disminución de myeloid cell leukemia 1 (Mcl-1) y de Bcl-w (antiapoptóticos). Sin embargo, en la línea resistente, la falta de COX-2 se correlacionaba ya con una baja expresión de Mcl-1 y Bcl-w, así como una alta expresión de Bad, antes del tratamiento con DF, que podría ser explicado por la falta de PEG2 en estas células. En esta situación, no podrían ocurrir los efectos proapoptóticos del DF. Sin embargo, se vio que en estas células, Noxa y Puma, miembros proapoptóticos también de la familia Bcl-2, se encontraban subexpresados, lo que podría favorecer, en conjunto, la respuesta antiapoptótica al tratamiento por DF de manera independiente de COX-2.
Punto clave: la falta de respuesta a DF en células de CCE parece ser independiente de las vías mediadoras de apoptosis a través de COX-2 en células de CCE.
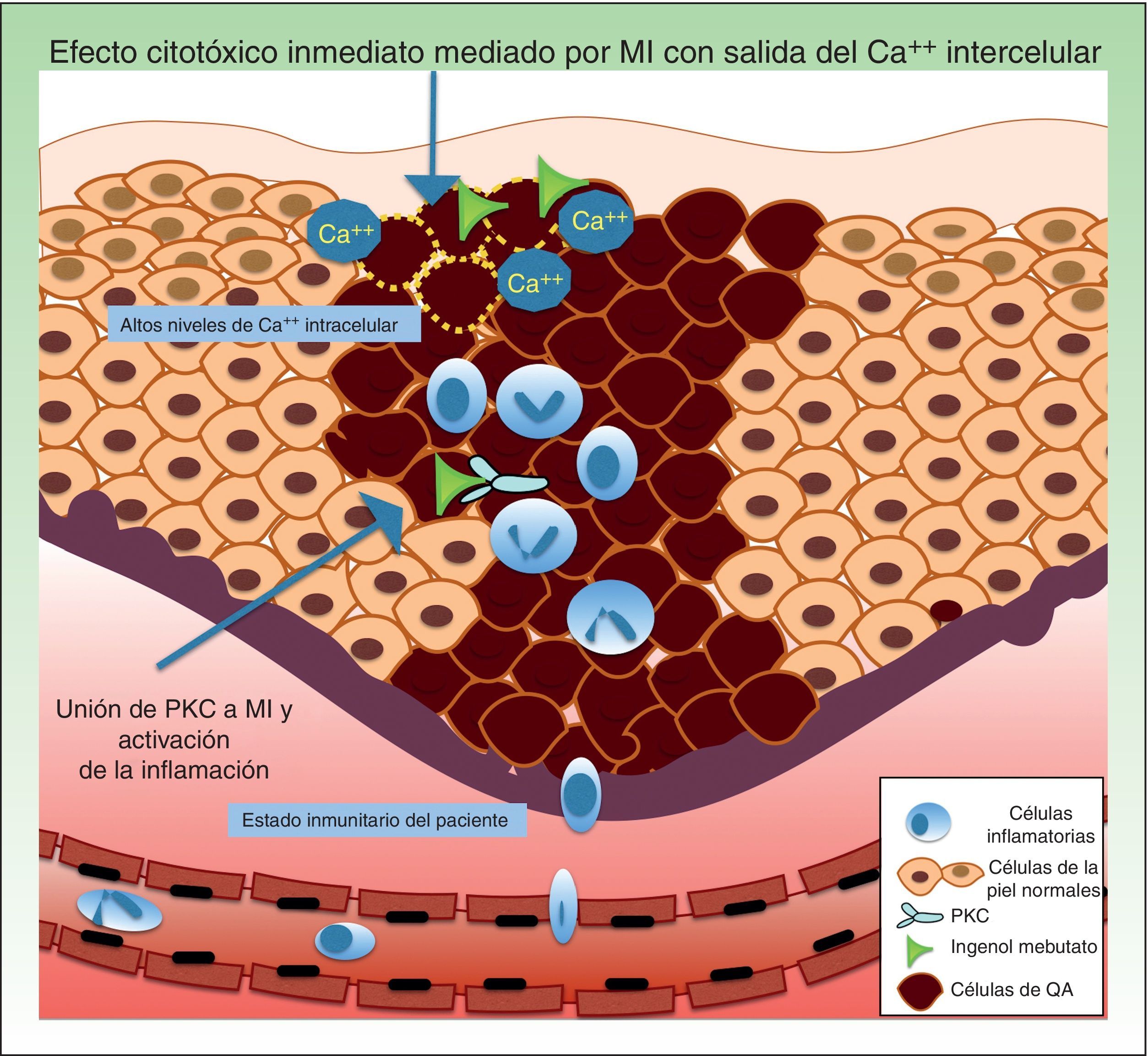
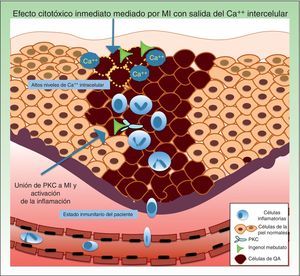
Resistencia a mebutato de ingenolEl mebutato de ingenol (MI) es un extracto natural de la planta Euphorbia peplus, que desde hace tiempo se ha usado en el tratamiento de diferentes problemas cutáneos como verrugas virales y neoplasias61. Presenta un doble mecanismo de acción: la inducción de una muerte celular rápida, en horas, mediante necrosis de los queratinocitos displásicos a través de daño mitocondrial y en la membrana plasmática62, y, a los pocos días, una respuesta inflamatoria a través de la proteína quinasa C δ (PKC) con la producción de citoquinas proinflamatorias y anticuerpos específicos del tumor que provocan una citotoxicidad celular mediada por neutrófilos dependiente de anticuerpos (fig. 4)63.
Los mecanismos de resistencia que se pueden ver involucrados en la terapia con mebutato de ingenol son los niveles de Ca++ intracelular, a nivel de los receptores de unión y del propio estado inmunitario del paciente.
Ca++: calcio; MI: mebutato de ingenol; PKC: proteína quinasa C; QA: queratosis actínica.
Actualmente su uso tópico en forma de gel está aprobado en QA en 2 concentraciones: 0,015% para las lesiones localizadas en cabeza, aplicado una vez al día durante 3 días, y al 0,05% para las de tronco aplicado solo 2 días64. Otras patologías cutáneas para las que se ha usado el MI son el CBC6, la EB7, un caso de poroqueratosis gigante65, las verrugas anogenitales66, e incluso en el melanoma in situ recurrente67.
La tasa de respuesta completa para QA en cara y cuero cabelludo es del 42,2%, y en tronco y extremidades es del 34,1%68.
Respecto a los factores que pueden influir en la resistencia relacionada con el efecto citotóxico agudo, se ha postulado que MI provoca la liberación de calcio desde el retículo endoplásmico (en lugar de una afluencia de calcio extracelular). En este sentido, los queratinocitos humanos diferenciados presentan niveles altos de calcio, siendo significativamente menos sensibles a la muerte celular mediada por MI que los queratinocitos indiferenciados y proliferantes con menor contenido intracelular de calcio62,69.
Un factor que puede intervenir como mecanismo de resistencia a MI es el reclutamiento de neutrófilos. A nivel preclínico, el efecto inflamatorio del MI se estudió en el ratón Foxn1nu (ratones denominados «desnudos» con una mutación autosómica recesiva en el gen FOXN1 [Forkhead box N1] relacionada con inmunodeficiencia de células T, alopecia y onicodistrofia) a los cuales además se les indujo una depleción de los neutrófilos, y en otro modelo murino CD 18 deficiente (expresión deficiente de molécula de adhesión leucocitaria)70. En ambos grupos se les inyectaron células LK2 que desarrollan CEC inducido por la radiación UV, observando un aumento significativo de las tasas de recaída del tumor (>70%) a las semanas, ya que los neutrófilos serían los causantes de la muerte de células tumorales residuales. Los autores concluyeron que el estado inmunitario del individuo puede contribuir a la resistencia de MI70.
Punto clave: el estado inmunitario del individuo consistente en déficit de linfocitos T, déficit de PMN y diferentes factores como los niveles de Ca++ intracelular podrían influir en su sensibilidad al tratamiento con MI.
ConclusionesEn los últimos años hemos asistido a un incremento en el número de tratamientos tópicos para el CCNM, principalmente a expensas de una generación de fármacos bautizados con el nombre de inmunomoduladores tópicos. Sin embargo, desde su lanzamiento, se han publicado diferentes mecanismos de resistencia que pueden depender tanto del estado inmunológico del paciente como de características propias, bioquímicas y moleculares, de las células tumorales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.