La terapia fotodinámica tiene una importante acción antimicrobiana. Se presentan 2 casos clínicos de úlceras crónicas en las extremidades inferiores sobreinfectadas por hongos y bacterias de difícil manejo, en los que el tratamiento fotodinámico con azul de metileno como fotosensibilizante resultó en la curación clínica y microbiológica. No se presentaron efectos adversos reseñables. La posibilidad de utilizar la terapia fotodinámica con azul de metileno en el manejo de las úlceras crónicas sobreinfectadas constituye una interesante alternativa para reducir el uso de antibióticos y disminuir la aparición de resistencias.
Photodynamic therapy (PDT) is a therapeutic modality with significant antimicrobial activity. We present 2 cases of chronic lower limb ulcers in which fungal and bacterial superinfection complicated management. PDT with methylene blue as the photosensitizer led to clinical and microbiological cure with no significant adverse effects. PDT with methylene blue is a valid option for the management of superinfected chronic ulcers, reducing the use of antibiotics and the induction of resistance.
La terapia fotodinámica (TFD) es una modalidad terapéutica basada en la fotooxidación de materiales biológicos inducida por un fotosensibilizante (FS) que, localizado selectivamente en ciertas células, y al ser iluminado con una determinada luz, consigue la destrucción de las mismas1.
La TFD tiene indicación aprobada en el tratamiento del cáncer cutáneo queratinocitario, aunque puede tener otras aplicaciones1,2. Además de actuar sobre células tumorales, la TFD tiene una acción antimicrobiana que es conocida desde hace más de 100 años3. Entre sus puede servir como tratamiento en infecciones mixtas (no solo de diferentes bacterias —sea cual sea su perfil de resistencia—, sino también de la combinación de bacterias, hongos, virus e incluso parásitos), constituyendo una alternativa o un complemento a los antimicrobianos convencionales2.
La TFD antimicrobiana (TFDa) tiene una acción local directa, por lo que es especialmente utilizada en zonas accesibles como las lesiones cutáneas, y constituye una terapia segura y con escasos efectos secundarios1.
Las úlceras cutáneas colonizadas y/o infectadas son una importante preocupación, tanto clínica (entidad recalcitrante, lenta en cicatrizar, dolorosa, antiestética, fuente de infección) como epidemiológica (reservorio de bacterias multirresistentes y de hongos de difícil manejo y costosos tratamientos), por no entrar en el capítulo de gastos que todo esto lleva añadido4.
La TFD tiene además otras acciones que se suman a la mejoría que se pueda derivar de la reducción —o desaparición— de la carga microbiana5. Propicia la cicatrización y la epitelización cutánea mediante procesos inmunomoduladores y regenerativos, como el aumento en el contenido de hidroxiprolina, la mejora en la angiogénesis y los efectos moduladores del colágeno (atenuando su degradación y mediando su remodelación)5–7.
La experiencia práctica en el uso de la TFDa en el manejo de las úlceras es escasa, si bien hay 2 ensayos clínicos publicados con prometedores resultados8,9. Nuestro grupo cuenta con la resolución de un complejo caso de esporotricosis cutánea ulcerada recalcitrante curada con la aplicación de TFD con azul de metileno (AM) intralesional en tratamiento combinado con un antifúngico sistémico10.
A continuación se presentan 2 casos de úlceras tórpidas sobreinfectadas en las extremidades inferiores resueltos con la ayuda de la TFD en sus 2 modalidades: la aplicación convencional (con lámpara Aktilite®) y la nueva modalidad con luz de día.
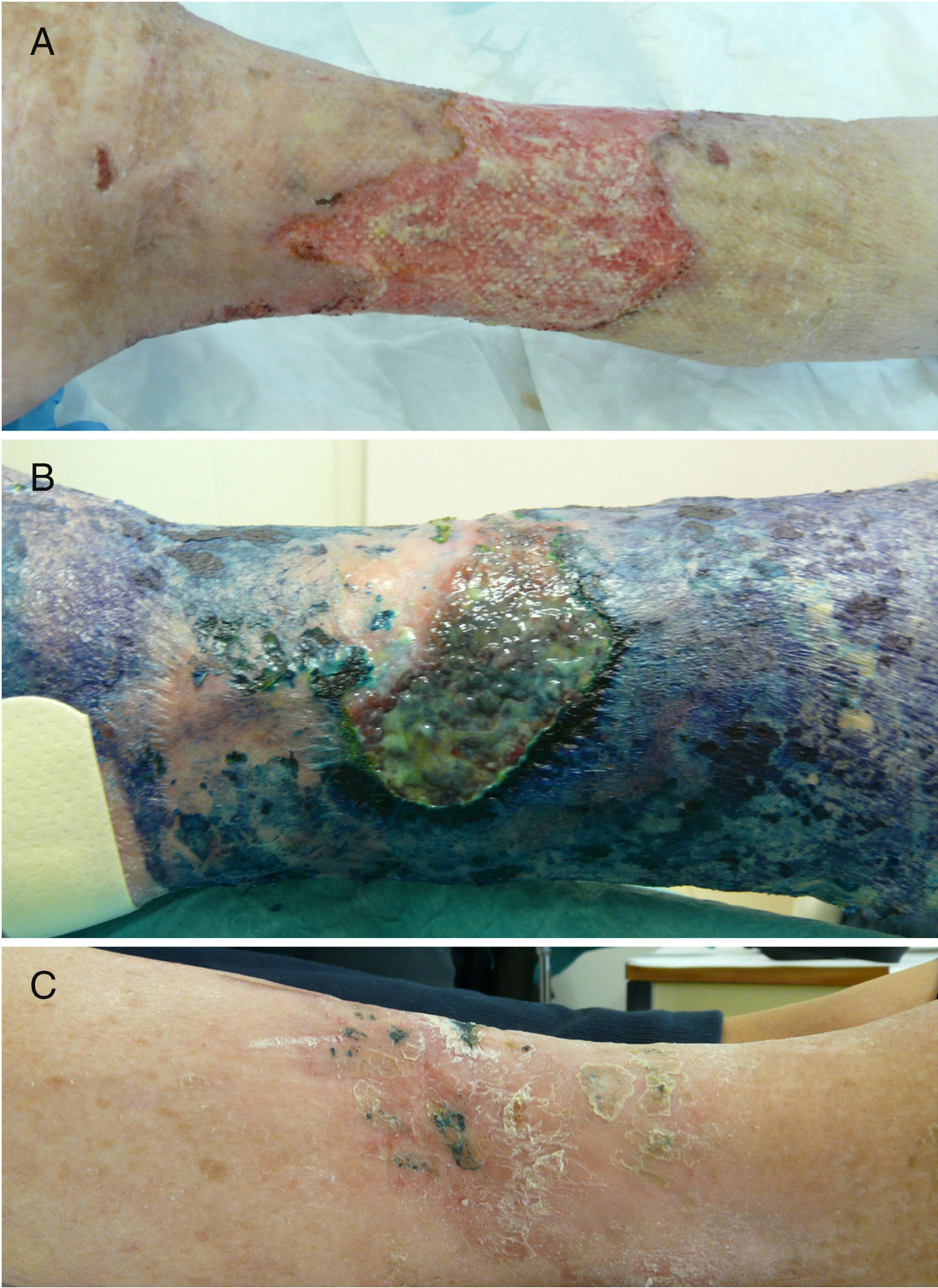
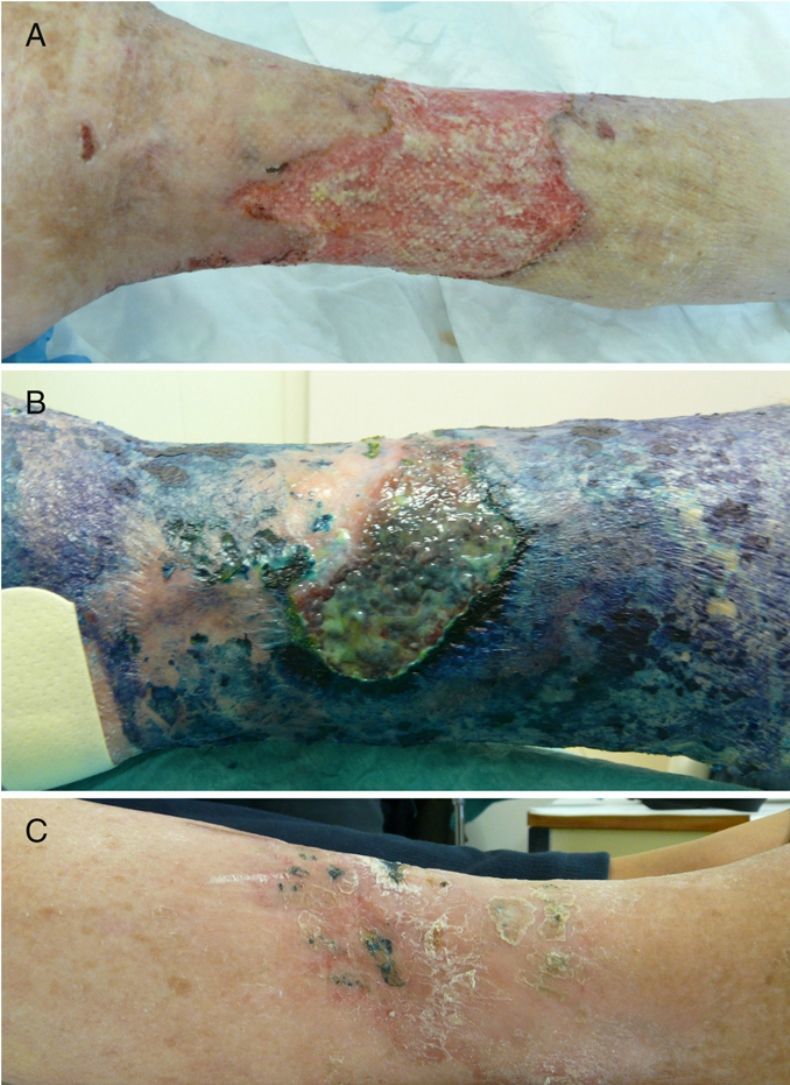
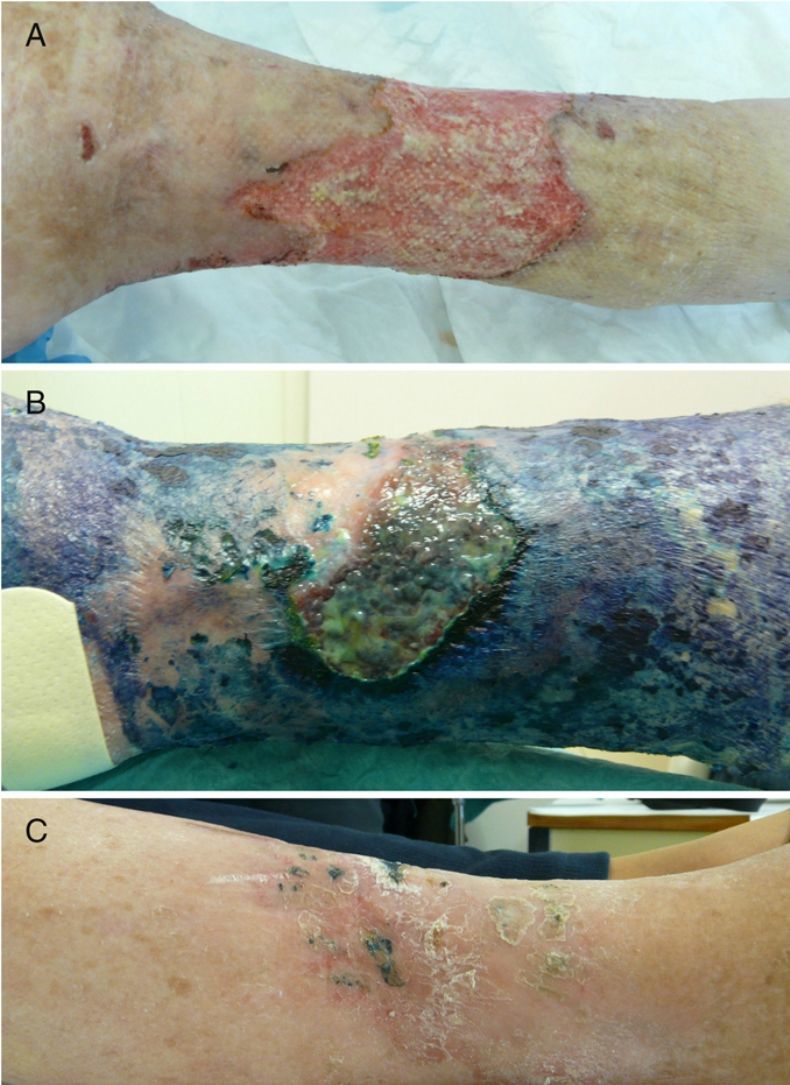
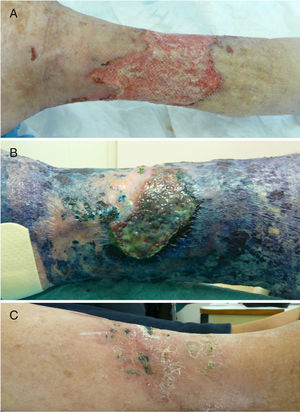
Casos clínicosCaso 1Una mujer de 76 años ingresó en el servicio de medicina interna por presentar una úlcera varicosa crónica de grado iv en la extremidad inferior derecha de evolución tórpida, con aumento de extensión, mal olor, supuración y necrosis (fig. 1A). En los cultivos crecieron repetidamente Fusarium sp. y Pseudomonas aeruginosa. Se realizó un desbridamiento quirúrgico y se trató empíricamente con linezolid y piperacilina-tazobactam iv. Tras los resultados del cultivo se cambió a ciprofloxacino, añadiéndose voriconazol. La evolución de la paciente fue muy tórpida, con múltiples complicaciones (sepsis urológica e ictus) y la introducción de nuevos tratamientos (anticoagulantes, ceftazidima y amikacina). Ante esta evolución, y tras obtener el consentimiento de la paciente, se procedió a la aplicación de TFD con solución de AM al 1% (30min de incubación en oclusiva) e irradiación, previa limpieza con suero fisiológico del exceso de AM, con lámpara Aktilite (Galderma, SL. Francia; fluencia de 37J/cm2). Se administraron 3 sesiones la primera semana y 2 la segunda y tercera semana (fig. 1B). La mejoría fue importante, por lo que la paciente fue dada de alta, continuando con 2 sesiones semanales de «TFD con luz de día» en su domicilio (aplicación del AM y exposición a la luz del día durante 30min diariamente, con controles bisemanales). En el seguimiento tardío apareció en cultivo Staphylococcus aureus resistente a meticilina (SARM), que se valoró como una colonización con escaso valor patógeno, si bien se aplicó mupirocina tópica y se siguió con la TFD domiciliaria, desapareciendo en el siguiente control microbiológico. Tras 6 meses de tratamiento se consiguió la curación completa de la lesión (fig. 1C).
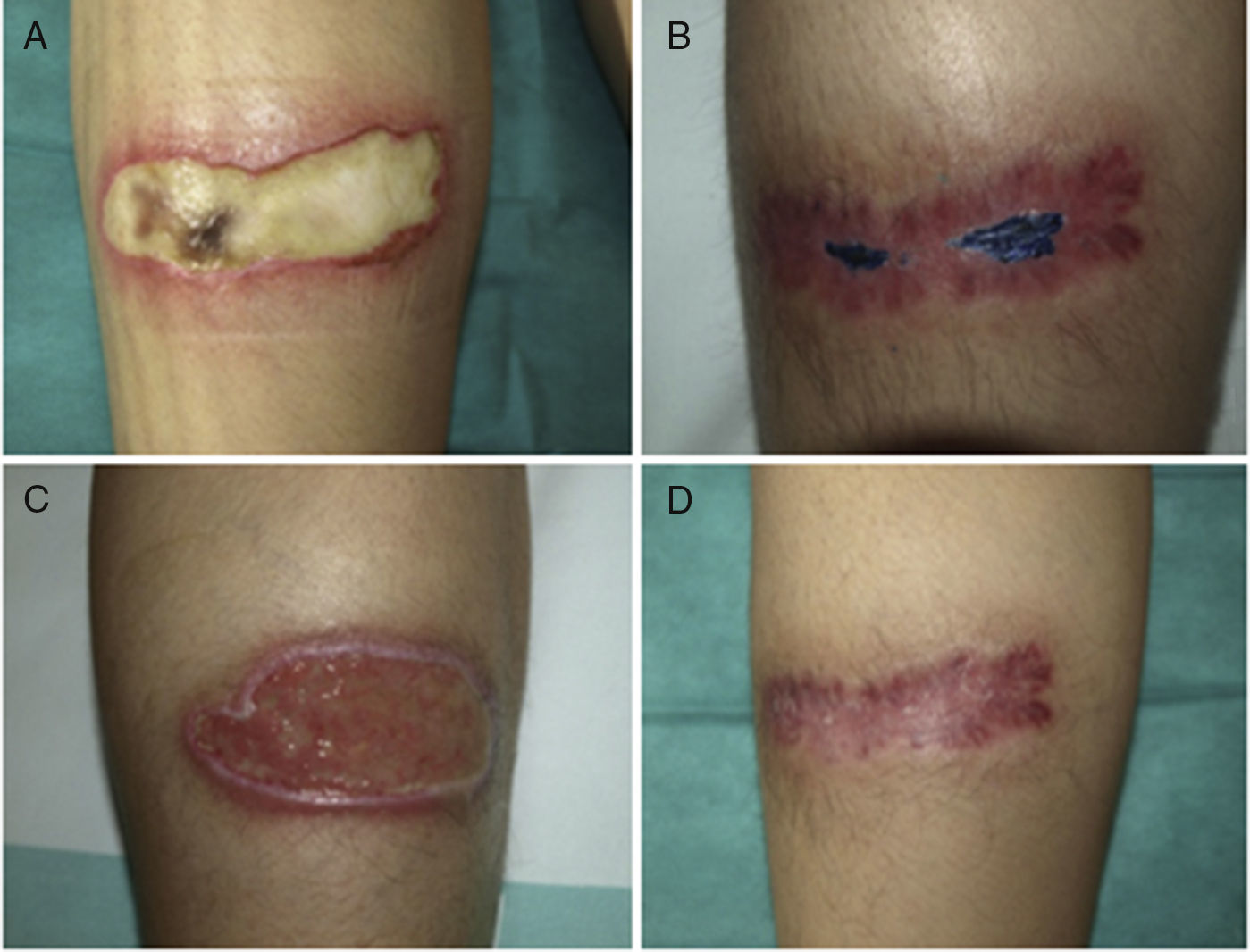
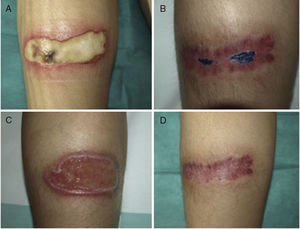
Caso 2Una mujer de 38 años de edad, portadora de trasplante mixto de riñón y páncreas, en oral con tacrolimus y prednisona, sufrió unas quemaduras simétricas en la zona gemelar durante una intervención quirúrgica por una eventración. A la inspección se apreciaban 2 úlceras simétricas de 9×4cm, que en un principio estaban cubiertas por una escara negruzca que posteriormente dejó un lecho de fibrina (figs. 2 A y C). En las lesiones se aisló repetidamente Corynebacterium striatum y Fusarium oxysporum. La paciente fue tratada con ciprofloxacino oral durante una semana y se inició TFD con solución de AM 1% con el protocolo expuesto anteriormente. Se administró una sesión semanal y el cultivo realizado a las 8 semanas fue negativo para bacterias y hongos. A los 2 meses se evidenció la cicatrización en la pierna derecha, mientras que en el lado izquierdo se aisló SARM, reiniciándose la TFD con AM y mupirocina entre sesiones, negativizándose el cultivo en 3 semanas. A los 3 meses las 2 lesiones estaban cicatrizadas (figs. 2 B y D).
Evolución de las úlceras situadas en las extremidades inferiores del caso 2, en las que se aisló repetidamente Fusarium oxysporum (además de Corynebacterium ulcerans). En las imágenes A y C está al principio del proceso y en las imágenes B y D tras el tratamiento, en proceso de resolución.
En la evolución de ambos casos los cultivos se fueron negativizando, evidenciando una gradual disminución de carga microbiana (bacteriana y fúngica). La percepción de las pacientes fue muy positiva, valorando subjetivamente la terapia como eficaz, sin presentar dolor, y refiriendo como único efecto colateral la coloración azul intensa en la zona tratada y de la orina ocasionalmente.
DiscusiónLa TFD con AM resultó eficaz en el manejo de 2 úlceras tórpidas sobreinfectadas con Fusarium sp., Pseudomonas y otras bacterias de difícil tratamiento. De este modo las 2 pacientes lograron la curación y epitelización de las úlceras, sin necesidad de utilizar terapias de elevado coste, no exentas de interacciones y efectos adversos y que pueden requerir administración parenteral.
La presencia de Fusarium sp. en los 2 casos y de P. aeruginosa en el caso 1 constituye uno de los paradigmas de microorganismos de difícil tratamiento con antimicrobianos. Especialmente P. aeruginosa constituye, hoy por hoy, un reto terapéutico debido a su creciente multirresistencia. Por otro lado, en ambos casos se aisló SARM durante la evolución, pero este no requirió tratamiento sistémico, manejándose con mupirocina tópica y con la propia TFD. La TFDa puede constituir una terapia adyuvante, segura, sencilla y económica que, además, no crea resistencias, es de amplio espectro y puede tener efecto sobre el biofilm11. Este último fenómeno (formación de biofilms o biocapas) parece influir en la alteración de la cicatrización y consiste en la formación de comunidades de bacterias agregadas y cubiertas por una matriz extracelular de polisacáridos que las protege contra los antibióticos y de la inmunidad del paciente12. La TFD complementa los tratamientos antimicrobianos, con los que puede tener efectos sinérgicos11, evita terapias caras y agresivas para la microbiota de las personas y no tiene interacciones, por lo que puede ser especialmente útil en pacientes inmunosuprimidos, diabéticos y ancianos polimedicados, como nuestros casos13. Todo ello se une a otras propiedades que, en el caso de su aplicación en las úlceras cutáneas, parecen disminuir la carga microbiana y promover la cicatrización de un modo importante11.
En ninguno de los 2 casos se realizó biopsia, ya que ni la clínica ni la historia natural nos hicieron sospechar otra etiología.
No existe un FS comercializado para realizar TFDa. Diferentes estudios in vitro e in vivo demuestran el excelente perfil del AM, activo frente a bacterias gram positivas, gram negativas y hongos2. Respecto a Pseudomonas, hay ya publicadas exitosas experiencias de la TFD sobre lesiones cutáneas, tanto in vitro como en modelo animal14–16. Los casos presentados son la primera experiencia de uso de TFD con AM en Fusarium sp.
El AM está indicado para uso humano de forma intravenosa, por tanto es seguro. Además, es barato y está disponible en el hospital. No obstante, hay que tener las precauciones necesarias –aun cuando su uso es tópico en la TFDa— en el embarazo y en caso de que los pacientes estén tratados con medicamentos psiquiátricos serotoninérgicos (http://www.fda.gov/Drugs/DrugSafety/ucm267886.htm).
La TFDa ejerce su acción solo en el momento en que el fotosensibilizante es fotoactivado, y en el instante en que no hay luz este deja de ser activo. Por dicha razón, recomendamos a los pacientes que sigan activando con la luz del día el AM que persiste en la úlcera en los días siguientes a su aplicación. De esta forma se puede alcanzar una dosis diaria de TFD.
En conclusión, los casos presentados son un ejemplo de cómo la TFDa puede ser una alternativa terapéutica con un interesante futuro en el manejo de las úlceras cutáneas crónicas. Su uso puede ayudar a sortear las multirresistencias, y a reservar los antimicrobianos para casos en los que verdaderamente estén indicados y en localizaciones en las que esta terapia no sea capaz de actuar.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLos autores cuentan con el apoyo del Ministerio de Economía y Competitividad en su investigación en terapia fotodinámica mediante el Proyecto del Plan Estatal de Investigación Científica y Técnica y de Innovación CTQ2013-48767-C3-2-R. Asimismo, cuentan con el apoyo del Gobierno de Aragón mediante la participación en el Grupo de Investigación B-85.
Los autores quieren hacer constar su agradecimiento al Dr. Antonio Rezusta por su colaboración y asesoramiento.