Los trabajos sobre el tratamiento sistémico de la psoriasis en edad pediátrica son escasos. El objetivo principal de este trabajo consistió en describir qué tratamientos sistémicos se emplean en práctica clínica en psoriasis moderada-grave en edad pediátrica. Secundariamente se describió la efectividad y perfil de seguridad de dichos tratamientos.
Materiales y métodosEstudio descriptivo transversal multicéntrico, de los pacientes con psoriasis moderada-grave, que siendo menores de 18 años estuviesen recibiendo o hubieran recibido tratamiento sistémico (clásico o biológico) o fototerapia. Se recogieron datos clínico-demográficos, tipo de tratamiento recibido, y tolerancia, efectos indeseables y respuesta al mismo.
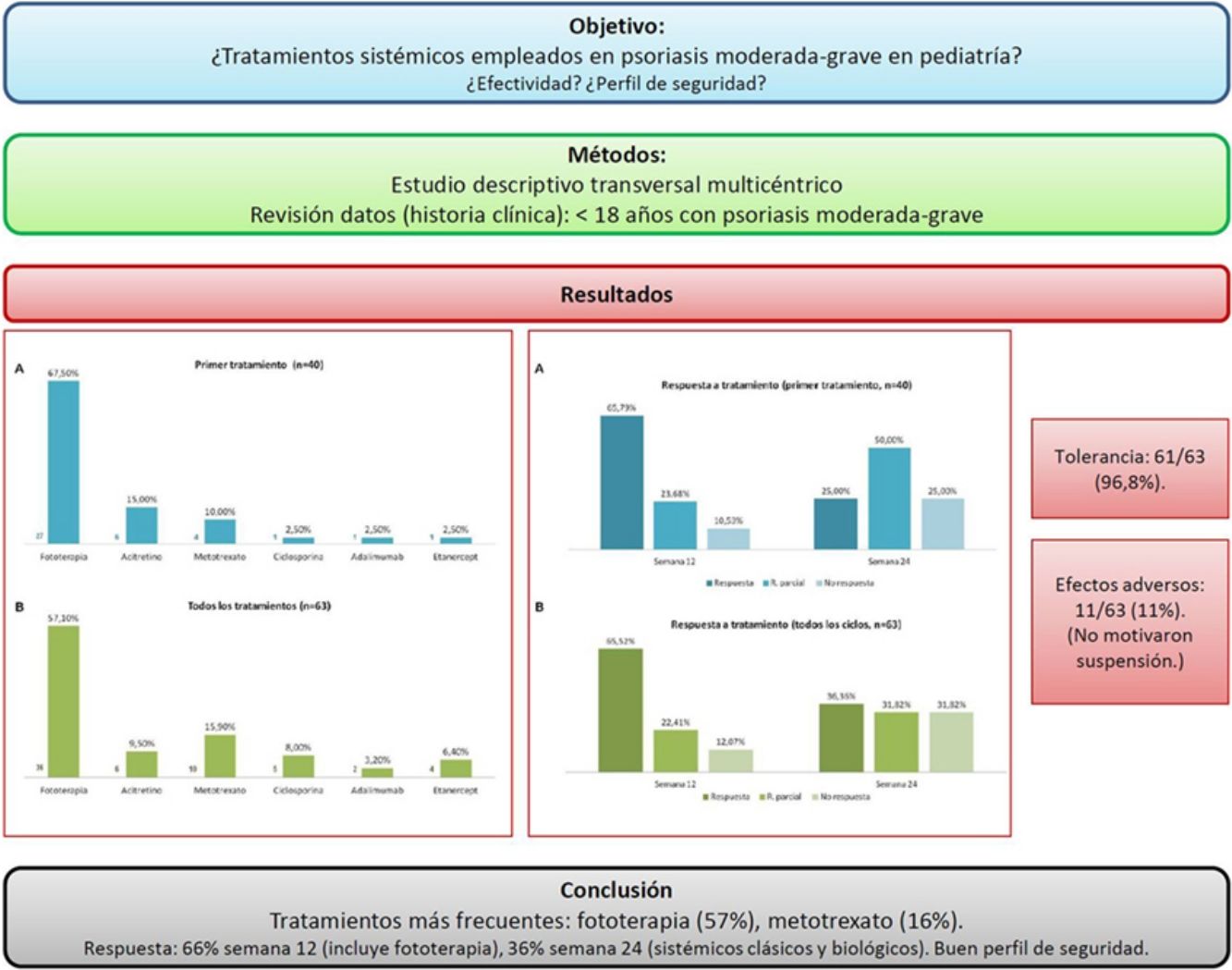
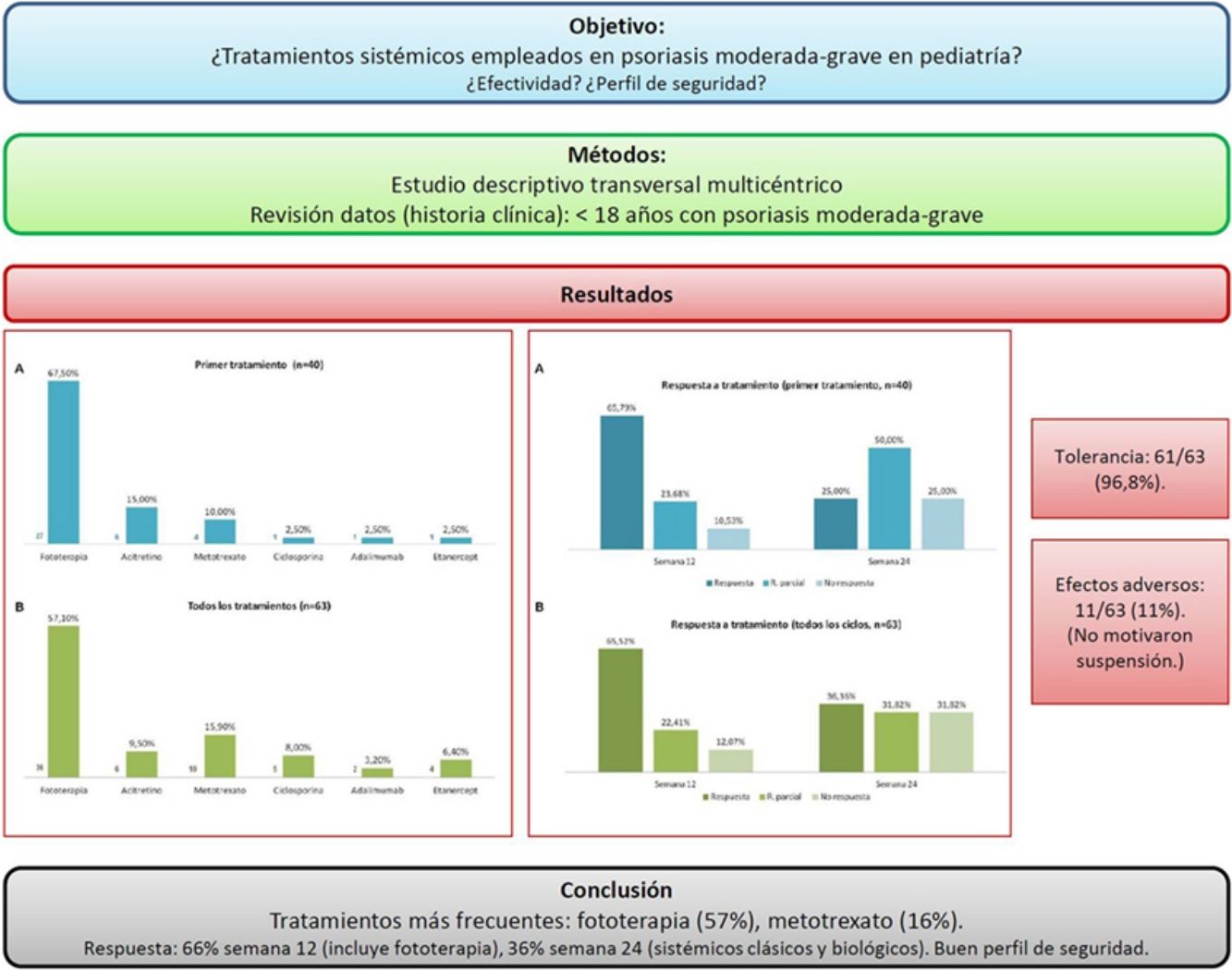
ResultadosSe obtuvieron datos de 40 pacientes (60% sexo femenino, edad media 13 años), que realizaron 63 ciclos de tratamiento. Teniendo en cuenta el primer tratamiento (n=40), la fototerapia fue la opción más frecuente (68%), seguida de acitretino (15%). Considerando el total de ciclos de tratamiento (n=63), el tratamiento más frecuentemente empleado fue la fototerapia (57%), seguida de metotrexato (16%). En la semana 12 (incluye evaluación de fototerapia), el 66% y el 22% fueron buenos respondedores o respondedores parciales, respectivamente. En la semana 24 (datos exclusivos sobre fármacos sistémicos), el 36% y el 32% continuaron con respuestas buenas y parciales. Los tratamientos fueron bien tolerados (97%) y los efectos indeseables escasos (11%), sin que en ningún caso motivasen la suspensión del fármaco.
ConclusionesEn la población menor de 18 años con psoriasis moderada-grave evaluada la fototerapia fue el tratamiento más utilizado, seguida de metotrexato. Los tratamientos consiguieron porcentajes de buenos respondedores del 66% en la semana 12 (incluida fototerapia), y del 36% en la semana 24 (fármacos sistémicos sin fototerapia), presentando un buen perfil de seguridad.
Studies on the use of systemic therapy for psoriasis in pediatric patients are scarce. The main aim of this study was to describe the systemic treatments used for moderate to severe psoriasis in pediatric clinical settings. The second aim was to describe the effectiveness and safety of these treatments.
Material and methodsDescriptive, cross-sectional, multicenter study of patients under 18 years of age with moderate to severe psoriasis who were being treated or had been treated with a systemic drug (conventional or biologic) or phototherapy. We recorded demographic and clinical information, treatments received, tolerance, adverse effects, and response to treatment.
ResultsData were collected for 40 patients (60% female; mean age, 13 years) who had received 63 treatments in total. The most common first treatment (n=40) was phototherapy (administered to 68% of patients), followed by acitretin (15%). The most common treatments overall (n=63) were phototherapy (57%) and methotrexate (16%). At week 12 (evaluation of systemic treatment and phototherapy), 66% of the patients were classified as good responders and 22% as partial responders. The respective rates for week 24 (evaluation of systemic treatment only) were 36% and 32%. The treatments were well tolerated (97%) and adverse effects were reported in just 11% of cases. There were no treatment discontinuations because of adverse effects.
ConclusionsPhototherapy, followed by methotrexate, was the most common treatment for moderate to severe psoriasis in this series of patients under 18 years. The treatments showed a favorable safety profile and were associated with a good response rate of 66% at week 12 (systemic treatment and phototherapy) and 36% at week 24 (systemic treatment only).
La psoriasis en pediatría no es una enfermedad infrecuente, sin embargo existen pocos datos acerca de sus características epidemiológicas y de su manejo con tratamientos sistémicos1,2.
En los diferentes trabajos sobre psoriasis en edad pediátrica, en torno al 8% de los pacientes presentan enfermedad moderada-grave y requieren tratamiento con fototerapia o fármacos sistémicos3. El curso crónico de la psoriasis y el planteamiento de regímenes de tratamiento prolongados hace necesaria una selección cuidadosa de las diferentes opciones terapéuticas, considerando el mejor perfil de efectividad y seguridad, especialmente en estas edades tempranas4.
Nuestro objetivo principal consistió en describir qué tratamientos sistémicos se emplean en práctica clínica en psoriasis moderada-grave en edad pediátrica.
Secundariamente se trató de describir la efectividad y el perfil de seguridad de dichos tratamientos.
Material y métodosEstudio descriptivo transversal multicéntrico realizado en los servicios de Dermatología pertenecientes a las 7 Estructuras de Gestión Integrada de las que consta la red del Servizo Galego de Saúde (SERGAS). Se incluyeron pacientes con psoriasis moderada-grave, que siendo menores de 18 años estuviesen recibiendo o hubieran recibido tratamiento sistémico (clásico o biológico) o fototerapia, en el periodo de enero de 2005 a agosto de 2017. Se extendió el estudio a una edad menor de 18 años (y no meramente pediátrica –hasta los 12-14 años–), ya que es la edad a partir de la cual se considera a un paciente como adulto. También los 18 años son el punto de corte a partir del cual la mayoría de los tratamientos sistémicos (a excepción del etanercept5, y más recientemente el adalimumab6 y el ustekinumab2) cuentan con aprobación (su empleo en niños se considera «fuera de ficha técnica»).
De cada uno de los pacientes incluidos se recogieron datos clínico-demográficos, parámetros analíticos básicos, características de la psoriasis y gravedad de la misma (según el Psoriasis Area and Severity Index [PASI] o según el área de superficie corporal: Body Surface Index [BSA]), y presencia de comorbilidades. Se consideró psoriasis moderada-grave si el PASI era igual o superior a 10, con extensión a aquellos casos en los que el PASI era menor de 10, pero no respondían a un tratamiento correctamente indicado. Con relación al BSA, el punto de corte para psoriasis moderada-grave fue el 10%. Con respecto a los tratamientos sistémicos realizados, se recogió la duración, la posología, la respuesta, la presencia de efectos indeseables, la tolerancia y el motivo de suspensión.
La evaluación de la respuesta se realizó en la semana 12 y/o 24 para todos los tratamientos con excepción de la fototerapia (evaluada únicamente en la semana 12). Esto se explica por el modo de proceder en la práctica clínica diaria en nuestros centros, donde tras la fototerapia no se suele programar una reevaluación estandarizada en la semana 24, a diferencia de lo que se hace ante el tratamiento con fármacos sistémicos.
Teniendo en cuenta el PASI, el BSA y otra información descriptiva reflejada por el dermatólogo en la historia clínica, se establecieron definiciones para clasificar a los pacientes como buenos respondedores, respondedores parciales y no respondedores. Se definió buena respuesta si se alcanzaba un PASI≥75 (mejoría del 75% o superior con respecto al PASI basal) en el momento de la evaluación (semana 12, semana 24). Se incluyeron también en este grupo a los pacientes en cuya historia clínica se indicase: «evolución muy buena o excelente», psoriasis «prácticamente aclarada», «remisión total o prácticamente total», o «suspensión del tratamiento por buena respuesta». Un valor de BSA de 0 o 1% en ausencia del valor PASI también se consideró buena respuesta. Se definió respuesta parcial si en el momento de la evaluación el paciente se situaba entre un PASI≥50 y PASI<75, o si en la historia clínica se indicaba: «mejoría parcial», «aclaramiento parcial», «remisión parcial». Aquellos que no alcanzaban el PASI50, o en cuya historia se recogía «mejoría escasa», «mínimo efecto», «ausencia de mejoría», «estabilidad de las lesiones con respecto al momento del inicio del tratamiento», o «suspensión del tratamiento por falta de respuesta», se consideraron no respondedores.
Se diferenció «efecto indeseable» (signos clínicos o alteraciones en estudios complementarios observados por el facultativo y reflejados en la historia clínica, relacionados con el tratamiento en cuestión, habiendo o no derivado en la suspensión del mismo), de intolerancia (cualquier sintomatología subjetiva u otras molestias que reportasen el paciente o sus padres con respecto a la toma del fármaco).
Los motivos que llevaron a la suspensión de un tratamiento se dividieron en buena respuesta, escasa respuesta/ausencia de respuesta, pérdida de respuesta (fallo secundario), pauta de tratamiento intermitente, deseo expreso del paciente o sus padres, mal cumplimiento terapéutico, pauta limitada por ensayo clínico, o si se suspendió debido a motivo médico (como intervención quirúrgica, infección activa o necesidad de otros tratamientos que interaccionasen o estuviesen contraindicados con el fármaco que se recibía), o por presencia de efectos indeseables/intolerancia.
El protocolo de este trabajo fue evaluado, con dictamen favorable, por el Comité Ético de Investigación Clínica de Galicia. Asimismo, fue clasificado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), como estudio postautorización con otros diseños diferentes al de seguimiento prospectivo (EPA-OD).
Análisis estadísticoLos datos se recogieron en una hoja de cálculo del programa Excel y se analizaron con el programa R Statistics (versión R i386 3.4.2). Se calculó la distribución de frecuencias para las variables cualitativas, y la media y desviación estándar de las variables cuantitativas. Se utilizó el test Chi cuadrado (o el test exacto de Fisher en caso necesario según el número de observaciones) para determinar las relaciones entre las diferentes variables cualitativas. Para la comparación entre variables cuantitativas según grupos de tratamiento se empleó el test de la T de Student. Se consideró estadísticamente significativo un valor de p¿0,05.
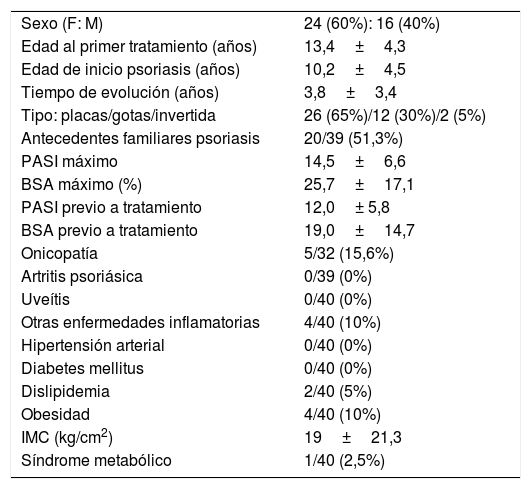
ResultadosSe obtuvieron datos de 40 pacientes (60% sexo femenino, edad media al inicio del primer tratamiento 13 años, 65% con psoriasis en placas), que realizaron 63 ciclos de tratamiento. Las características de la población de estudio se muestran en la tabla 1.
Características de los pacientes menores de 18 años con psoriasis moderada-grave con tratamiento sistémico (incluida fototerapia) (n=40)
| Sexo (F: M) | 24 (60%): 16 (40%) |
| Edad al primer tratamiento (años) | 13,4±4,3 |
| Edad de inicio psoriasis (años) | 10,2±4,5 |
| Tiempo de evolución (años) | 3,8±3,4 |
| Tipo: placas/gotas/invertida | 26 (65%)/12 (30%)/2 (5%) |
| Antecedentes familiares psoriasis | 20/39 (51,3%) |
| PASI máximo | 14,5±6,6 |
| BSA máximo (%) | 25,7±17,1 |
| PASI previo a tratamiento | 12,0± 5,8 |
| BSA previo a tratamiento | 19,0±14,7 |
| Onicopatía | 5/32 (15,6%) |
| Artritis psoriásica | 0/39 (0%) |
| Uveítis | 0/40 (0%) |
| Otras enfermedades inflamatorias | 4/40 (10%) |
| Hipertensión arterial | 0/40 (0%) |
| Diabetes mellitus | 0/40 (0%) |
| Dislipidemia | 2/40 (5%) |
| Obesidad | 4/40 (10%) |
| IMC (kg/cm2) | 19±21,3 |
| Síndrome metabólico | 1/40 (2,5%) |
BSA: body surface area; F: sexo femenino; IMC: índice de masa corporal; M: sexo masculino; PASI: Psoriasis Area and Severity Index.
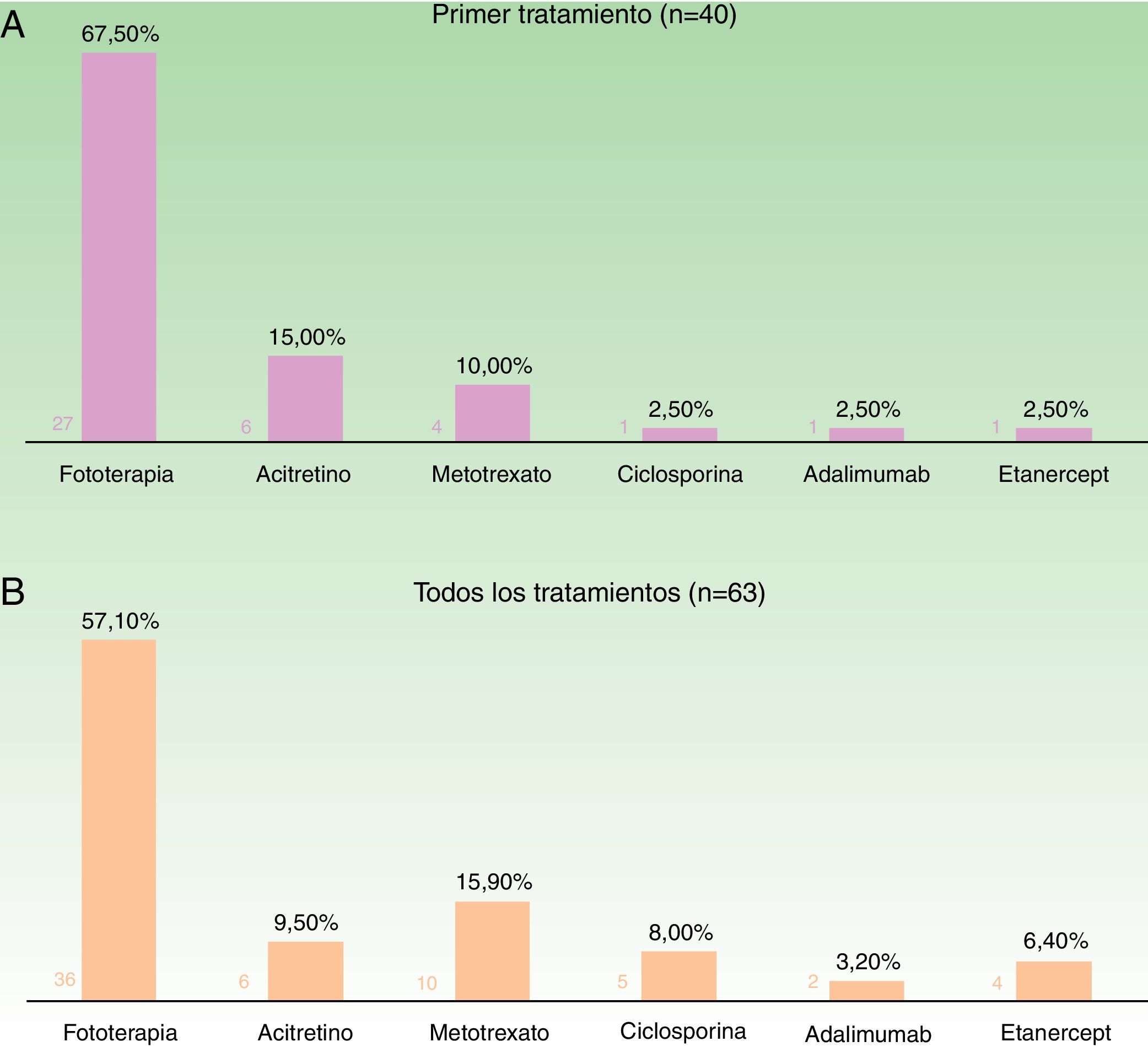
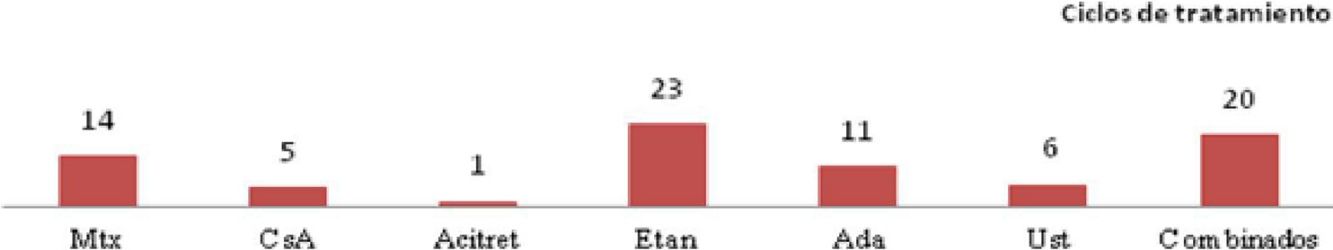
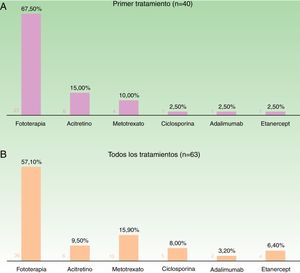
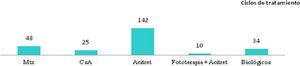
Teniendo en cuenta el primer tratamiento (n=40), la fototerapia fue la terapia más frecuentemente empleada (68%), seguida de acitretino (15%) (fig. 1). En la semana 12, en donde se incluye la evaluación de la fototerapia, el 66% (25/38) y el 24% (9/38) fueron buenos respondedores o respondedores parciales, respectivamente. En la semana 24 (evaluación de sistémicos clásicos y biológicos exclusivamente), el 25% (3/12) alcanzaron buena respuesta y el 50% (6/12) presentaron respuestas parciales.
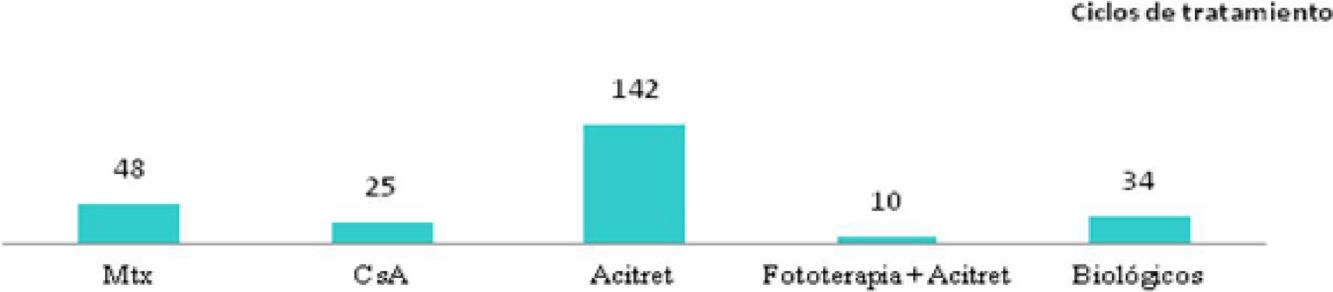
Distribución de tratamientos en menores de 18 años con psoriasis moderada-grave. A. Considerando el primer tratamiento realizado (n=40). B. Considerando todos los ciclos de tratamiento (n=63). A la izquierda de cada barra se indica el valor absoluto de pacientes con cada uno de los tratamientos.
Considerando el total de ciclos de tratamiento realizados (n=63), el tratamiento más frecuente fue la fototerapia, suponiendo el 57% de los ciclos, seguida de metotrexato, que fue indicado en el 16% de los casos (fig. 1). En la semana 12, el 66% (38/58) y el 22% (13/58) fueron buenos respondedores o respondedores parciales, respectivamente. En la semana 24 (análisis de sistémicos clásicos y biológicos exclusivamente), el 36% (8/22) continuó con buena respuesta y el 32% (7/22) con respuestas parciales.
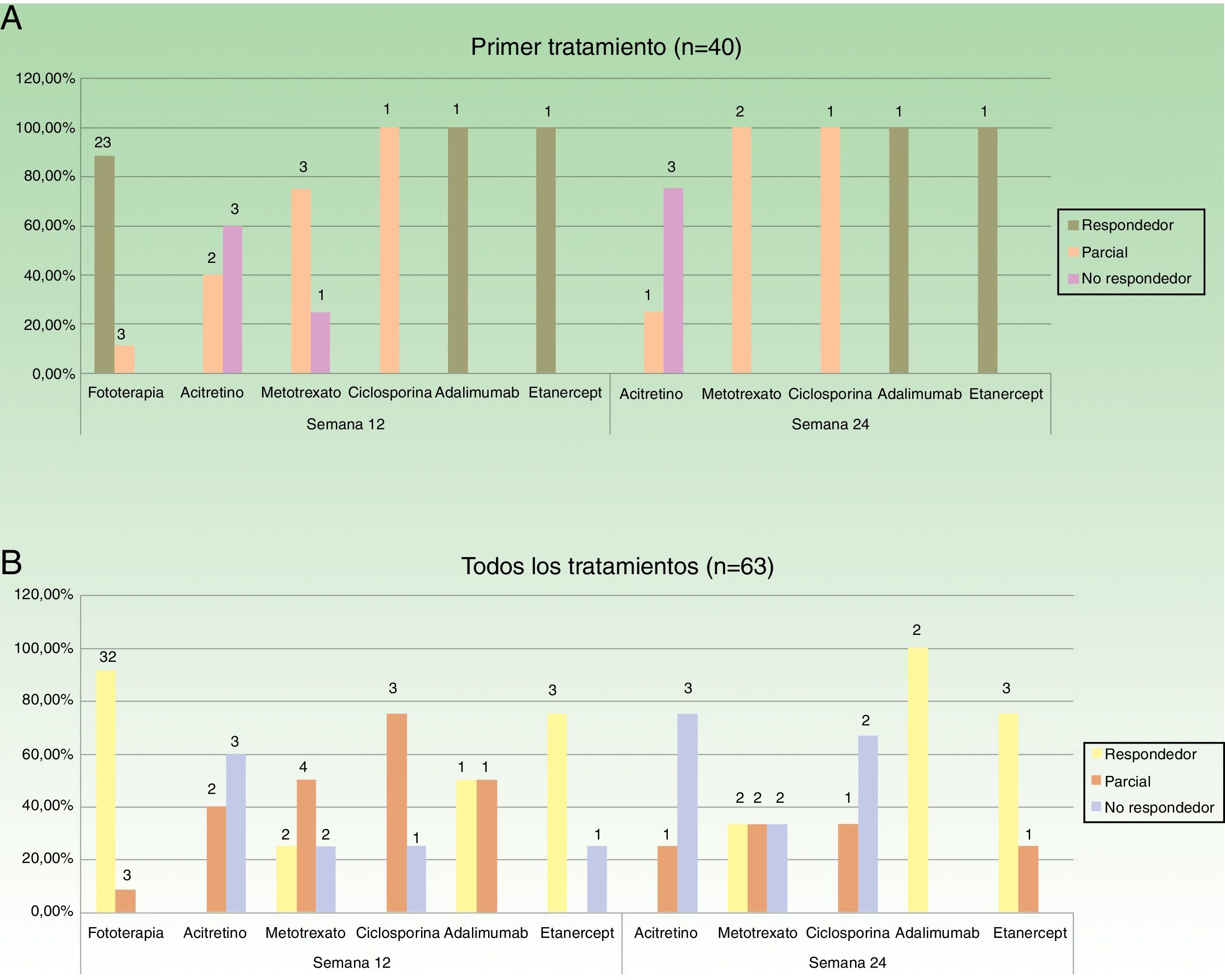
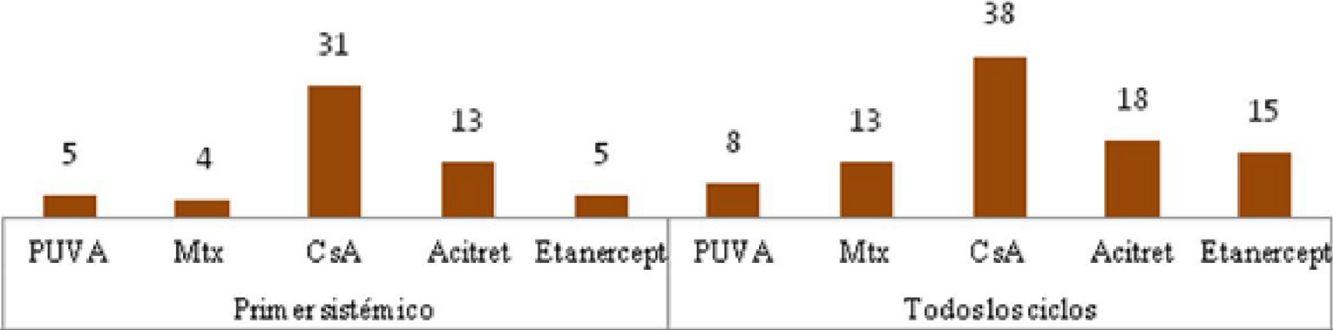
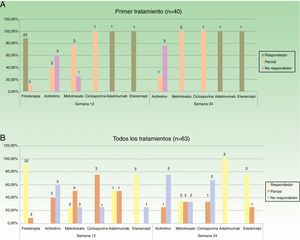
En la figura 2 se especifican los datos de respuesta para las diferentes opciones terapéuticas, en las semanas 12 y 24, teniendo en cuenta solo el primer tratamiento (n=40), o todos los ciclos de tratamiento (n=63). La fototerapia, la ciclosporina y los fármacos biológicos consiguieron los mejores resultados en el corto plazo (semana 12). En la semana 24 las respuestas más favorables se obtuvieron con los fármacos biológicos, seguidos de metotrexato.
Distribución de buenos respondedores, respondedores parciales y no respondedores para cada uno de los tratamientos. A. Considerando el primer tratamiento realizado (n=40). B. Considerando todos los ciclos de tratamiento (n=63). Sobre cada una de las barras se indica el valor absoluto de pacientes en cada uno de los grupos de respuesta.
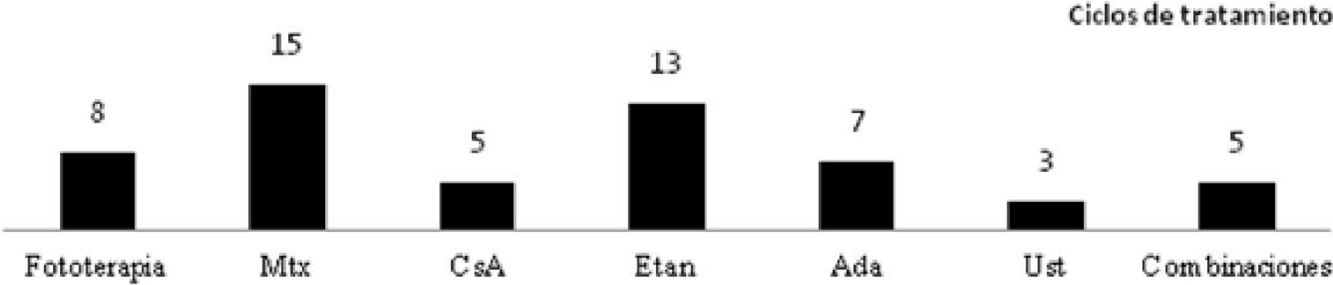
En el material suplementario se especifican las pautas empleadas y los datos de tolerancia y efectos indeseables, considerando todos los ciclos de tratamiento (n=63). Etanercept y acitretino fueron los tratamientos más prolongados (media de 26 y 23 meses, respectivamente). En referencia a la fototerapia (94% ultravioleta B de banda estrecha), la duración media de un ciclo de tratamiento fue de 2 meses. El tipo de psoriasis (placas versus gotas), no se relacionó con el tiempo de tratamiento ni con el número de sesiones (p>0,05). Los tratamientos fueron bien tolerados (97%) y los efectos indeseables escasos (11%), y en ningún caso motivaron la suspensión del fármaco.
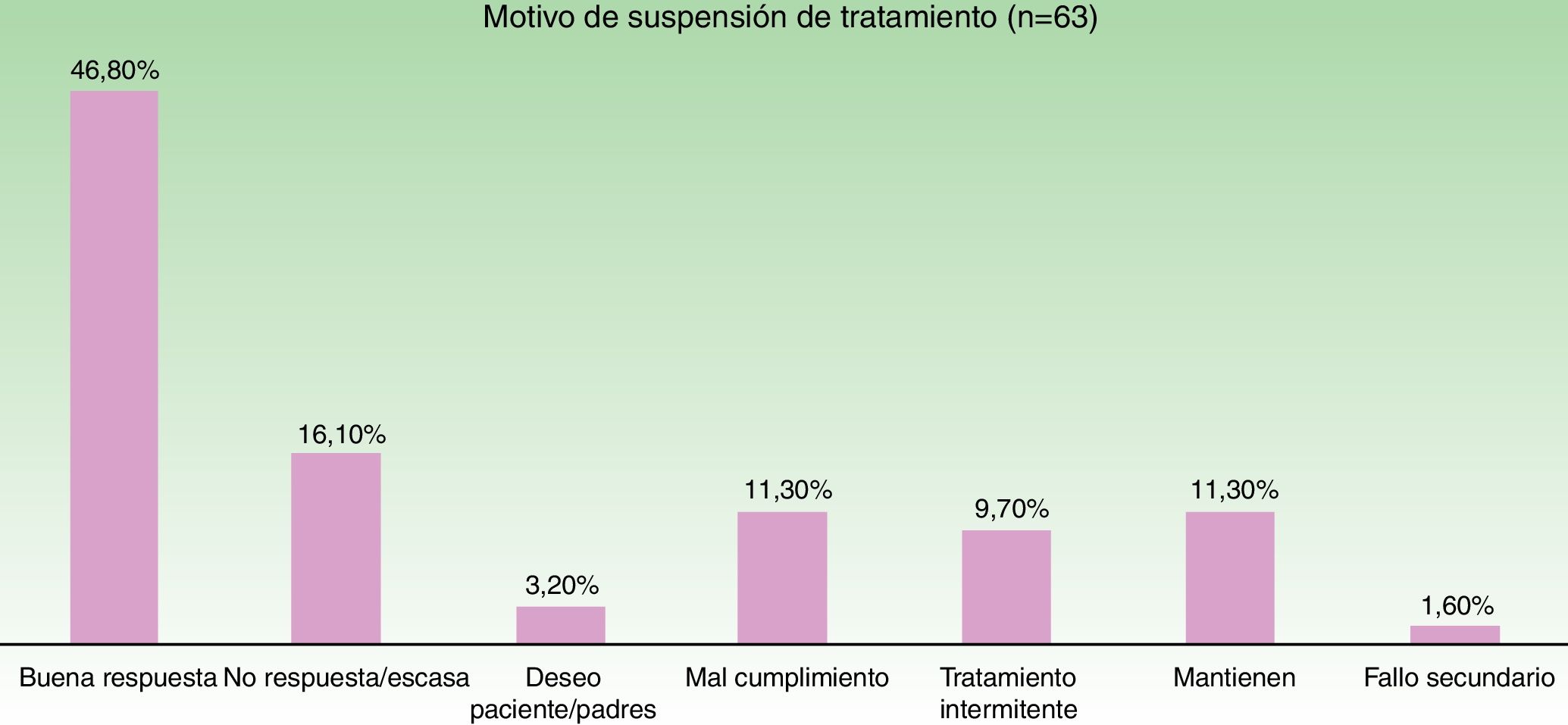
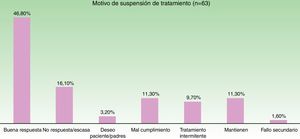
En la figura 3 se muestra la distribución de las razones que llevaron al cese del tratamiento. El motivo más frecuente fue la buena respuesta (47% de los casos).
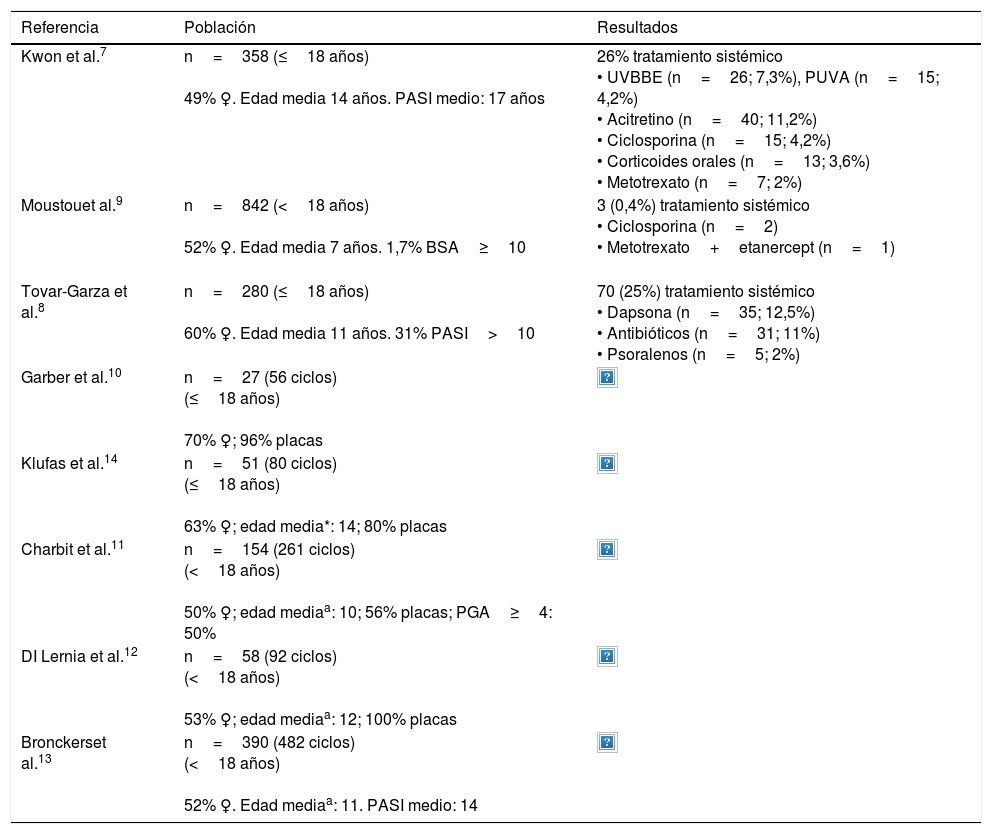
DiscusiónLos trabajos que evalúan los tratamientos en psoriasis moderada-grave en edad pediátrica y adolescente difieren metodológicamente y muestran resultados dispares (tabla 2).
Tratamientos sistémicos en psoriasis moderada-grave en niños y adolescentes: datos de estudios descriptivos7–14
| Referencia | Población | Resultados |
|---|---|---|
| Kwon et al.7 | n=358 (≤18 años) 49% ♀. Edad media 14 años. PASI medio: 17 años | 26% tratamiento sistémico • UVBBE (n=26; 7,3%), PUVA (n=15; 4,2%) • Acitretino (n=40; 11,2%) • Ciclosporina (n=15; 4,2%) • Corticoides orales (n=13; 3,6%) • Metotrexato (n=7; 2%) |
| Moustouet al.9 | n=842 (<18 años) 52% ♀. Edad media 7 años. 1,7% BSA≥10 | 3 (0,4%) tratamiento sistémico • Ciclosporina (n=2) • Metotrexato+etanercept (n=1) |
| Tovar-Garza et al.8 | n=280 (≤18 años) 60% ♀. Edad media 11 años. 31% PASI>10 | 70 (25%) tratamiento sistémico • Dapsona (n=35; 12,5%) • Antibióticos (n=31; 11%) • Psoralenos (n=5; 2%) |
| Garber et al.10 | n=27 (56 ciclos) (≤18 años) 70% ♀; 96% placas | |
| Klufas et al.14 | n=51 (80 ciclos) (≤18 años) 63% ♀; edad media*: 14; 80% placas | |
| Charbit et al.11 | n=154 (261 ciclos) (<18 años) 50% ♀; edad mediaa: 10; 56% placas; PGA≥4: 50% | |
| DI Lernia et al.12 | n=58 (92 ciclos) (<18 años) 53% ♀; edad mediaa: 12; 100% placas | |
| Bronckerset al.13 | n=390 (482 ciclos) (<18 años) 52% ♀. Edad mediaa: 11. PASI medio: 14 |
♀: sexo femenino; BSA: Body Surface Area; n: número de pacientes; PASI: Psoriasis Area and Severity Index; PGA: Physician Global Assessment; PUVA: ultravioleta A y psoraleno; UVBBE: ultravioleta B de banda estrecha.
aEdad media al inicio del tratamiento, expresada en años.
Un primer grupo de estudios descriptivos analizan datos clínico-epidemiológicos de niños con psoriasis de cualquier gravedad, y sin que sea su objetivo principal, indican los tipos de tratamientos utilizados. Kwon et al. evaluaron a 358 niños y adolescentes. El 26% recibieron tratamiento sistémico. Fototerapia y acitretino fueron las opciones más empleadas, seguidas de ciclosporina7. Tovar-Garza et al. muestran resultados similares con relación al porcentaje de tratamiento sistémico, que fue pautado en el 25% de 280 casos analizados. Sin embargo, los tratamientos empleados no coinciden con las recomendaciones de los documentos de consenso seguidos en nuestro medio, pues la dapsona fue el fármaco más frecuentemente utilizado, y los antibióticos, indicados ante psoriasis guttata, ocupaban el segundo lugar8. El estudio más numeroso incluye a 842 niños y adolescentes (edad media 7 años, el 2% con BSA≥10), de los cuales solo 3 recibieron tratamiento sistémico (2 ciclosporina y uno metotrexato en combinación con etanercept)9.
Otros estudios, más parejos a la metodología seguida en nuestro trabajo, analizan únicamente los casos de psoriasis en edad pediátrica en tratamiento con fármacos sistémicos. Destacan 5 trabajos (tabla 2), con poblaciones de entre 27 y 390 pacientes. Al igual que nuestro estudio, 3 de ellos incluyen la fototerapia entre las opciones de tratamiento evaluadas10–12. Metotrexato seguido de etanercept10,13, etanercept seguido de metroxato14, acitretino11 o ciclosporina12, son los fármacos mayoritarios según cada una de las series.
La posología de los citados tratamientos es similar en los distintos trabajos: fototerapia (ultravioleta B de banda estrecha o PUVA), 2-3 veces/semana; acitretino en dosis de 0,2-1mg/kg/día, metotrexato en dosis de 0,2-0,7mg/semana, ciclosporina en dosis de 2,5-5mg/kg/día y etanercept según ficha técnica (0,8mg/kg/semana hasta un máximo de 50mg/semana)3,12,15,16. Estos datos son concordantes con las pautas seguidas en los pacientes de nuestro estudio.
En los trabajos descriptivos previamente citados10–12,14, aunque con disparidad en el diseño y en el modo de expresar los resultados, se indican de modo general, para todos los grupos de tratamientos, respuestas satisfactorias. En cuanto a los fármacos más efectivos, Garber et al. observan mejores respuestas con fármacos biológicos frente a sistémicos convencionales y fototerapia, mientras que Charbit et al. indican una mayor tasa de respuestas para la combinación de fototerapia y acitretino, si bien solo 10 de 261 ciclos de tratamiento correspondieron a esta modalidad (tabla 3)10,11. En nuestra población de estudio, el porcentaje de buenos respondedores fue del 66% en la semana 12, disminuyendo al 32% en la semana 24. Los porcentajes ascienden si se aúnan respuestas buenas y parciales (88% en semana 12, 68% en semana 24).
Tratamientos sistémicos en psoriasis moderada-grave en niños y adolescentes: efectividad y seguridad según datos de estudios descriptivos10–12,14,15,17–30
| Referencia | Población | Efectividad | Efectos indeseables |
|---|---|---|---|
| Garber et al.10 | n=27 (56 ciclos) (≤18 años) | Aclaramiento: - Ada (4/6) y Etan (6/9): 66,7% - Ust (1/3): 33,3% - Convencionales: 0/28 (0%) S-MAPA 50%: - UVBBE 3/3 (100%), Mtx 4/11 (36,4%), CsA 2/3 (66,7%), Ada 6/6 (100%), Etan 7/9 (77,8%), Ust 2/3 (66,7), combinaciones (biológico+Mtx/CsA): 4/4 (100%) | Más frecuentes: - Mtx: 16% infecciones menores, 16% GI, 11% alteración PFH - Ada: 25% infecciones menores - Etan: 33% infecciones menores Motivaron suspensión: 2/56 (3,6%) - Mtx 1/19 (5%) - Ust 1/3 (33%) |
| Klufas et al.14 | n=51 (80 ciclos) (≤18 años) | PGA, 5-7 meses y 12 meses - Todos los grupos de tratamiento alcanzan respuesta positiva | 29/80 (36%), menores y subjetivos. Efecto indeseable más frecuente: fatiga (7,5%). «Pocos ciclos de tratamiento suspendidos por efectos indeseables» (no dan porcentaje exacto) |
| Charbit et al.11 | n=154 (261 ciclos) (<18 años) | PASI≥50: 59% de los sistémicos - Fototerapia+actitret mejores tasas de respuesta | 88/261 (33,7%) - Más frecuentes: acitret (52/116; 45%) Motivaron suspensión: 15/261(5,7%) - CsA: 5/25 (20%) - Mtx: 4/48 (8,3%) - Acitret: 6/142 (4,2%) |
| Di Lernia et al.12 | n=58 (92 ciclos) (<18 años) | No claramente especificada Se indican datos de suspensión por remisión completa, pero no se mide efectividad directamente | Motivaron suspensión: 19/92(10,9%) - PUVA: ninguno - Mtx: 1/13 (7,7%): elevación transaminasas - CsA: 8/38 (21,1%): GI, cefalea, elevación de Cr o Tg, piodermitis, hipertricosis - Acitret: 1/18 (5,6%): artralgias - Etan: ninguno |
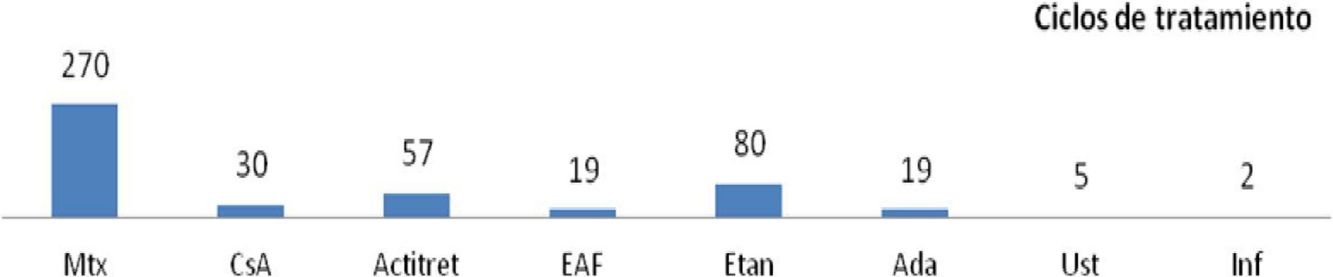
| Bronckers et al.13 | n=390 (482 ciclos) (<18 años) | La evaluación de la efectividad no es un objetivo de este trabajo | Menos frecuentes con anti-TNF que con Mtx - Mtx: 130/270 (48,1%): ≥1 (GI: n=67) - Biológicos: 41/106 (38,7%): 20/106 (18,9%): reacción local - Acitret 38/57 (66,7%) - Fumaratos 13/19 (68,4%) - CsA 11/30 (36,7%) Graves: - Mtx: n=3; EAF n=2; Ada: n=1 Motivaron suspensión: 47/390 (9,75%): - Mtx: 33/270 (12,2%) - CsA: 3/30 (10%) - Acitret: 6/57 (10,5%) - Biológicos: 3/106 (2,8%) - Fumaratos: 2/19 (10,5%) |
| Van Geel et al.15 | n=25 Mtx (<18 años) | PASI≥75: - Semana 12: 4,3%a/4%b - Semana 24: 33,3%a/32%b - Semana 36: 40%a/40%b - Semana 48: 28,6%a/28,6%b | Más frecuentes: náuseas graves (5/25, 20%), infecciones (5/25, 20%) y astenia (4/25, 16%) Suspensión: 6/25 (24%) |
| Kaur et al.19 | n=24 Mtx (<18 años) | PASI≥75: - 22/24 (91,7%) PASI50-75 - 2/24 (8,3%) | 9/24 (37,5%) efectos indeseables leves: náuseas, vómitos, pérdida de apetito No derivaron en suspensión |
| Collin et al.20 | n=13 Mtx (3-15 años) | Buena respuesta (definida como aclaramiento dejando mínima enfermedad residual) - 11/13 (84,6%) | Más frecuentes: GI: 6/13 (46,2%) Suspensión: 1/13 (7,7%)c: alteración de PFH |
| Di Lernia et al.17 | n=18 Acitret (<17 años) | PASI≥75: - 8/18 (44,4%) semana 16 | Más frecuentes mucocutáneos: 18/18 (100%): se manejaron con ajuste de dosis Suspensión: 1/18 (5,5%): artralgias |
| Dogra et al.21 | n=10 CsA (<18 años) | PASI≥75: - 5/8 (62,5%) semana 4 | 2/8 (25%): dolor abdominal, elevación Cr No motivaron suspensión |
| Ergun et al.18 | n=226 Acitret (n=61) Mtx (n=85) CsA (n=80) (<18 años) | PASI≥75: - 29/61 (47,5%) acitret - 29/85 (34,1%) Mtx - 32/80 (40%) CsA | Efectos indeseables menores: - Acitret: 29,3%: mucocutáneos (25,9%), hiperlipidemia (1,7%), náuseas (1,7%) - Mtx: 9,2%: náuseas, vómitos (8%), alteración de PFH (1,1%) - CsA: 22,5%: hiperlipidemia (3,8%), elevación Cr (1,3%), GI (1,3%) y citopenia (1,3%) Suspensión: - 1/61 (1,7%) acitret - 1/85 (1,1%) Mtx - 2/80 (2,5%) CsA |
| Di Lernia et al.16 | n=23 Etan (<18 años) | PASI≥75: - 56,5% semana 12 - 65,2% semana 24 - 52,1% semana 52 | Más frecuentes: - 2/23 (8,7%): reacción lugar inyección - 8/23 (34,7%): dolor leve área de inyección No motivaron suspensión |
| Ersoy-Evans et al.d22 | n=28 UVBBE (<18 años) | Mejoría mayor del 75%: 26/28 (92,9%) | Eritema 51,6%d Prurito 18%d Quemazón 9%d |
| Ersoy-Evans et al.d22 | n=30 UVB (<18 años) | Mejoría mayor del 75%: 28/30 (93,3%) | |
| Ersoy-Evans et al.d22 | n=7 PUVA (<18 años) | Mejoría mayor del 75%: 5/7 (71,4%) | |
| Jain et al. 23 | n=20 UVBBE (6-14 años) | Semana 12: - PASI≥90: 12/20 (60%) - PASI70-90: 3/20 (15%) | Eritema leve: 2/20 (10%) |
| Pasić et al.24 | n=20 UVBBE (6-14 años) | PASI≥90: 9/20 (45%) PASI70-90: 4/20 (20%) | Ninguno |
| Zamberk et al.25 | n=20 UVBBE (5-17 años) | PASI90: 52,2% PASI75-90: 17,4% | 35%: mayoritariamente eritema (no indican valor exacto) No motivaron suspensión |
| Pavlovsky et al.26 | n=79 UVBBE (≤18 años) | Aclaramiento: 40/79 (50,6%) Mejoría≥75%: 33/79 (41,8%) | 18/79 (22,8%): - Eritema leve (13/18, 72,2%), prurito (2/18, 11,1%), quemadura de primer grado (3/18, 16,7%) |
| Jury et al.e27 | n=35 UVBBE (≤16 años) | Aclaramiento o enfermedad residual mínima: 22/35 (62,9%) | Eritema (23/77; 28,6%), ampollas (5/77; 6,5%), herpes zóster (1/77; 1,3%), ansiedad (5/77; 6,5%)e |
| Tan et al.f28 | n=38 UVBBE (<16 años) | Mejoría del 75% o aclaramiento: 90% | Eritema leve (36%)f No motivaron suspensión |
| Eustace et al.29 | n=21 UVBBE (≤17 años) | Aclaramiento (PASI90 o PGA 0-1): 86,7% | Eritema (5/21; 23,8%), VHS (2/21; 9,5%) |
| Wong et al.30 | n=12 UVBBE | Mejoría en BSA≥90%: 5/10 (50%) Mejoría en BSA 70-90%: 4/10 (40%) | Quemadura leve (1/12; 8,3%), quemazón (1/12; 8,3%), prurito (2/12; 16,7%), dolor (2/12; 16,7%), eritema 2/12; 16,7%). Suspensión: 1/12 (8,3%): aumento progresivo de eritema |
Acitret: acitretino; Ada: adalimumab; CsA: ciclosporina; BSA: Body Surface Area; Cr: creatinina; EAF: ésteres del ácido fumárico; Etan: etanercept; GI: gastrointestinales; Mtx: metotrexato; n: número de pacientes; PASI: Psoriasis Area and Severity Index; PFH: pruebas de función hepática; PGA: Physician Global Assessment; PUVA: ultravioleta A y psoraleno; S-MAPA: simple measure for assessing psoriasis activity: medida que resulta del producto del BSA y el PGA; Tg: triglicéridos; TNF: tumoral necrosis factor (factor de necrosis tumoral); Ust: ustekinumab; UVB: ultravioleta B; UVBBE: ultravioleta B de banda estrecha; VHS: virus herpes simple.
aAs treated (por tratamiento).
bLast observation carried forward (traslación de los datos según la última observación disponible).
c2/18 (11,1%) si se consideran todos los ciclos de tratamiento (n=18).
d,e,fTrabajos que incluyen pacientes con psoriasis y otras dermatosis (n=113d, n=77e, n=116f); los efectos indeseables corresponden al total de los pacientes incluidos en dichos estudios (no se indican los datos específicos del grupo de psoriasis).
En la mayoría de las series, los efectos indeseables son leves y escasos. El porcentaje de efectos indeseables que motiva suspensión del tratamiento oscila entre un 4 y un 11% (tabla 3)10–14. Recientemente, Bronckers et al., en un estudio retrospectivo de 390 menores de 18 años, observaban que el porcentaje de efectos indeseables era menor con agentes biológicos que con metotrexato, aunque la presencia de infecciones era mayor con los primeros. Con relación a los fármacos biológicos destacaban las reacciones en el área de inyección (20/106) y con relación a metotrexato, las alteraciones gastrointestinales (67/270). El porcentaje de efectos indeseables graves fue del 2% (3 asociados a metotrexato, 2 a ésteres del ácido fumárico y uno a adalimumab)13.
Otros estudios revelan datos de efectividad y efectos indeseables evaluando un único fármaco o pocos fármacos (tabla 3). El momento de evaluación de la respuesta, la escala utilizada para medir la efectividad y el número de pacientes son heterogéneos, pero se extraen porcentajes de buenos respondedores de en torno al 40% tanto para metotrexato, como para acitretino y ciclosporina15,17,18. Trabajos menos recientes evidenciaban respuestas más favorables para metotrexato19,20. Del mismo modo, se han indicado porcentajes de respuesta del 62% para ciclosporina21. Este dato debe ser tenido en cuenta con cautela, ya que se trata de una población de 10 pacientes, en los que la efectividad de ciclosporina se evalúa en la semana 4. Di Lernia et al. analizan datos de efectividad de etanercept en población menor de 18 años, en práctica clínica. Observan que el 65% de los pacientes alcanzan un PASI75 en la semana 2416.
Todos estos trabajos coinciden nuevamente en la presencia de efectos indeseables escasos, con necesidad de suspensión del fármaco en menos del 4% de los casos15–21.
Con respecto a la fototerapia, se ha documentado aclaramiento total o mejoría mayor del 70% en más del 60% de los casos, y se describen efectos secundarios menores (eritema, prurito o quemazón, presencia de ampollas, o reactivación del virus herpes simple)22–30. En la población del estudio que presentamos, la fototerapia alcanzó buenas respuestas en más del 80% de los ciclos de tratamiento, siendo mínimos los efectos secundarios.
Nuestro trabajo no está exento de limitaciones. Contamos con un número pequeño de pacientes y los datos se analizan con carácter retrospectivo, por lo que dependen de lo previamente registrado en las historias clínicas. Son pues necesarios más estudios, preferentemente de carácter prospectivo y con mayor número de pacientes, para confirmar y añadir información a nuestros hallazgos.
ConclusiónEn nuestro medio, en la población menor de 18 años con psoriasis, la fototerapia fue el tratamiento más utilizado, seguida de metotrexato. Los tratamientos evaluados consiguen un porcentaje de buenos respondedores del 66% en la semana 12 (incluida fototerapia), y del 32% en la semana 24 (fármacos sistémicos sin fototerapia), presentando un buen perfil de seguridad.
Conflicto de interesesAna Batalla: actividades de formación patrocinadas por Abbvie, LeoPharma, Novartis y Pierre-Fabre. Investigadora de ensayos clínicos promovidos por Lilly y Novartis.
Rosa Fernández-Torres: actividades de formación patrocinadas por Abbvie, LeoPharma, Janssen, Novartis y Pfizer. Investigadora de ensayos clínicos promovidos por Janssen y Novartis.
Laura Rodríguez-Pazos: investigadora de ensayos clínicos promovidos por Novartis.
Romina Rodríguez Lojo: actividades de formación patrocinadas por Abbvie, Brystol-Myers y Roche. Investigadora de ensayos clínicos promovidos por Janssen y Novartis.
Ánder Zulaica: actividades formativas, ensayos clínicos o de consultoría patrocinados o promovidos por Abbvie, Almirall, Celgene, Janssen, Leo-Pharma, MSD, Novartis y Pfizer.
Miguel Cabanillas: actividades de formación patrocinadas por Abbvie, Janssen, Leo-Pharma y Pfizer. Investigador de ensayos clínicos promovidos por Abbvie y Novartis.
Eduardo Fonseca Capdevila ha participado en actividades de formación o ensayos clínicos patrocinados o promovidos por Abbvie, Almirall, Celgene, Janssen, Novartis y Pfizer.
Álvaro León: actividades de formación patrocinadas por LeoPharma, Novartis y Pierre-Fabre.
Luisa Fernández-Díaz: actividades de formación, investigación o asesoramiento patrocinadas por Abbvie, Celgene, Gebro-Pharma, Janssen, LeoPharma, Lilly, MSD, Novartis y Pfizer.
María José Seoane-Pose: investigadora de ensayos clínicos promovidos por Abbvie y Novartis.
Hugo Vázquez-Veiga: proyectos de investigación, actividades formativas y de consultoría patrocinadas por Almirall, Celgene, Leo-Pharma, Lilly, Janssen, MSD y Novartis.
Teresa Abalde: actividades de formación patrocinadas por Celgene, LeoPharma, Janssen, MSD, Novartis, Pfizer. Investigadora de ensayos clínicos promovidos por Almirall, Janssen y Novartis.
Laura Salgado-Boquete: actividades de formación o asesoría científica patrocinadas por Abbvie, Celgene,Janssen, Lilly, Medea, MSD; Novartis, Pfizer. Investigadora de ensayos clínicos promovidos por Abbvie, Almirall, Janssen y Novartis.
Ignacio Suárez-Conde: investigador en ensayo clínico promovido por Novartis.
Ángeles Flórez: proyectos de investigación, actividades formativas y de consultoría patrocinadas por Almirall, Celgene, Leo-Pharma, Lilly, Janssen, MSD y Novartis.
Los restantes autores no refieren conflicto de intereses.