Existe una tendencia creciente entre los gestores sanitarios y los farmacéuticos hospitalarios a insistir en la sustitución de fármacos, y en especial biológicos que comparten indicación terapéutica en función de una pretendida «equivalencia clínica» y consideraciones de eficiencia (eficacia/coste), a menudo con escasa o nula participación de los clínicos. Cuando no se dispone de ensayos clínicos comparativos (head-to-head) de diversos fármacos, se puede emplear el análisis comparativo indirecto para definir diferentes fármacos como «alternativas de tratamiento equivalentes». Que 2 fármacos se consideren «alternativas de tratamiento equivalentes» no demuestra que sean «equivalentes terapéuticos» o «terapéuticamente equivalentes»; para ello es preciso que en la mayoría de los pacientes no existan diferencias significativas (en todos los aspectos) que hagan que uno sea preferible al otro en determinadas situaciones. Aunque los pacientes en la vida real no sean totalmente comparables con los que participan en ensayos clínicos, la elección de un agente biológico en el tratamiento de la psoriasis viene determinada en gran medida por los resultados de los mismos. Empleando los datos de un reciente metaanálisis se comprueba que, en contra de la afirmación de sus autores, los tratamientos biológicos disponibles para la psoriasis moderada a grave no pueden considerarse alternativas terapéuticas equivalentes (en ningún caso por lo que respecta al par infliximab/etanercept). Existen diferencias reales en cuanto a eficacia en diferentes momentos y velocidad de inicio del efecto de los diferentes agentes biológicos disponibles, y en cualquier caso la decisión terapéutica debe ser tomada por un clínico experimentado de forma individualizada para cada paciente.
Health care managers and hospital pharmacists are increasingly compelling prescribers to use medication substitutes. This policy becomes particularly evident when the agents are biologics with shared indications based on their assumed clinical equivalence and efficiency (cost-effectiveness), and in these cases the involvement of clinicians in decision making is often minimal or nonexistent. Lacking head-to-head clinical trials comparing various drugs, the prescriber can use indirect comparisons to define 2 or more agents as clinically equivalent therapeutic alternatives. This denomination of clinical equivalence does not imply that 2 such medications are truly therapeutically equivalent, or therapeutic equivalents, as this type of equivalence is defined by the absence of statistically significant differences between the drugs on all measures of effect in most patients, meaning that neither one is preferable to the other in different situations. Although real patients are not entirely comparable to those in clinical trials, the choice of a biologic agent to treat psoriasis is largely based on the findings of such trials. A recently published meta-analysis shows that not all the biologics currently available to treat moderate to severe psoriasis can be considered therapeutic equivalents, in spite of the authors’ claim to the contrary; indeed, infliximab and etanercept can in no way be considered equivalent therapeutic alternatives based on the data provided. Biologics do display real differences with respect to efficacy at different time points and in the time required to onset of effect. In any case, therapeutic decisions should be made by an experienced clinician and tailored to each individual patient.
Existe un interés creciente por evaluar la eficacia relativa de alternativas terapéuticas, que podría conllevar, como en el caso de los biosimilares, un ahorro de costes y una mayor accesibilidad para los pacientes, lo que debería constituir un objetivo prioritario para el médico prescriptor. Si en el caso de los genéricos la equivalencia clínica se correlaciona directamente con la identidad química y la equivalencia farmacológica (biodisponibilidad, etc.), existen claras dificultades para determinar la extrapolación de indicaciones y la intercambiabilidad en los biosimilares, a pesar de lo cual existe una tendencia creciente entre los gestores sanitarios y los farmacéuticos hospitalarios a plantear la sustitución de biológicos que comparten indicación terapéutica en función de una pretendida «equivalencia clínica» y consideraciones de eficiencia (eficacia/coste).
Los dermatólogos y otros especialistas observamos con preocupación creciente esta posibilidad, incompatible con la necesaria individualización del tratamiento y basada en análisis efectuados por profesionales sin la adecuada competencia clínica, y que en ocasiones adolecen de errores conceptuales o metodológicos. Esta circunstancia la ilustra una reciente publicación basada en un metaanálisis, en la que se llega a la conclusión de que todos los biológicos actualmente disponibles para el tratamiento de la psoriasis son «clínicamente equivalentes» porque los intervalos de confianza del 95% (IC 95%) de las diferencias de riesgo absoluto de alcanzar una respuesta en el Psoriasis Area and Severity Index (PASI) de 75 (mejoría superior al 75% con respecto al PASI basal) no alcanzan el «umbral de relevancia clínica» del 25% preestablecido por los autores1.
Cuando no se dispone de ensayos clínicos comparativos (head-to-head) de diversos fármacos, solo pueden efectuarse inferencias sobre la comparabilidad de su eficacia de forma indirecta mediante metaanálisis de los ensayos clínicos disponibles.
Para establecer la equivalencia en cuanto a eficacia de 2 o más tratamientos es fundamental definir lo que se conoce como «relevancia clínica» Sin embargo, existe cierta confusión entre este concepto (que determina el parámetro de eficacia con trascendencia clínica a evaluar, por ejemplo la supervivencia del paciente, una reducción de tensión arterial, el blanqueamiento de la psoriasis, un valor de PASI o un determinado porcentaje de reducción con respecto al valor basal) y otros parámetros como:
- a)
La reducción del riesgo absoluto con respecto al placebo o «riesgo diferencial» (diferencia en los porcentajes de pacientes que alcanzan el parámetro de eficacia en un momento predefinido del ensayo clínico).
- b)
El «tamaño del efecto», que cuantifica la magnitud de la diferencia entre 2 o más grupos de un ensayo clínico, y que generalmente se expresa en forma de odds ratio (OR) o bien de número de pacientes que hay que tratar ([NNT], correspondiente al valor absoluto del recíproco del riesgo diferencial) para conseguir el parámetro de eficacia.
- c)
El valor de delta, o diferencia entre el porcentaje de respuesta entre los 2 grupos a comparar que determina la hipótesis nula (no diferencia, no inferioridad, etc.) y permite calcular, para una determinada probabilidad de error de tipo i-que consiste en rechazar una hipótesis nula verdadera, equivalente a un falso positivo (α) -y de tipo ii-que consiste en no rechazar una hipótesis nula falsa, equivalente a un falso negativo (β)-, el tamaño de la muestra en un ensayo clínico.
Probablemente por su formación, alejada de la clínica y la dermatología, los autores de este metaanálisis no conocen bien el significado de la «mínima diferencia clínicamente relevante»2 o «umbral de significación clínica», que no es en absoluto sinónimo del valor delta que permite calcular los tamaños de muestra necesarios en los ensayos clínicos para descartar una hipótesis nula con un determinado grado de significación estadística, ni tampoco del valor delta que se emplea en las comparaciones indirectas de tratamientos que se discuten más adelante.
Por definición, una diferencia o umbral clínicamente relevante refleja la mínima mejoría absoluta o relativa en un parámetro de eficacia que puede ser detectada por el paciente y/o el médico (y es, por tanto, clínicamente relevante); por ejemplo, un valor absoluto de PASI, o una mejoría relativa del mismo, pero en ningún caso una tasa o porcentaje de una población (como la tasa de respuesta PASI 75), ni tampoco el riesgo diferencial entre los brazos de un ensayo clínico, o entre las intervenciones en un metaanálisis.
Tal vez los autores han confundido relevancia clínica con tamaño del efecto. El tamaño del efecto cuantifica la magnitud de la diferencia observada entre 2 grupos (por ejemplo, tratamiento activo/placebo), y por lo tanto puede decirse que es una medida real de la significación de la diferencia observada, que no debe confundirse con la «significación estadística», que es la probabilidad de que la diferencia observada entre los 2 grupos pueda ser un accidente de muestreo, resultado del azar, y que se expresa como «p». El valor de p depende esencialmente de 2 factores: el tamaño del efecto y el tamaño de la muestra. Se puede obtener un resultado estadísticamente «significativo» cuando el efecto es muy grande, aunque la muestra sea pequeña, o cuando la muestra es muy grande, aunque el efecto sea pequeño. En los metaanálisis se proporciona información sobre el tamaño del efecto (en forma de OR, por ejemplo, con su margen de error probable, o IC 95%); cuando los IC mayor y menor de las OR o los NNT (referidos a placebo) de 2 fármacos no se superponen, o cuando el IC del riesgo relativo no cruza el valor 1 (en comparaciones de 2 fármacos), puede afirmarse que el tamaño de su efecto es diferente (y por tanto, no puede hablarse de «equivalencia clínica» en cuanto a eficacia). Esto es lo que ocurre en los metaanálisis de los biológicos empleados para el tratamiento de la psoriasis3–5, y no tiene ningún sentido predefinir un «umbral de relevancia clínica» del 10, el 25 o el 30%, a gusto del autor: los tamaños de los efectos son diferentes o no, y punto.
En el ámbito de la farmacología clínica se está empleando de forma creciente el análisis comparativo indirecto, por ejemplo mediante el método de Bucher6, para definir diferentes fármacos como «alternativas de tratamiento equivalentes». Para ello se dispone de calculadoras7 y se emplean metaanálisis8 que comparan los resultados (para un determinado parámetro de eficacia o outcome y en un determinado momento de evaluación o endpoint) de los diferentes ensayos clínicos con respecto a un fármaco de referencia. Para comparar los resultados, cuando se expresan en forma de riesgo diferencial, se define un valor delta arbitrario que se considera la máxima diferencia que se puede considerar clínicamente relevante (no es lo mismo que la «mínima diferencia clínicamente relevante» o «umbral de significación clínica»). Por poner una analogía, el coste anual de un tratamiento puede ser superior a otro (que tuviera exactamente la misma eficacia) en por ejemplo 500€, pero si definimos 1.000€ como la mínima diferencia clínicamente relevante, aunque uno sea más caro que el otro ambos pueden considerarse «alternativas de tratamiento equivalentes» desde el punto de vista del coste de adquisición. El valor de delta es en todo caso arbitrario; generalmente son valores comprendidos entre el 10 y el 15% cuando se emplean reducciones absolutas de riesgo expresadas en porcentajes, aunque depende mucho del riesgo diferencial con respecto a placebo que se detecte en el metaanálisis.
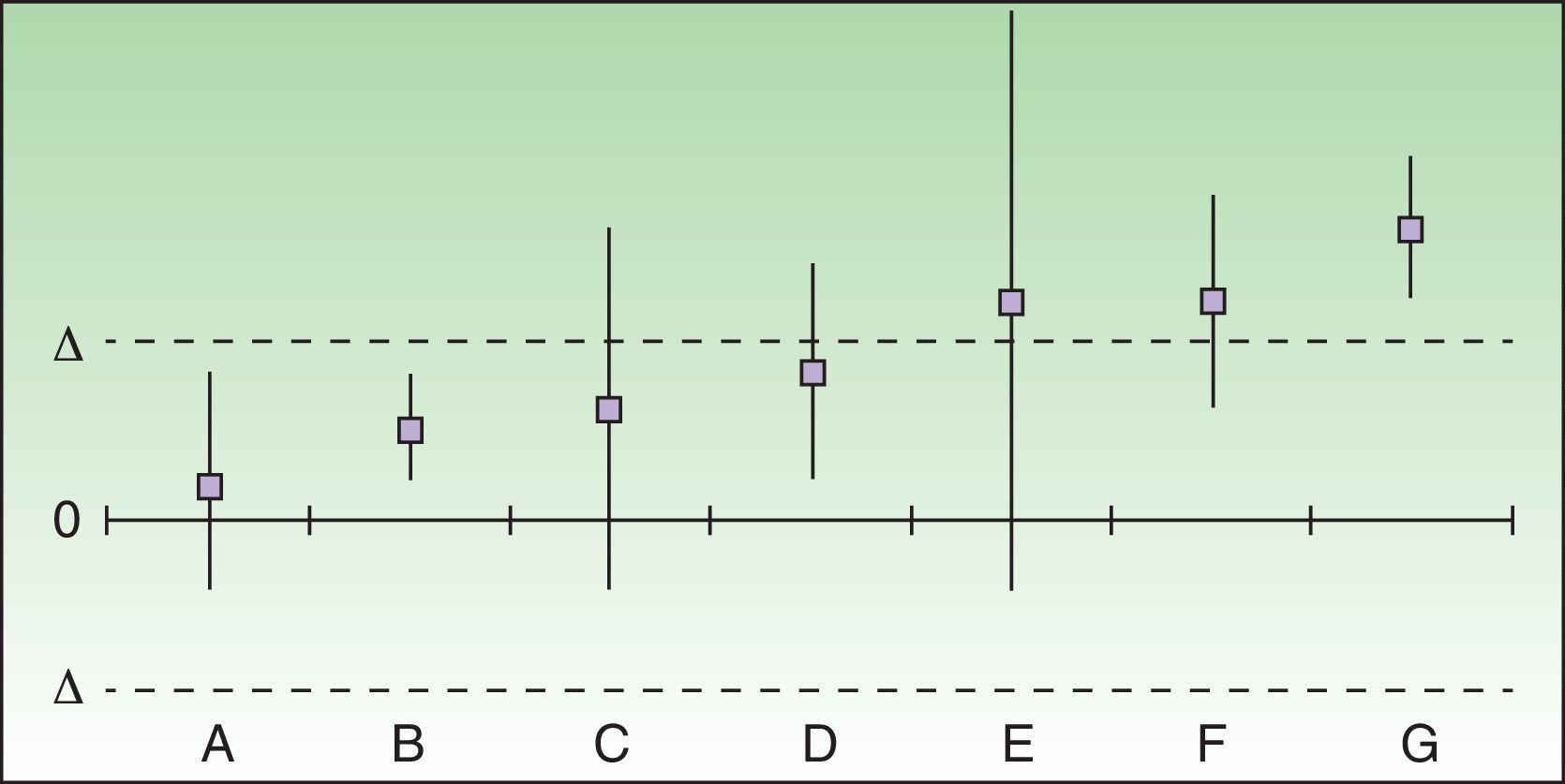
Los resultados de los análisis de equivalencia tienen en cuenta las diferencias entre los riesgos diferenciales de cada fármaco con respecto a placebo, con su IC 95%, y se representan en una gráfica en la que 0 es la ausencia de diferencia y delta es el valor de «corte» preestablecido, posicionando de esta forma los fármacos (fig. 1).
Evaluación y posicionamiento de 2 fármacos como «alternativas de tratamiento equivalentes». En los casos A y B 2 fármacos pueden considerarse como alternativas de tratamiento equivalentes aunque el fracaso implique un daño grave o irreversible para el paciente. En los casos dudosos o no concluyentes (C-E) no se puede considerar que sean alternativas de tratamiento equivalentes si el fracaso implica un daño grave o irreversible para el paciente, pero podría aceptarse que lo fueran, de forma condicional, en el caso opuesto. F y G, con la diferencia de riesgo diferencial superando la delta predefinida, no podrían considerarse alternativas de tratamiento equivalentes en ningún caso.
En una publicación muy reciente referida al tratamiento con biológicos de la artritis psoriásica se emplea la mitad del riesgo diferencial con respecto a la respuesta ACR50 según el metaanálisis (16%)9, pero es muy discutible que un fármaco cuya probabilidad de respuesta sea la mitad que la de otro sea una «alternativa de tratamiento equivalente». En el caso de la psoriasis, en el que para la respuesta PASI 75 cabe esperar riesgos diferenciales entre el 60 y 78% a la semana 24 para la mayoría de los biológicos, una delta del 10% (alrededor de un 15% del riesgo diferencial global) podría ser razonable.
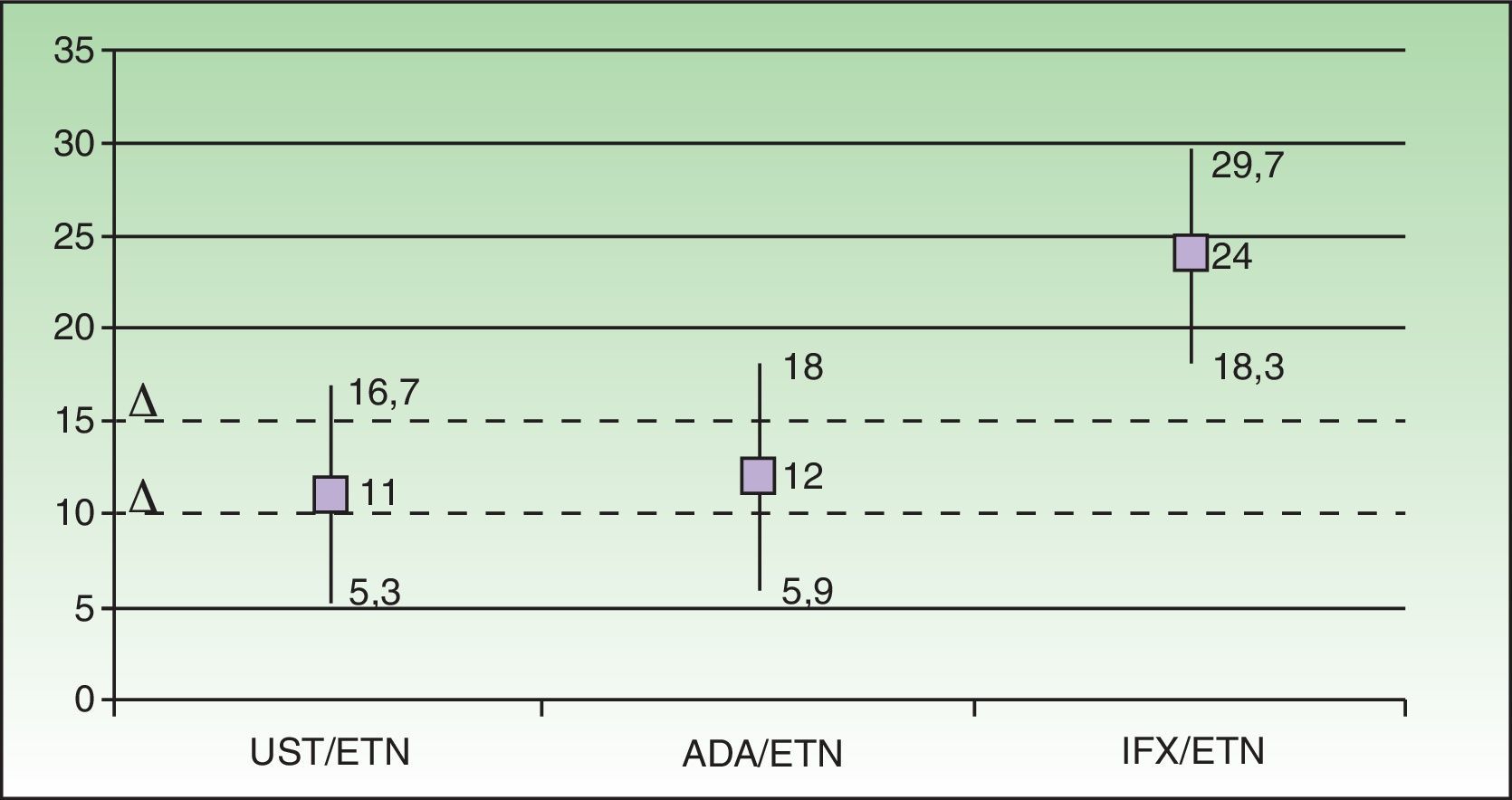
En la figura 2 se muestra, empleando los datos del metaanálisis de Galván-Banquieri et al.1, que los tratamientos biológicos disponibles para la psoriasis moderada a grave no pueden considerarse alternativas terapéuticas equivalentes (en ningún caso por lo que respecta al par infliximab/etanercept).
Evaluación y posicionamiento de los fármacos biológicos disponibles para la psoriasis según el metaanálisis de Galván-Banqueri et al.1 asumiendo una delta de 10% como definitoria de «alternativa de tratamiento equivalente». En la comparación indirecta ustekinumab resulta superior a etanercept (riesgo diferencial relativo a etanercept [RD] 11% [IC 95% 5,3-16,7]), al igual que adalimumab (RD 12%, IC 95% 5,9-18) e infliximab (RD 24%, IC 95%: 18,3-29,7). Empleando una delta de 10% los pares ustekinumab/etanercept (UST/ETN) y adalimumab/etanercept (ADA/ETN) corresponden a los supuestos F de la figura 1, y el par infliximab/etanercept (IFX/ETN) corresponde al supuesto G. Empleando una delta de 15% los supuestos correspondientes son D, D y G. En ningún caso puede afirmarse que todos los biológicos con indicación para psoriasis moderada a grave sean alternativas de tratamiento equivalentes.
Que 2 fármacos se consideren «alternativas de tratamiento equivalentes» no demuestra que sean «equivalentes terapéuticos» o «terapéuticamente equivalentes»; para ello es preciso que en la mayoría de los pacientes no existan diferencias significativas (en todos los aspectos) que hagan que uno sea preferible al otro en determinadas situaciones.
Estamos completamente de acuerdo con Galván-Banqueri et al.1 en que la elección del agente biológico en la psoriasis viene determinada en gran medida por su perfil de seguridad relativo, contraindicaciones y consideraciones farmacoeconómicas, pero existen diferencias reales en cuanto a eficacia3–5 y velocidad de inicio de su efecto10, y en cualquier caso la decisión terapéutica debe ser tomada por un clínico experimentado de forma individualizada para cada paciente, teniendo en cuenta diversos factores tales como el peso, las comorbilidades (incluyendo la artritis) asociadas y la conveniencia de la administración para el paciente2. Tal vez en un futuro próximo serán alcanzables en la mayoría de los pacientes respuestas de blanqueamiento completo o casi completo, que sin duda alguna son verdaderamente relevantes, y no tendremos que preocuparnos en definir el «umbral de significación clínica» en esta enfermedad que tanto afecta a la calidad de vida de nuestros pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor ha recibido honorarios en concepto de asesorías y/o conferencias de Abbvie, Boehringer, Janssen, Merck-Serono, MSD, Novartis y Pfizer. He participado en ensayos clínicos patrocinados por Abbvie, Amgen, Janssen, Lilly, MSD, Novartis, Pfizer y VBL.


![Evaluación y posicionamiento de los fármacos biológicos disponibles para la psoriasis según el metaanálisis de Galván-Banqueri et al.1 asumiendo una delta de 10% como definitoria de «alternativa de tratamiento equivalente». En la comparación indirecta ustekinumab resulta superior a etanercept (riesgo diferencial relativo a etanercept [RD] 11% [IC 95% 5,3-16,7]), al igual que adalimumab (RD 12%, IC 95% 5,9-18) e infliximab (RD 24%, IC 95%: 18,3-29,7). Empleando una delta de 10% los pares ustekinumab/etanercept (UST/ETN) y adalimumab/etanercept (ADA/ETN) corresponden a los supuestos F de la figura 1, y el par infliximab/etanercept (IFX/ETN) corresponde al supuesto G. Empleando una delta de 15% los supuestos correspondientes son D, D y G. En ningún caso puede afirmarse que todos los biológicos con indicación para psoriasis moderada a grave sean alternativas de tratamiento equivalentes. Evaluación y posicionamiento de los fármacos biológicos disponibles para la psoriasis según el metaanálisis de Galván-Banqueri et al.1 asumiendo una delta de 10% como definitoria de «alternativa de tratamiento equivalente». En la comparación indirecta ustekinumab resulta superior a etanercept (riesgo diferencial relativo a etanercept [RD] 11% [IC 95% 5,3-16,7]), al igual que adalimumab (RD 12%, IC 95% 5,9-18) e infliximab (RD 24%, IC 95%: 18,3-29,7). Empleando una delta de 10% los pares ustekinumab/etanercept (UST/ETN) y adalimumab/etanercept (ADA/ETN) corresponden a los supuestos F de la figura 1, y el par infliximab/etanercept (IFX/ETN) corresponde al supuesto G. Empleando una delta de 15% los supuestos correspondientes son D, D y G. En ningún caso puede afirmarse que todos los biológicos con indicación para psoriasis moderada a grave sean alternativas de tratamiento equivalentes.](https://static.elsevier.es/multimedia/00017310/0000010500000005/v1_201405270041/S0001731013002834/v1_201405270041/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)



