La alopecia frontal fibrosante (AFF) es un tipo de alopecia cicatricial primaria adquirida, descrita por Kossard en 1994, cuya incidencia ha aumentado en los últimos años. Se caracteriza clínicamente por una recesión de la línea de implantación frontotemporal del cabello, acompañada frecuentemente por alopecia de las cejas. La AFF fue inicialmente descrita en mujeres posmenopáusicas y premenopáusicas con antecedentes personales de histerectomía o menopausia precoz, por lo que se propuso un origen hormonal de la enfermedad. Sin embargo, en los últimos años se han publicado estudios en varones, así como en mujeres premenopáusicas que cuestionan dicha etiología. A pesar de que las manifestaciones clínicas de la AFF son muy características, desde el punto de vista histopatológico los hallazgos son similares al liquen plano pilaris, por lo que actualmente es considerada como una variante clínica de este último. Hasta el momento no se han realizado ensayos clínicos sobre las diferentes alternativas de tratamiento en pacientes con AFF. En los estudios observacionales publicados se valora el uso de múltiples fármacos, siendo los inhibidores de la 5-alfa-reductasa y los corticoides intralesionales los que mejor resultado han obtenido hasta el momento, seguidos por los antipalúdicos y los inhibidores de la calcineurina. Esta revisión analiza de forma exhaustiva la información más recientemente publicada sobre la etiopatogenia, la clínica, el diagnóstico y el tratamiento de los pacientes con AFF.
Frontal fibrosing alopecia (FFA) is an increasingly common acquired primary scarring alopecia, first described by Kossard in 1994. Clinically it is characterized by frontotemporal hairline recession, frequently accompanied by eyebrow loss. FFA was initially thought to have a hormonal origin as it was first described in postmenopausal women and premenopausal women with a history of hysterectomy or early menopause. This origin, however, has been questioned in recent years due to the publication of cases in men and premenopausal women. Although FFA has a highly characteristic clincal pattern, it is histologically similar to lichen planopilaris, and is currently believed to be a clinical variant of this condition. No clinical trials to date have investigated the efficacy of treatments for FFA. Numerous drugs, however, have been assessed in observational studies, and the best results to date have been reported for 5-αreductase inhibitors and intralesional corticosteroids, followed by antimalarials and calcineurin inhibitors. In this article, we review the latest data on the etiology, pathogenesis, clinical presentation, diagnosis, and treatment of FFA.
La alopecia frontal fibrosante (AFF) es un tipo de alopecia cicatricial primaria adquirida1, descrita por Kossard en 19942, cuya incidencia ha aumentado en los últimos años. La AFF se caracteriza clínicamente por una recesión de la línea de implantación frontotemporal del cabello, acompañada por alopecia de las cejas en muchas ocasiones2,3. Al tratarse de una alopecia cicatricial estos cambios son de carácter irreversible, lo cual repercute de forma llamativa en la confianza y en la calidad de vida de los pacientes afectados4. A pesar de que las manifestaciones clínicas de la AFF son muy características, desde el punto de vista histopatológico los hallazgos son idénticos a los observados en el liquen plano pilaris (LPP)3, por lo que actualmente es considerada por algunos autores como una variante clínica de este último1.
EtiopatogeniaLa AFF afecta mayoritariamente a mujeres posmenopáusicas con una edad media de 60 años; sin embargo, está descrita la afectación de varones5–10, así como de mujeres premenopáusicas8–14, siendo una mujer de 23 años la paciente más joven en que se ha observado la enfermedad10. A pesar de un llamativo aumento en su incidencia desde su descripción original2, la etiología de la AFF permanece aún desconocida. El papel de las hormonas sexuales en el desarrollo de AFF ha sido propuesto por diversos autores, y se piensa que actuarían induciendo una disminución del crecimiento del cabello, al estimular el paso de los folículos pilosos en fase de anagen a fase de telogen15,16. Estudios posteriores han corroborado esta hipótesis en función de la respuesta favorable obtenida con el uso de fármacos antiandrógenos en pacientes con esta enfermedad10,11,16–18, y a la elevada proporción de pacientes con menopausia precoz (14% frente al 6% de la población general)10, histerectomizadas (11-21%)10,12,14, con alopecia androgenética (AAG) asociada (40% en algunas series)10,15 y con ooforectomía (asociación hasta el momento sin consistencia demostrada)19. Sin embargo, esta teoría hormonal también ha sido cuestionada en los estudios publicados en varones y en mujeres premenopáusicas, ya que el mecanismo patogénico entre la AAG y la AFF difiere (miniaturización versus inflamación y fibrosis)20, se ha comprobado que la terapia hormonal sustitutiva no evita ni ralentiza el curso de la enfermedad3, y los estudios hormonales realizados a pacientes con AFF han confirmado que no existe una elevación de andrógenos ni otras alteraciones hormonales en sangre periférica3,10.
Por otro lado, la asociación de AFF con enfermedades autoinmunes, como el hipotiroidismo (11-23% de las pacientes con AFF frente a 4,2% de la población general)9,10,12,13, el vitíligo21 o el síndrome de Sjögren13 sugieren una etiología autoimmune. En el caso del LPP se ha observado una buena respuesta al tratamiento corticoideo, la presencia de autoanticuerpos en algunos casos, y la influencia de ciertos fármacos en la presentación de epítopos de los folículos pilosos al sistema inmune. Sin embargo, la AFF difiere del LPP en este punto, ya que en ningún caso se han detectado anticuerpos específicos en título suficiente en estos pacientes, y hasta la fecha no existen evidencias en la literatura que apoyen un origen autoimmune de la enfermedad22.
Tampoco se ha conseguido demostrar un componente genético en la etiopatogenia de la AFF, pero sí se ha observado una relación familiar en algunas series, existiendo antecedentes familiares de la enfermedad en cerca del 8% de los pacientes publicados9,10,21,23. Además, un estudio reciente realizado en 4 familias afectadas por la enfermedad24, que analizó 8 casos de madre e hija con AFF, encontró que todas las madres tenían AFF posmenopáusica y todas las hijas habían desarrollado la enfermedad antes de la menopausia, sugiriendo que los antecedentes familiares de la enfermedad podrían asociarse a un inicio más temprano de la AFF.
Finalmente, aunque se han publicado casos aislados de AFF asociada a procedimientos quirúrgicos como trasplante capilar o lifting facial, en los que se ha postulado una respuesta inmune secundaria a un proceso de Koebner como posible factor etiológico, el número de pacientes descritos en la literatura es aún demasiado bajo como para establecer una relación consistente3,14,25,26.
Al igual que la etiología, la patogénesis de la AFF continúa sin estar clara. Parece que es el conjunto de múltiples procesos lo que desencadena y conduce a la progresión de la enfermedad. Los experimentos de laboratorio en ratones han demostrado que la reversibilidad de la AFF depende exclusivamente del daño a las células madre epiteliales del folículo piloso27. Y es precisamente alrededor de estas células donde se observa una mayor densidad del infiltrado inflamatorio. Además, se ha identificado una disminución de la expresión de citoqueratina 15, que es un marcador de células madre epiteliales del folículo piloso28,29 en biopsias de AFF. Las células madre epiteliales se localizan en un área específica del folículo piloso conocida como bulge, que constituye un nicho con privilegio inmunitario4,22,28,30,31, al estar rodeada por linfocitos T, células de Langerhans, macrófagos y péptidos antimicrobianos como beta-2-defensina, psoriasina, catelicidina y RNAasa7, que bloquearían el paso a agentes externos nocivos32. Todo lo anterior, junto con una inmunosupresión local inducida por la ausencia de MHC I y II y beta-2-microglobulina en las células madre4,33, y por la secreción de inmunosupresores endógenos como TFGbeta, hormona estimuladora de melanocito alfa y cortisol31,33,34, impedirían la inflamación excesiva que pudiera dañar a las células madre de los folículos pilosos. En esta línea, Harries et al.35 han demostrado un aumento de moléculas MHC de clase i y ii, beta-2-microglobulina e INFγ4 en las áreas alopécicas de pacientes con AFF, lo que expondría a las células madre a las células T citotóxicas del infiltrado inflamatorio y favorecería su destrucción.
El papel de las glándulas sebáceas en la patogenia de la AFF también ha sido investigado por diferentes autores, ya que la pérdida de estas es llamativamente más frecuente en las alopecias cicatriciales que en las no cicatriciales (55% y 5% respectivamente)36. En condiciones normales, las glándulas sebáceas influyen en los cambios que la vaina radicular externa experimenta durante el ciclo piloso37,38, de forma que su alteración puede favorecer el desarrollo de una alopecia cicatricial. En pacientes con AFF se ha observado inflamación de los ductos glandulares por daño citotóxico, que podría contribuir al desarrollo de la enfermedad36. Además, estudios recientes han demostrado que ratones con una deficiencia del receptor de peroxisoma-proliferador-activado gamma (PPAR-γ), que influye en el metabolismo lipídico, presentan unas manifestaciones clínicas similares al LPP, por lo que el PPAR-γ se postula como un mediador importante en la AFF, que podría ser la diana de futuras estrategias terapéuticas22,28,39.
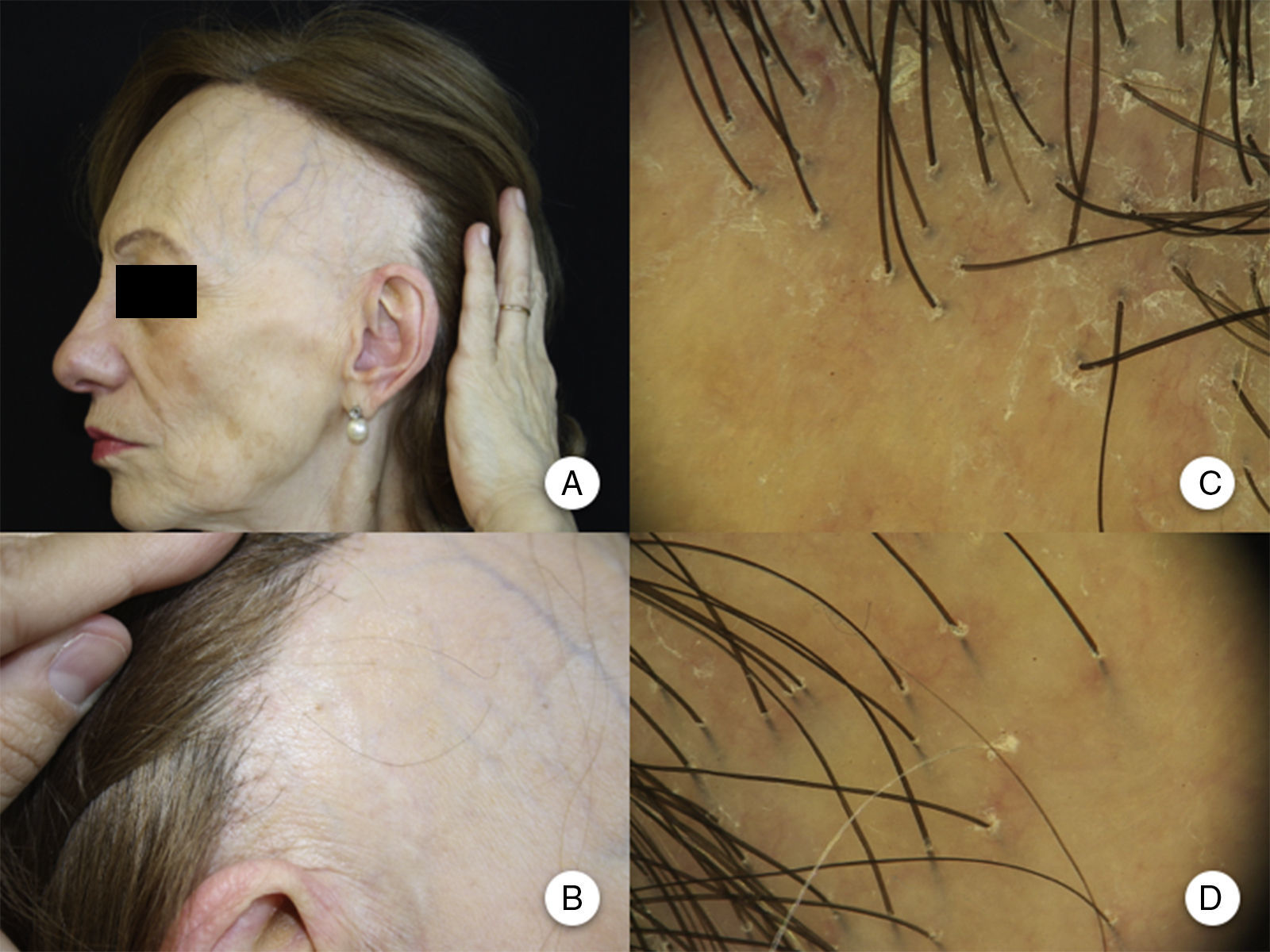
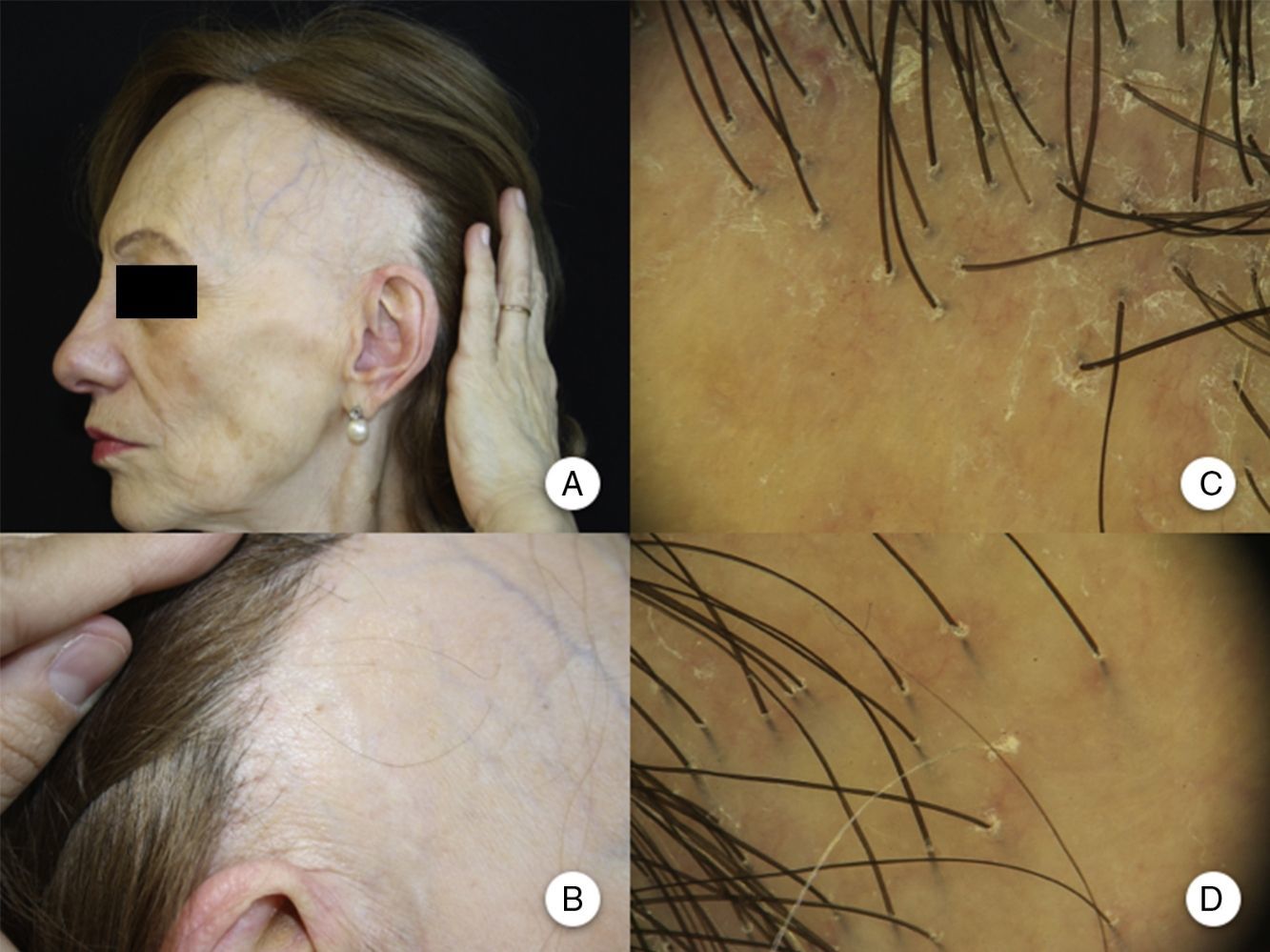
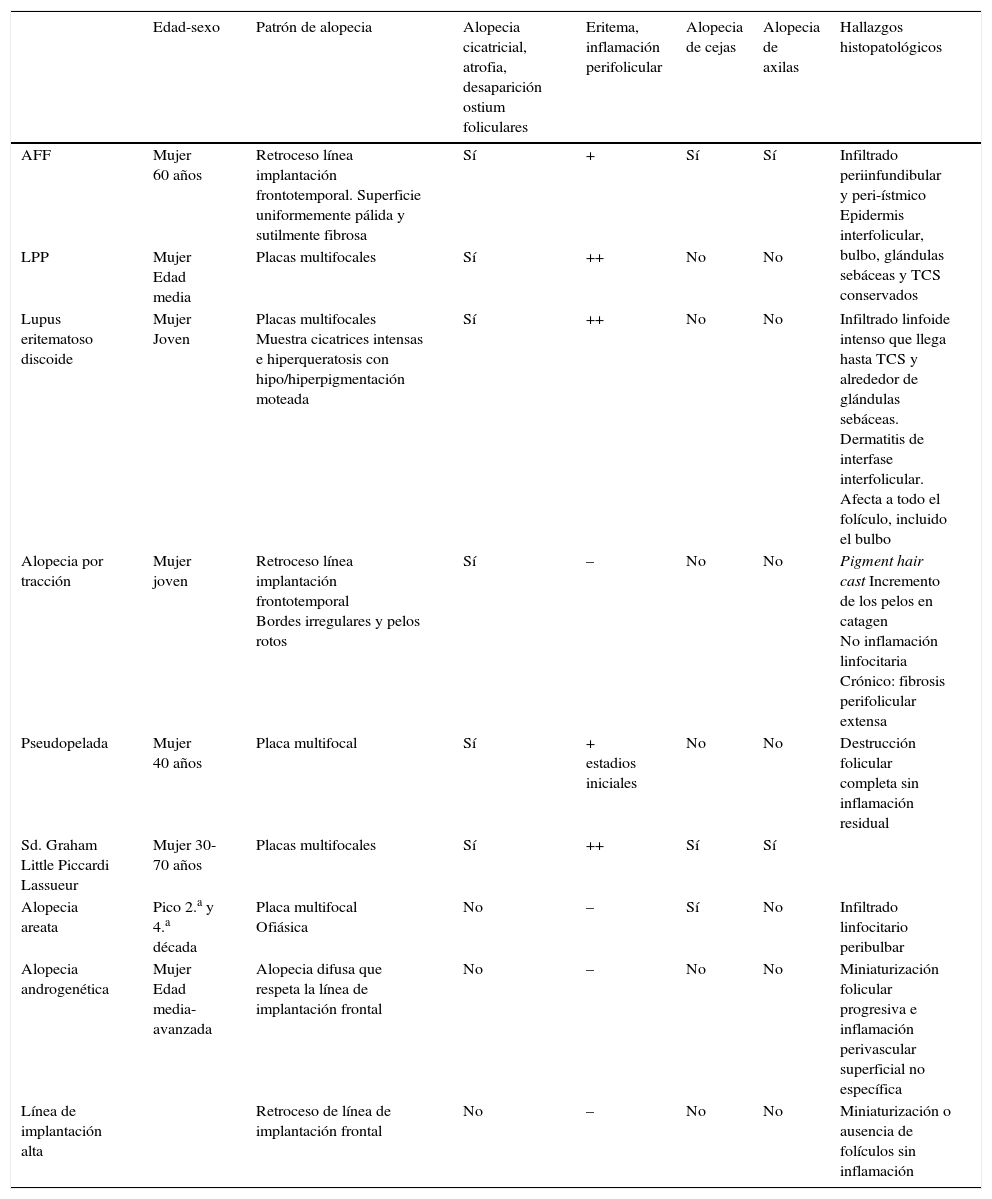
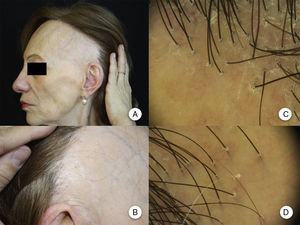
Manifestaciones clínicasRecesión de la línea de implantación capilarLa manifestación clínica más constante es la recesión de la línea de implantación frontotemporal del cabello20, que se produce de manera simétrica y bilateral, llegando en ocasiones a extenderse a la región retroauricular3, sin que sea imprescindible una continuidad entre esta región y la banda de alopecia frontal13 (figs. 1A y B). La piel de la zona alopécica presenta cambios cicatriciales irreversibles en su superficie, destacando una piel lisa, con pérdida de los orificios foliculares y una palidez uniforme, que contrasta con las regiones adyacentes, en las que se observa la pigmentación propia del daño actínico crónico acorde a la edad del paciente2. En la zona de transición entre ambas es frecuente apreciar eritema inter o perifolicular en el 50% de los pacientes, con hiperqueratosis folicular en un 30-60% y sin que estos cambios se acompañen de induración o esclerosis10,20.
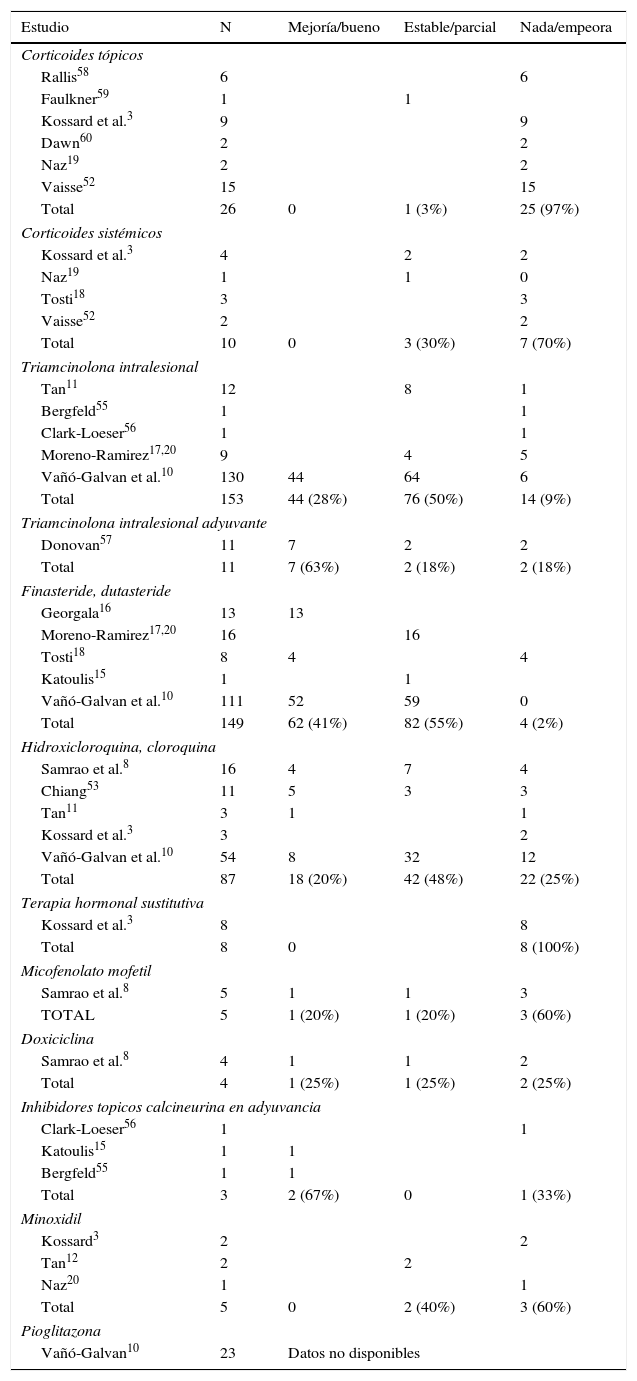
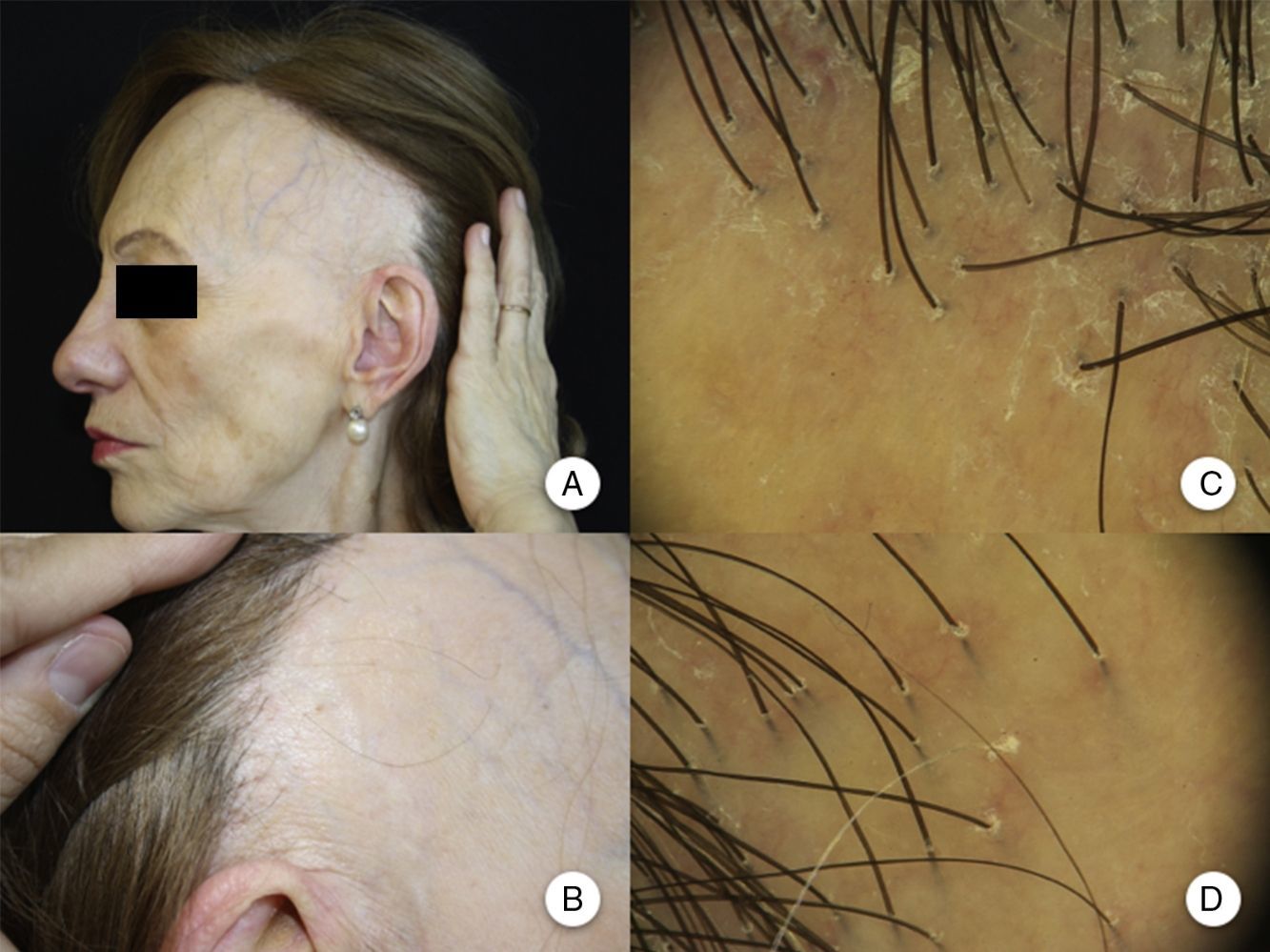
Manifestaciones clínicas en la alopecia frontal fibrosante. A. Se observa recesión de la línea de implantación frontotemporal del cabello, que se extiende a la región retroauricular. B. La piel de la zona alopécica presenta cambios cicatriciales en su superficie, con pérdida de los orificios foliculares, palidez uniforme y visualización de la red vascular. C. Imagen con tricoscopia de la línea de implantación frontal del cabello, en la que se observa ausencia de los ostium foliculares, eritema, descamación perifolicular y capilares ramificados. D. Imagen con tricoscopia de la región retroauricular en la que se observan cambios similares a la anterior.
La presentación de la alopecia en la AFF es habitualmente asintomática, dificultando así el diagnóstico precoz20. Sin embargo, algunos pacientes pueden referir prurito e incluso dolor, que están presentes en el 20% y 35% de los casos, según las series10. Además, aunque lo más característico es la afectación de la línea de implantación frontotemporal del cabello, diversos estudios10,13 describen afectación de la región occipital en el 7% y 14% de los pacientes. En concreto, el estudio de Vañó-Galvan et al. es el que reúne un mayor número de pacientes varones hasta la fecha, y sus datos reflejan un mayor porcentaje de afectación occipital que en mujeres (33% frente a 13%), aunque sin llegar a ser estadísticamente significativo10. Estos datos son importantes de cara al tratamiento, especialmente en el caso del trasplante capilar, que puede ser menos efectivo si existe afectación occipital40.
La distancia de recesión de la línea de implantación capilar puede oscilar desde 0,5 hasta 8cm3, aunque alrededor del 75% de los pacientes10 presentan una recesión menor de 3cm. De hecho, Vañó-Galván et al. encontraron una correlación estadísticamente significativa entre la distancia de recesión y el tiempo de evolución de la enfermedad10. Finalmente, la evolución de la AFF puede variar hacia la estabilización sin necesidad de tratamiento3,11,12,17, la estabilización tras la retirada del tratamiento14 o la rápida progresión, que puede acabar en alopecia «en forma de payaso»20, o con la afectación de todo el cuero cabelludo12.
Afectación de las cejasLa afectación de las cejas se considera hoy en día una manifestación clínica más de la AFF, ya que, si bien no está presente en el 100% de los casos, sí que se puede observar en un alto porcentaje de los pacientes, llegando en algunos estudios hasta el 95%14. Este rasgo se presenta como característica clínica de inicio en un 20-48% de los pacientes con AFF, precediendo a la alopecia frontal hasta 8 años en uno de los casos publicados13. Por tanto, la alopecia de las cejas permitiría el diagnóstico precoz de la enfermedad en el 15-39% de los pacientes con AFF, y se suele relacionar con formas moderadas de la enfermedad10,13.
El grado de afectación de las cejas también es variable, siendo lo más característico la pérdida de cabello en la región lateral, que puede progresar a una alopecia total o casi total de ambas cejas. En los casos en los que la pérdida no es completa se observa una disminución de la densidad de la ceja restante, rasgo similar al que se suele observar en la alopecia areata, y que puede dificultar el diagnóstico diferencial entre ambos procesos20. Finalmente, aunque en algunos casos aislados se ha observado un leve eritema perifolicular, lo más frecuente es una pérdida de las cejas sin asociar clínica inflamatoria significativa ni descamación evidente13.
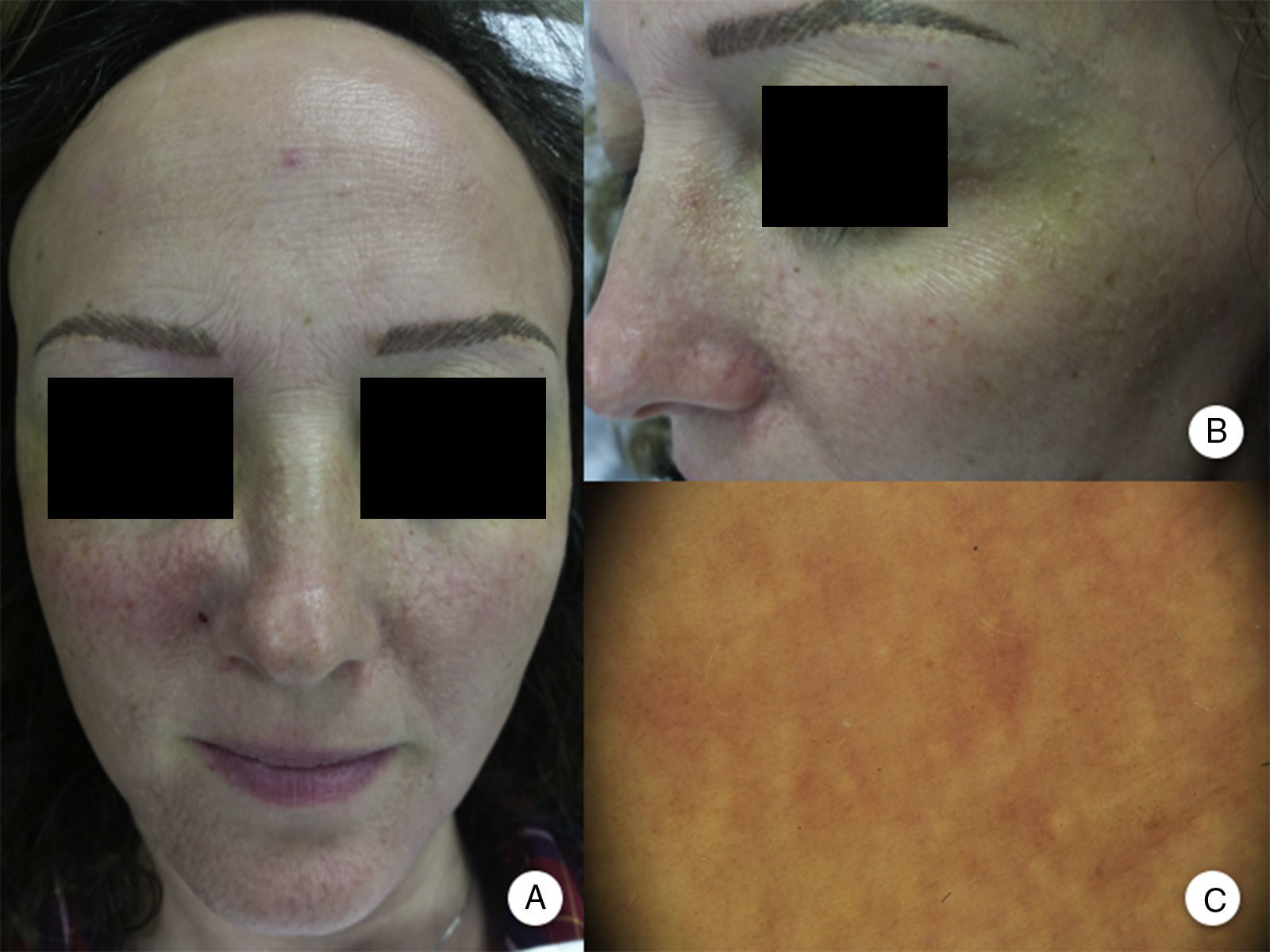
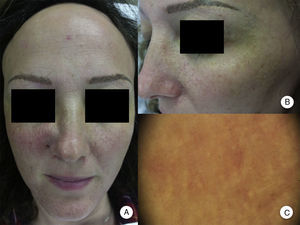
Afectación de otras zonas pilosasLa pérdida de las pestañas se observa en el 14-26% de los pacientes10,14. La afectación del vello facial, así como la presencia de pápulas faciales, se ha descrito en el 6-37% de los casos, y la afectación de la barba en el 50% de los varones10,12,14. La afectación del vello corporal se observa en el 25% de los pacientes con AFF, siendo las regiones más frecuentemente afectadas las axilas, el pubis y las extremidades13. Además, la pérdida conjunta del vello corporal y las pestañas, junto con la aparición de pápulas faciales, se ha asociado con formas graves de AFF, y ha sido considerado por algunos autores como indicador pronóstico y marcador de inicio de tratamiento sistémico10. De hecho, aunque se han descrito frecuentemente las pápulas perifoliculares en la línea de progresión de la alopecia del cuero cabelludo, las pápulas faciales en la AFF son mucho menos frecuentes, y no fueron descritas hasta el año 2009 como pápulas foliculares monomorfas, no inflamatorias, de color piel, aspecto rugoso o áspero, y sin eritema ni descamación asociados (fig. 2). Estas pápulas representan la afectación del vello facial, contrastando con la alopecia del vello corporal en la AFF, que es subclínica.
Pápulas faciales en la alopecia frontal fibrosante. A. Se aprecian pápulas foliculares no inflamatorias, monomorfas, color piel, de aspecto rugoso o áspero y sin eritema ni descamación asociados. B. Detalle de las pápulas faciales. C. Con dermatoscopia se aprecian puntos blancos foliculares, sobre la red vascular que se observa habitualmente a nivel facial.
En las regiones corporales afectadas por la AFF, al igual que en las cejas, no se suele observar reacción inflamatoria ni descamación. Además, en ocasiones, no se llega a una alopecia completa, sino que se manifiesta como una pérdida de densidad capilar en esa zona, asociada a leve atrofia cutánea y eritema perifolicular2,11. Finalmente, la afectación del vello corporal puede acompañarse de hiperqueratosis folicular en algunas ocasiones, por lo que muchos de los pacientes diagnosticados finalmente de AFF habían sido valorados en consultas de dermatología por síndrome de Graham-Little.
Otras manifestacionesLa prevalencia de AAG en pacientes con AFF ha sido analizada en varios estudios bajo la hipótesis de un origen hormonal común a ambos tipos de alopecia; sin embargo, existe controversia en la literatura al respecto, ya que unos estudios no encuentran relación entre AFF y AAG11,13,14, mientras que otros encuentran asociación hasta en el 40% de los pacientes y en el 67% de los pacientes varones10,17.
Finalmente, otras manifestaciones clínicas de AFF recientemente descritas son los puntos rojos glabelares41, la depresión de las venas frontales42 y las máculas pigmentadas faciales43.
DiagnósticoLas manifestaciones clínicas de la AFF una vez establecida son muy características; sin embargo, en estadios iniciales de la enfermedad el diagnóstico diferencial con otros tipos de alopecia puede ser complejo. En estos casos pueden resultar de utilidad otras técnicas diagnósticas complementarias como la tricoscopia o la histopatología10,44. La tabla 1 resume las principales características clínicas e histopatológicas de AFF que pueden ayudar en el diagnóstico diferencial con otras alopecias.
Diagnóstico diferencial de la alopecia frontal fibrosante
| Edad-sexo | Patrón de alopecia | Alopecia cicatricial, atrofia, desaparición ostium foliculares | Eritema, inflamación perifolicular | Alopecia de cejas | Alopecia de axilas | Hallazgos histopatológicos | |
|---|---|---|---|---|---|---|---|
| AFF | Mujer 60 años | Retroceso línea implantación frontotemporal. Superficie uniformemente pálida y sutilmente fibrosa | Sí | + | Sí | Sí | Infiltrado periinfundibular y peri-ístmico Epidermis interfolicular, bulbo, glándulas sebáceas y TCS conservados |
| LPP | Mujer Edad media | Placas multifocales | Sí | ++ | No | No | |
| Lupus eritematoso discoide | Mujer Joven | Placas multifocales Muestra cicatrices intensas e hiperqueratosis con hipo/hiperpigmentación moteada | Sí | ++ | No | No | Infiltrado linfoide intenso que llega hasta TCS y alrededor de glándulas sebáceas. Dermatitis de interfase interfolicular. Afecta a todo el folículo, incluido el bulbo |
| Alopecia por tracción | Mujer joven | Retroceso línea implantación frontotemporal Bordes irregulares y pelos rotos | Sí | – | No | No | Pigment hair cast Incremento de los pelos en catagen No inflamación linfocitaria Crónico: fibrosis perifolicular extensa |
| Pseudopelada | Mujer 40 años | Placa multifocal | Sí | + estadios iniciales | No | No | Destrucción folicular completa sin inflamación residual |
| Sd. Graham Little Piccardi Lassueur | Mujer 30-70 años | Placas multifocales | Sí | ++ | Sí | Sí | |
| Alopecia areata | Pico 2.a y 4.a década | Placa multifocal Ofiásica | No | – | Sí | No | Infiltrado linfocitario peribulbar |
| Alopecia androgenética | Mujer Edad media-avanzada | Alopecia difusa que respeta la línea de implantación frontal | No | – | No | No | Miniaturización folicular progresiva e inflamación perivascular superficial no específica |
| Línea de implantación alta | Retroceso de línea de implantación frontal | No | – | No | No | Miniaturización o ausencia de folículos sin inflamación |
El hallazgo característico en la tricoscopia de la AFF es una marcada disminución de los ostium foliculares en la zona central del área alopécica, acompañado de eritema, con descamación perifolicular en la periferia de la placa. Además, se ha descrito la presencia de capilares ramificados, red de pigmento con patrón en «panal de abejas», parches y puntos blancos y pelos vellosos (figs. 1C y D)10. En 2012 Mireles-Rocha et al.45 describieron también la presencia de puntos azul-gris rodeando a algunas unidades foliculares, que hasta entonces se habían descrito únicamente en LPP. La correlación histopatológica exacta de estos hallazgos tricoscópicos no está del todo establecida, pero se acepta que los puntos gris-blanquecino se suelen observar en áreas con mayor fibrosis, o más evolucionadas; mientras que los puntos gris-azulado se deben a la presencia de melanófagos en la dermis papilar como consecuencia de la dermatitis de interfase e incontinencia pigmentaria que se observa en el LPP y el lupus eritematoso44–46.
En el caso del estudio histopatológico es importante tener en cuenta que en etapas tardías de la enfermedad la biopsia tendrá una rentabilidad escasa, ya que los hallazgos serán similares a otras alopecias cicatriciales11. Para conseguir hallazgos histopatológicos más específicos será necesario estudiar lesiones recientes en las que se observen signos de progresión de la enfermedad, y que en la biopsia se incluyan folículos pilosos, pápulas perifoliculares si existen, y que se realicen además cortes transversales de las muestras20.
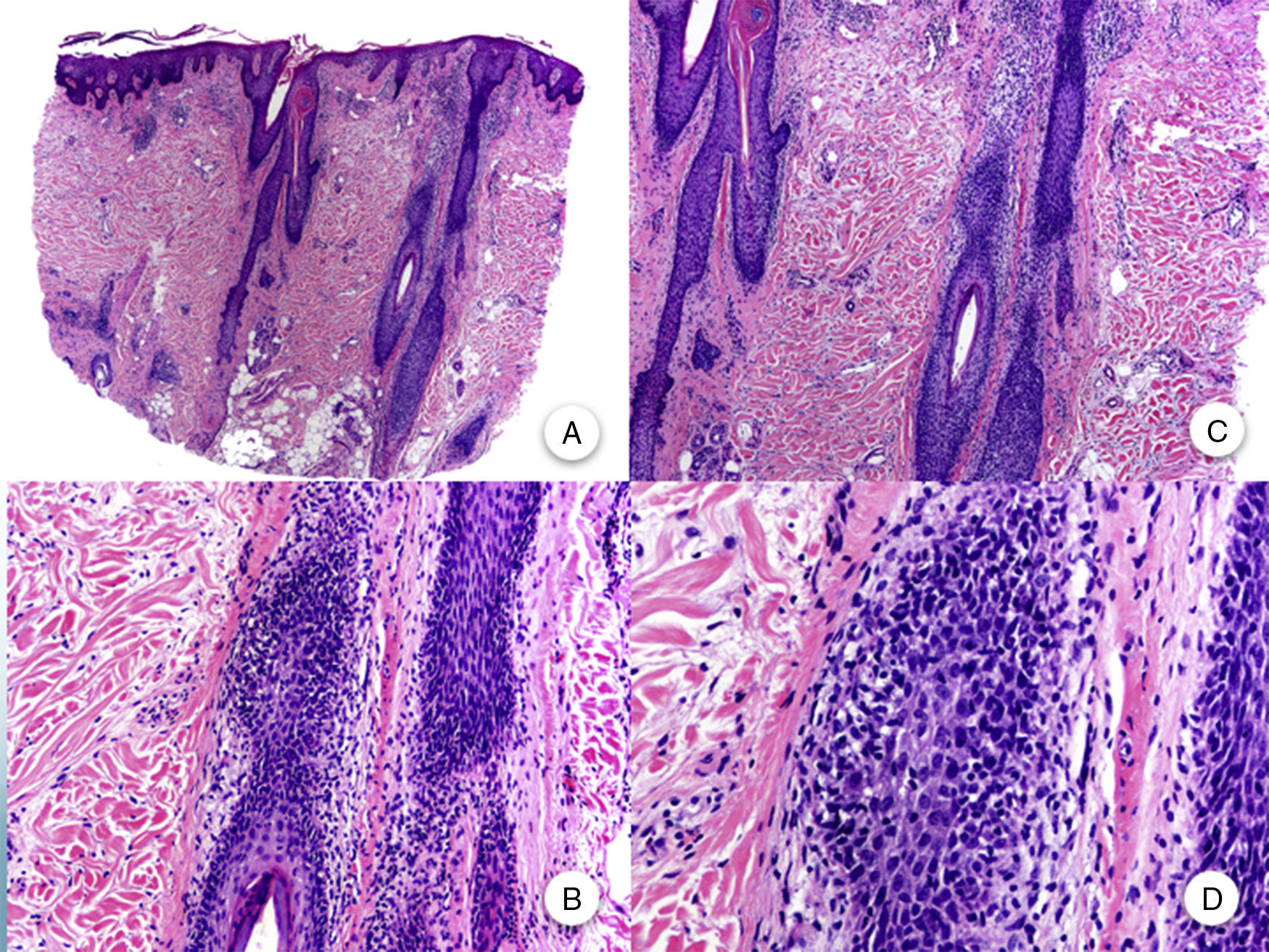
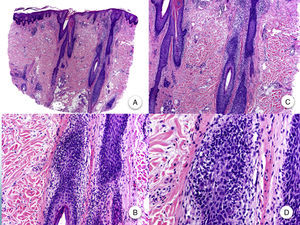
La AFF se considera una alopecia cicatricial primaria linfocítica, debido a la presencia de un infiltrado inflamatorio linfocitario de hábito liquenoide, que se localiza preferentemente en las regiones infundibulares e ístmicas del folículo piloso, y que respeta la epidermis interfolicular11,20,47. A pesar de que en algunos artículos se hace hincapié en la mayor afectación de los folículos intermedios y vellosos11, hoy en día se acepta que los folículos terminales se ven afectados de igual manera que los anteriores47. El infiltrado inflamatorio se acompaña de una degeneración vacuolar de la capa basal del epitelio folicular y de una apoptosis eosinófila prominente de las células de la vaina radicular externa, a nivel del infundíbulo y del istmo48. Es a este nivel donde se localiza la zona del bulge, que alberga las células madre pluripotenciales del folículo, por lo que el daño generado en esta área ocasiona una alopecia cicatricial irreversible47. La destrucción folicular propicia que restos apoptóticos de la vaina radicular externa, el tallo piloso y la cutícula queden atrapados en la dermis, favoreciendo una reacción granulomatosa a cuerpo extraño47. También se observa una dilatación e hipergranulosis del infundíbulo folicular. Según avanza la enfermedad, el infiltrado inflamatorio desaparece y los cambios anteriores ocasionan una progresiva fibrosis perifolicular de tipo lamelar «en capas de cebolla», que sustituirá los folículos pilosos por tractos fibrosos, y que clínicamente se corresponde con áreas de alopecia total y pérdida de los orificios foliculares (fig. 3)3,11. A pesar de la palidez uniforme que se aprecia clínicamente en estas áreas2, es significativa la ausencia de elastosis solar desde el punto de vista histopatológico11. Además, la porción inferior del folículo piloso, las glándulas sudoríparas y el tejido celular subcutáneo están preservados3.
Histopatología de la alopecia frontal fibrosante. A y B. En cortes longitudinales se observa infiltrado perifolicular (H-E ×10, H-E ×100, figuras A y B, respectivamente). C y D. A mayor aumento se observa una fibrosis concéntrica perifolicular e infiltrado linfocitario en la periferia (H-E ×200, H-E ×400, figuras C y D, respectivamente).
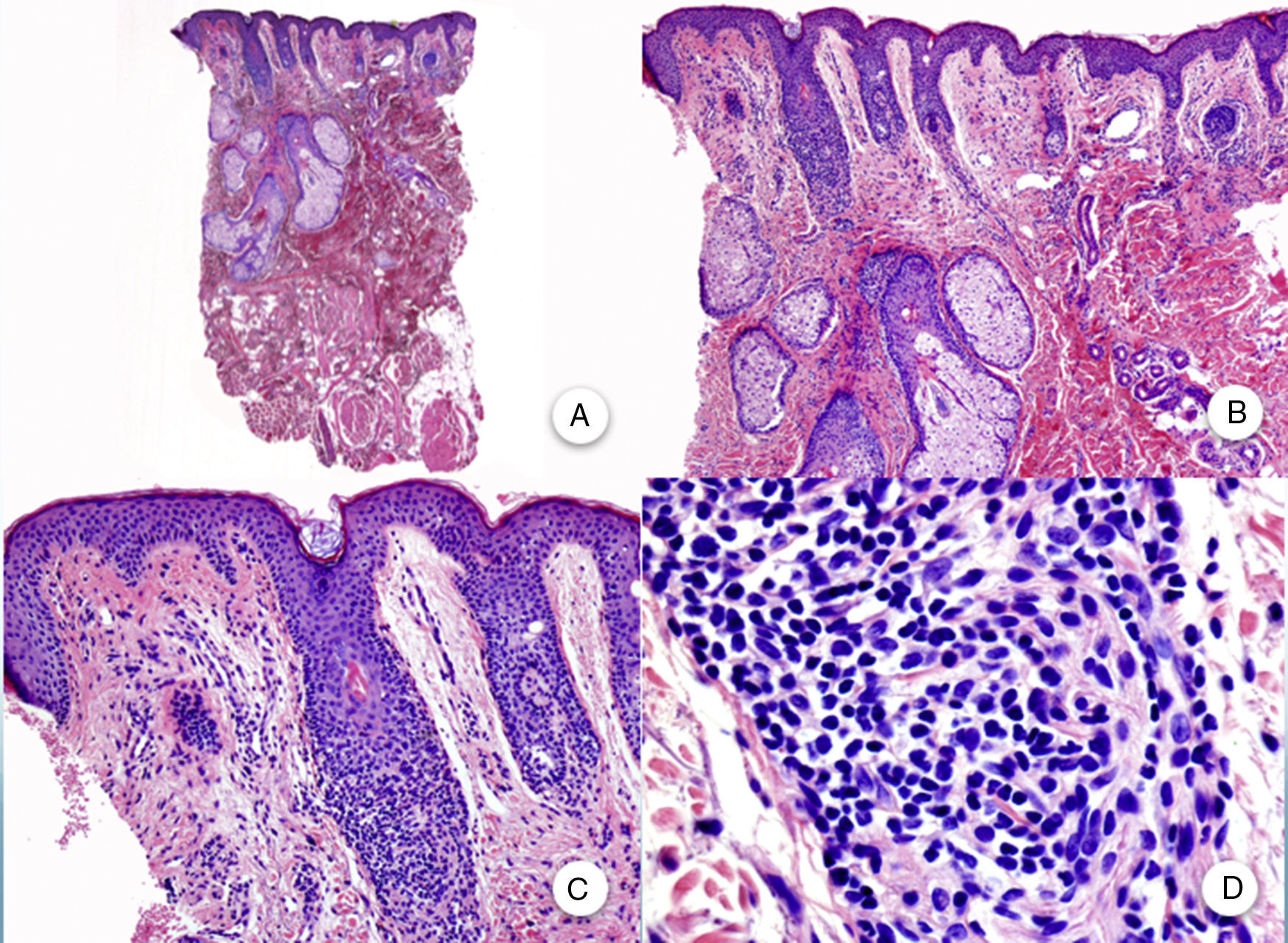
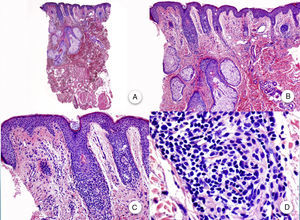
En las biopsias realizadas en la región occipital3, en las cejas o en el vello corporal se aprecian hallazgos histopatológicos similares a los descritos, y a pesar de que clínicamente son alopecias no inflamatorias y no cicatriciales, sí que se observan cambios inflamatorios en los folículos remanentes en la biopsia. En las biopsias de las pápulas faciales se observan cambios similares a los presentes en el cuero cabelludo, pero afectando a folículos pilosos de tipo velloso (fig. 4).
Biopsia una pápula facial. A y B. A bajo aumento se aprecian varios folículos pilosos de tipo velloso con numerosas glándulas sebáceas (H-E ×10, H-E ×100). C y D. Detalle del infiltrado inflamatorio rodeando la porción superior de los folículos pilosos vellosos (H-E ×200, HE ×400).
Pese a que las manifestaciones clínicas de la AFF son diferentes al LPP, los hallazgos histopatológicos son similares en ambas, por lo que la AFF es considerada como una variante clínica de LPP2. Poblet et al.47 estudiaron biopsias de ambas enfermedades con el fin de encontrar diferencias a nivel histopatológico, y como únicos hallazgos diferenciales encontraron la presencia de un infiltrado inflamatorio perivascular en la dermis en el caso del LPP, que no se observa en la AFF, la afectación de la epidermis interfolicular en el 50% de los casos de LPP, ausente en la AFF, y la presencia de cuerpos coloides o fibrosis en la dermis papilar, hallazgos también ausentes en la AFF. Además describen una reacción liquenoide tisular menor en la AFF, menor presencia de células apoptóticas en LPP y, en algunos casos, intenso daño de la capa basal en LPP, que no se observa en AFF.
Los hallazgos inmunohistoquímicos también son comunes a ambas enfermedades. Se observa un infiltrado inflamatorio linfocitario compuesto por linfocitos T con activación HLADR (LN3), una proporción similar de CD4 y CD8, y anticuerpos contra dendrocitos (factor XIIIA) y macrófagos (MAC387) positivos3.
El estudio mediante inmunofluorescencia puede ayudar en el diagnóstico diferencial del LPP y AFF con el lupus eritematoso cutáneo crónico (LECC). En el LPP los cuerpos de Civatte muestran positividad con IgM, y menos frecuentemente con IgA, IgG y C3, y predominan en el epitelio folicular del infundíbulo y el istmo49. Este hallazgo, pese a ser una característica altamente sugestiva de LPP, no es patognomónico, ya que se puede observar también en el LECC. Sin embargo, parece que ambas entidades podrían diferenciarse en función de la composición de estos cuerpos de Civatte, que estarían formados por queratinocitos necróticos (expresan citoqueratinas) en el LPP, y por agregados de membrana basal (positivos con colágeno iv) en el LECC49.
Las tinciones para fibras elásticas también pueden ayudar en el diagnóstico diferencial con otras alopecias cicatriciales, ya que en las lesiones de LPP y AFF se observa la presencia de una cicatriz en forma de cuña de base superior en la dermis superficial, con destrucción de fibras elásticas solo en esa zona, mientras que en las lesiones de LECC se observa destrucción de las fibras elásticas perifoliculares49–51 y en la pseudopelada de Brocq las fibras elásticas se observan llamativamente engrosadas.
Los análisis de laboratorio no han demostrado ninguna anomalía en las series publicadas. Los resultados del hemograma, bioquímica, función hepática, hormonas tiroideas y serología de hepatitis C no detectaron hallazgos de interés. Además, las hormonas sexuales, incluyendo LH, FSH, andrógenos y prolactina eran acordes a los niveles propios de la edad de los pacientes estudiados2,3,10,11,17,19,47,52. Kossard et al.3 describieron un caso de positividad de anticuerpos antinucleares a títulos bajos, y Vañó-Galván et al.10 encontraron la presencia de anticuerpos antitiroideos y anticuerpos antinucleares positivos en un 10% y 7% de los pacientes estudiados respectivamente, por lo que recomiendan descartar enfermedad tiroidea autoinmune en pacientes con AFF.
Pronóstico y tratamientoHasta el momento no se han realizado ensayos clínicos que analicen las diferentes alternativas de tratamiento en AFF. La información disponible en la literatura ha sido obtenida a partir de estudios observacionales de tipo retrospectivo que miden la eficacia de los tratamientos empleados en función de variables objetivas como el LPP activity index. Esto, unido al frecuente retraso diagnóstico de la enfermedad, a la posibilidad de estabilización espontánea en algunos pacientes, y a que la cicatrización de las áreas alopécicas limita su reversibilidad conduce a que no existan evidencias suficientemente fuertes que permitan plantear un protocolo de tratamiento de buena calidad científica en esta enfermedad.
Los fármacos más frecuentemente empleados en los estudios publicados hasta la fecha son múltiples y variados, pero, en general, predomina el uso de los corticoides, por vía tópica e intralesional2,11,12,17, los antipalúdicos3,8,12,53 y los inhibidores de la 5-alfa-reductasa11,16–18. La tabla 2 resume los diferentes esquemas terapéuticos empleados hasta la fecha, con los resultados obtenidos en los diferentes estudios que se han publicado en la literatura.
Respuesta a los diferentes tratamientos en los estudios publicados
| Estudio | N | Mejoría/bueno | Estable/parcial | Nada/empeora |
|---|---|---|---|---|
| Corticoides tópicos | ||||
| Rallis58 | 6 | 6 | ||
| Faulkner59 | 1 | 1 | ||
| Kossard et al.3 | 9 | 9 | ||
| Dawn60 | 2 | 2 | ||
| Naz19 | 2 | 2 | ||
| Vaisse52 | 15 | 15 | ||
| Total | 26 | 0 | 1 (3%) | 25 (97%) |
| Corticoides sistémicos | ||||
| Kossard et al.3 | 4 | 2 | 2 | |
| Naz19 | 1 | 1 | 0 | |
| Tosti18 | 3 | 3 | ||
| Vaisse52 | 2 | 2 | ||
| Total | 10 | 0 | 3 (30%) | 7 (70%) |
| Triamcinolona intralesional | ||||
| Tan11 | 12 | 8 | 1 | |
| Bergfeld55 | 1 | 1 | ||
| Clark-Loeser56 | 1 | 1 | ||
| Moreno-Ramirez17,20 | 9 | 4 | 5 | |
| Vañó-Galvan et al.10 | 130 | 44 | 64 | 6 |
| Total | 153 | 44 (28%) | 76 (50%) | 14 (9%) |
| Triamcinolona intralesional adyuvante | ||||
| Donovan57 | 11 | 7 | 2 | 2 |
| Total | 11 | 7 (63%) | 2 (18%) | 2 (18%) |
| Finasteride, dutasteride | ||||
| Georgala16 | 13 | 13 | ||
| Moreno-Ramirez17,20 | 16 | 16 | ||
| Tosti18 | 8 | 4 | 4 | |
| Katoulis15 | 1 | 1 | ||
| Vañó-Galvan et al.10 | 111 | 52 | 59 | 0 |
| Total | 149 | 62 (41%) | 82 (55%) | 4 (2%) |
| Hidroxicloroquina, cloroquina | ||||
| Samrao et al.8 | 16 | 4 | 7 | 4 |
| Chiang53 | 11 | 5 | 3 | 3 |
| Tan11 | 3 | 1 | 1 | |
| Kossard et al.3 | 3 | 2 | ||
| Vañó-Galvan et al.10 | 54 | 8 | 32 | 12 |
| Total | 87 | 18 (20%) | 42 (48%) | 22 (25%) |
| Terapia hormonal sustitutiva | ||||
| Kossard et al.3 | 8 | 8 | ||
| Total | 8 | 0 | 8 (100%) | |
| Micofenolato mofetil | ||||
| Samrao et al.8 | 5 | 1 | 1 | 3 |
| TOTAL | 5 | 1 (20%) | 1 (20%) | 3 (60%) |
| Doxiciclina | ||||
| Samrao et al.8 | 4 | 1 | 1 | 2 |
| Total | 4 | 1 (25%) | 1 (25%) | 2 (25%) |
| Inhibidores topicos calcineurina en adyuvancia | ||||
| Clark-Loeser56 | 1 | 1 | ||
| Katoulis15 | 1 | 1 | ||
| Bergfeld55 | 1 | 1 | ||
| Total | 3 | 2 (67%) | 0 | 1 (33%) |
| Minoxidil | ||||
| Kossard3 | 2 | 2 | ||
| Tan12 | 2 | 2 | ||
| Naz20 | 1 | 1 | ||
| Total | 5 | 0 | 2 (40%) | 3 (60%) |
| Pioglitazona | ||||
| Vañó-Galvan10 | 23 | Datos no disponibles | ||
Los corticoides suponen la primera estrategia terapéutica en LPP2. Los resultados obtenidos dependen principalmente de la vía de administración elegida. En este sentido, existe controversia en la literatura respecto al uso de corticoides por vía intralesional. Según el metaanálisis más reciente54, el resultado varía desde la no obtención de respuesta2,55,56 hasta una respuesta parcial del 60%, sin haberse objetivado casos de respuesta franca11,17. Sin embargo, el último estudio publicado10, con mayor número de pacientes que el propio metaanálisis, refiere mejoría en el 33% de los casos, manteniendo una respuesta parcial/estabilización en el 50% de los pacientes. Esta controversia puede deberse al momento de la aplicación de los esteroides, ya que estos han demostrado ser eficaces solo cuando existen datos de inflamación en la biopsia10,17. De hecho, en casos avanzados de AFF pueden llegar a ser perjudiciales para la fibrosis y la atrofia20. Cabe destacar que en el caso de alopecia de cejas, el 80% de los pacientes responden de forma parcial o total al tratamiento57. Por otro lado, la administración de corticoides por vía sistémica produce una estabilización de la enfermedad en el 43% de los pacientes54, pero la progresión de la alopecia continúa al suspender el tratamiento. Finalmente, los corticoides tópicos2,19,52,58–60 e intramusculares18 no han demostrado mejoría de la enfermedad en la mayoría de estudios publicados hasta la fecha.
Inhibidores de la 5-α-reductasaLos inhibidores de la 5-α-reductasa, finasteride y dutasteride, muestran resultados variables, aunque en todos los casos descritos se ha reportado al menos una estabilización en la progresión de la AFF. Antes del año 2007 los inhibidores de la 5-α-reductasa habían sido empleados como coadyuvantes a otros tratamientos, principalmente corticoides intralesionales y minoxidil, obteniéndose tasas de estabilización de la enfermedad en torno al 14%, así como un incremento de la densidad pilosa17. Posteriormente, en estudios en monoterapia, los inhibidores de la 5-α-reductasa han demostrado tanto estabilización como mejoría de la AFF, sobre todo en el caso de dutasteride, que al actuar sobre las 2 isoenzimas de la de 5-α-reductasa presenta un mayor efecto inhibidor de esta13. El último estudio realizado en 355 pacientes describe mejoría y estabilización de la enfermedad en el 57% y 53% de los casos respectivamente10. Los mejores resultados con estos fármacos se han obtenido en estudios en los que existe un alto número de pacientes con AAG concomitante a la AFF10,17, por lo que es probable que estas altas tasas de respuesta estén en parte condicionadas por la AAG acompañante que presentan estos pacientes.
Antipalúdicos oralesLa cloroquina e hidroxicloroquina han demostrado tasas de eficacia menores que los fármacos anteriores, pero también constituyen una alternativa terapéutica eficaz en el tratamiento de la AFF. Han demostrado frenar la progresión de la enfermedad en el 48% de los casos y una mejoría en hasta el 20% de los pacientes en algunas series8,10,53.
Otros fármacosLos inhibidores de la calcineurina tópicos, como tacrolimus y pimecrolimus, han demostrado una leve eficacia en las fases iniciales de la enfermedad, por su efecto antiinflamatorio, y sin riesgo de empeorar la atrofia cutánea típica de la AFF. Sin embargo, estos fármacos en monoterapia no influyen en la evolución de la AFF. Algunos estudios han observado que su administración como coadyuvantes produce mejoría de los síntomas inflamatorios en >50% de los pacientes54.
La ciclosporina es un fármaco empleado en LPP cuyos efectos en la AFF se desconocen, aunque se ha postulado su eficacia debido al sustrato histopatológico común a ambas enfermedades. Hasta la fecha, la ciclosporina solo se ha utilizado en un paciente con AFF8, que tuvo que suspender el tratamiento por efectos adversos del fármaco.
Recientemente se ha propuesto el tratamiento con pioglitazona (agonista de los receptores de PPAR-γ) y con rituximab (anticuerpo monoclonal anti-CD20) como posibles opciones terapéuticas en AFF, debido a su actuación selectiva sobre moléculas proinflamatorias del infiltrado inflamatorio linfocitario implicado en la patogenia de esta enfermedad. Ladizinski13 utilizó pioglitazona en un paciente con AFF, pero no obtuvo ninguna respuesta terapéutica; sin embargo, en 2012 se publicó un estudio sobre su uso en el LPP, en el que se observó una remisión en el 20% de los casos tratados, con mejoría parcial en el 50%. Vañó Galván10 et al. también han realizado un estudio con más de 23 pacientes tratados con este fármaco, pero los resultados están aún pendientes de publicación.
La terapia hormonal sustitutiva3, el micofenolato de mofetilo, la doxicilina, el minoxidil tópico2,3,17–19,52, la isotretinoína3, la griseofulvina3, la azatioprina13 y el interferón alfa13 no han demostrado eficacia en ninguno de los estudios publicados hasta la fecha. Se ha observado que minoxidil mejora la densidad capilar del área tratada, pero no altera el curso de la enfermedad54. Es de gran utilidad cuando existe una AAG asociada. El ácido retinoico, utilizado en monoterapia tópica, no ha demostrado ser eficaz en el tratamiento de la AFF, aunque puede ser útil para promover la absorción de otros principios activos tópicos, y aumentar así su eficacia. Los retinoides orales, isotretinoína y acitretino, se han empleado a diferentes dosis con leve mejoría en algún caso aislado54.
Respecto al trasplante capilar en el tratamiento de la AFF, diversos estudios como el de Nusbaum et al.7 y Jiménez et al.40 confirman el crecimiento del cabello durante 1,5-2años tras el trasplante, pero también una pérdida de más del 50% del cabello trasplantado a los 3 años si no se asocia tratamiento médico posterior. La mayoría de autores coinciden en que el trasplante capilar solo se recomendaría en los casos en los que exista un periodo libre de enfermedad que varía de uno a 5 años7,10,13, y con la condición de mantener un tratamiento posterior. Mendes-Bastos et al.61 proponen el uso de clobetasol propionato al 0,05% en crema, o inhibidores de la calcineurina tópicos junto con el tratamiento sistémico con inhibidores de la 5-α-reductasa y minoxidil tópico para el mantenimiento del cabello trasplantado.
En conclusión, hasta la fecha, los inhibidores de la 5-α-reductasa han demostrado ser los fármacos más efectivos en el tratamiento de la AFF, sobre todo en casos con AAG asociada, siendo útiles además como terapia de mantenimiento. En casos de prurito, eritema e hiperqueratosis pueden estar indicados los corticoides intralesionales, con especial hincapié en la afectación de las cejas, donde se han obtenido los mejores resultados. Los antipalúdicos y los inhibidores de la calcineurina tópicos pueden constituir una alternativa como terapia coadyuvante. Finalmente, existe un amplio abanico de tratamientos cosméticos disponibles, entre los que destaca la micropigmentación de cejas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.