El herpes zoster es la expresión cutánea de la reactivación de una infección latente en ganglios sensitivos por el virus varicela zoster que se presenta con vesículas en el dermatoma correspondiente. Cuando compromete más de 2 dermatomas contiguos, presenta más de 20 vesículas por fuera del dermatoma inicial o tiene compromiso sistémico se denomina herpes zoster diseminado (HZD). Esta entidad es infrecuente y se suele presentar en pacientes inmunodeprimidos.
ObjetivosDescribir la epidemiología, factores predisponentes, clínica, laboratorio y evolución clínica de pacientes con HZD. Comparar hallazgos entre inmunodeprimidos e inmunocompetentes.
MetodologíaEstudio de una serie de casos retrospectiva, en adultos ingresados entre febrero de 2010 y octubre de 2015.
ResultadosSe incluyeron 41 pacientes con cuadro clínico de HZD y confirmación virológica. Se detectaron factores de estrés desencadenantes en el 39% y de inmunodepresión en el 58,5%. Los inmunodeprimidos fueron más jóvenes que los inmunocompetentes (60,5 vs 82 años, p<0,01). En 8 casos sin inmunodepresión ni desencadenantes se halló mayor edad (85 años). En el 95% de los casos el HZD comenzó en dermatomas definidos, y luego se extendió a otros o se generalizó. El 56% de los casos presentó trombocitopenia asociada. Las complicaciones afectaron por igual a inmunodeprimidos e inmunocompetentes (54% vs 59%, p>0,01). Fallecieron 6 pacientes, sin diferencias de mortalidad entre ambos grupos.
ConclusiónEste estudio aporta evidencia sobre la relación entre el HZD, la presencia de inmunosupresión subyacente y las posibles complicaciones. En pacientes inmunocompetentes, por inmunosenescencia, la edad podría desempeñar un papel importante en la aparición de esta enfermedad.
Shingles is the cutaneous expression of the reactivation of latent varicella zoster virus infection in sensory ganglia. It presents as vesicles in the corresponding dermatome. The condition is called disseminated herpes zoster (DHZ) when more than 2 contiguous dermatomes are affected, more than 20 vesicles are observed outside the initial dermatome, or involvement is systemic. DHZ is rare and most frequently occurs in immunocompromised patients.
ObjectivesTo describe the epidemiology, predisposing factors, clinical presentation, laboratory findings, and clinical course of patients with DHZ, and to compare the findings in immunocompromised and immunocompetent patients.
MethodologyWe analyzed a retrospective case series of adults hospitalized between February 2010 and October 2015.
ResultsForty-one patients with virologically confirmed manifestations of DHZ were included. Stress as a trigger factor was detected in 39% and immunodepression in 58.5%. Immunocompromised patients were younger than the immunocompetent patients (mean ages, 60.5 vs 82 years, P<.01). The 8 immunocompetent patients with no detectable trigger factors were older (mean age, 85 years). In 95% of cases, DHZ was initially limited to a single dermatome and then spread to other dermatomes or became disseminated. Thrombocytopenia was detected in 56% of cases. Complication rates were similar in immunocompromised and immunocompetent patients (54% vs 59%, P>.01). Six patients died; there was no difference in mortality between the 2 groups.
ConclusionThis study provides evidence on the relationship between DHZ, the presence of underlying immunodepression, and complications. Immunosenescence may play an important role in the onset of this disease in older immunocompetent patients.
La primoinfección por el virus varicela zoster (VVZ) se suele presentar con varicela, un exantema vesiculoso y pruriginoso de distribución cefalocaudal. Afecta a la mayor parte de los individuos durante la infancia o la adolescencia, y los estudios serológicos evidencian que el 98% de los adultos han estado expuestos a este virus1,2.
Tras la primoinfección, el virus queda latente en los ganglios sensitivos de la raíz dorsal. El herpes zoster (HZ) es la reactivación aguda de esa infección latente y afecta al 15% de los pacientes inmunocompetentes (IC) y al 50% de los inmunodeprimidos (ID) a lo largo de su vida. Se ha descrito que la edad avanzada, el estrés físico y/o psíquico y la inmunodepresión por sida, trasplantes, neoplasias, enfermedades autoinmunes y tratamientos inmunosupresores pueden ser factores de riesgo o desencadenantes de este cuadro1,2. La reactivación del VVZ ocasiona una viremia transitoria que es controlada de forma rápida por la inmunidad adquirida, y se suele presentar con dolor y vesículas en el dermatoma afectado. En ocasiones, algunas partículas virales pueden llegar a la piel distante al dermatoma afectado provocando vesículas aberrantes (menos de 20)2–6. Cuando la viremia persiste aumenta la probabilidad de compromiso visceral y pueden aparecer más de 20 vesículas en áreas distantes al dermatoma inicial, y/o afectarse más de 2 dermatomas contiguos o discontinuos. En estos casos se denomina HZ diseminado (HZD)1,7–9.
En la literatura el porcentaje comunicado de casos de HZ que evolucionan con diseminación es variable y se estima que en ID podría alcanzar el 40%2–6,10–12.
En la actualidad se suele considerar que el HZD se presenta con mayor frecuencia en ID, con una evolución clínica grave y mayor mortalidad, con comunicaciones aisladas en IC. Los objetivos de este estudio son describir las características demográficas, clínicas, factores predisponentes, alteraciones de laboratorio y evolución de pacientes con HZD y comparar los hallazgos en pacientes ID e IC.
Materiales y métodosDiseñoEstudio observacional retrospectivo en pacientes adultos admitidos en un centro hospitalario de tercer nivel de complejidad.
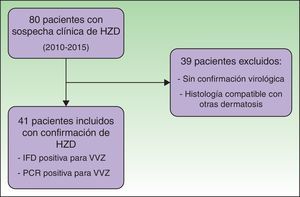
PoblaciónSe revisaron los registros clínicos electrónicos de los pacientes ingresados con sospecha de HZD entre febrero de 2010 y octubre de 2015. Se incluyeron aquellos mayores de 17 años, evaluados por médicos especialistas en dermatología que cumplían criterios clínicos de HZD y confirmación virológica por detección de antígeno por inmunofluorescencia directa o de ADN viral por PCR mediante toma de muestra mediante hisopo de las vesículas. Se realizó seguimiento de los pacientes por un periodo de 3 meses tras el diagnóstico. Se excluyeron casos con sospecha de HZD, en los que no se pudo confirmar la presencia del VVZ.
Mediciones y variables estudiadasSe revisaron las historias clínicas electrónicas. Los datos demográficos y las características clínicas de los pacientes se obtuvieron de una base de datos secundaria electrónica. La obtención de los datos se realizó por 2 operadores independientes con posterior revisión de los mismos por el investigador principal, a fin de detectar valores erróneos e información ausente. Específicamente se registraron: edad, sexo, comorbilidades basales preexistentes y diagnosticadas posteriores al inicio del cuadro de HZD, factores de estrés físicos o psíquicos desencadenantes, tratamientos inmunosupresores previos, características clínicas al inicio del cuadro y variables de laboratorio. Se consideraron ID a aquellos pacientes que por su enfermedad de base o por el tratamiento recibido presentaban alteración en su inmunidad celular y/o humoral: HIV con o sin tratamiento, trasplante de órganos sólidos bajo tratamiento inmunosupresor, enfermedades oncohematológicas o neoplasias de órganos sólidos con o sin tratamiento quimioterápico, enfermedades que requieren para su tratamiento más de 20mg de prednisona durante 2 semanas (como enfermedades autoinmunes o fibrosis pulmonar), hipo o agammaglobulinemias. También se registraron características evolutivas de la población, síntomas asociados, desarrollo de complicaciones tempranas y tardías, incluyendo la presencia de neuralgia postherpética (NPH) a los 3 meses del cuadro inicial y la muerte inmediata ocurrida durante el período de ingreso.
Análisis estadísticoPara describir las características basales de la población se utilizaron proporciones para las variables categóricas y mediana y rango intercuartílico (RIC) para las variables continuas. Se compararon las características basales de los pacientes con una causa predisponente definida para el desarrollo de HZD con las de aquellos pacientes sin un factor desencadenante. Con tal fin se utilizó el test de Fisher para variables categóricas y el test de Mann-Whitney para las continuas. Se consideró como significativo un valor de p<0,01.
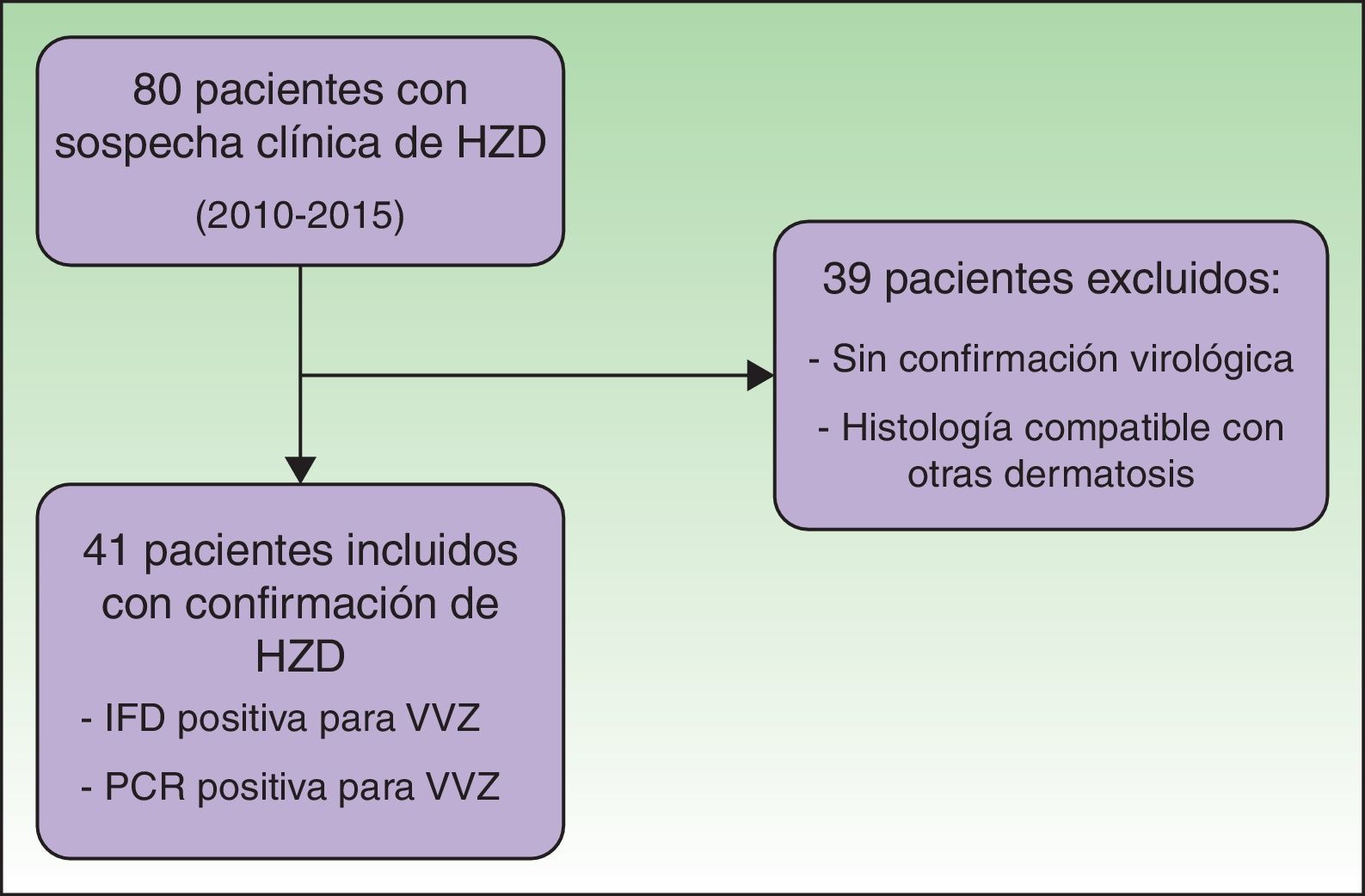
ResultadosSe revisaron 80 historias clínicas de pacientes ingresados con sospecha de HZD. En el período estudiado 41 pacientes cumplieron los criterios de inclusión, con confirmación de la infección del VVZ por IFD o PCR (fig. 1).
Con respecto a las características demográficas de la población (tabla 1) el 48,78% (n=20) de los pacientes fueron mujeres y la mediana de edad fue 70 años (RIC: 52-82).
Características basales de la población
| Covariables | Pacientes con HZD confirmado (n=41) | |
|---|---|---|
| Características demográficas | ||
| Sexo femenino (n, %) | 20 | 48,78 |
| Edad en años (mediana, RIC) | 70 | (52-82) |
| Factores predisponentes y desencadenantes | ||
| Factores predisponentesa(n, %): | 24 | 58,54 |
| Trasplante de órganos sólidos | 7 | 17,07 |
| Neoplasia hematológica | 6 | 14,63 |
| Neoplasia de órgano sólido | 4 | 9,76 |
| HIV sin tratamiento | 4 | 9,76 |
| Enfermedad autoinmune en tratamiento | 4 | 9,76 |
| Fibrosis pulmonar idiopática en tratamiento | 1 | 2,44 |
| Tratamiento inmunosupresor (corticoterapia prolongada o quimioterapia) | 17 | 41,46 |
| Factores de estrésb(n, %) | 16 | 39,02 |
| Causa médica | 12 | 75 |
| Causa quirúrgica | 3 | 18,75 |
| Causa traumática | 1 | 6,25 |
| Rasgos clínicos | ||
| Inicio en dermatoma definido (n, %) | 39 | 95,12 |
| Inicio en forma generalizada (n, %) | 2 | 4,88 |
| Evolución a más de 2 dermatomas contiguos (n, %) | 25 | 60,97 |
| Evolución a distribución generalizada (n, %) | 14 | 34,14 |
| Síntomas de presentación (n, %) | ||
| Ningún síntoma | 15 | 36,59 |
| Dolor | 21 | 51,22 |
| Prurito | 3 | 7,32 |
| Ardor | 2 | 4,88 |
| Presentación clínica (n, %) | ||
| Clásica | 29 | 70,73 |
| Atípicac: | 12 | 29,27 |
| Vesículas purulentas | 6 | 14,63 |
| Vesículas hemorrágicas | 3 | 7,32 |
| Vesículas purulentas y hemorrágicas | 2 | 4,88 |
| Necrosis | 1 | 2,44 |
| Compromiso de mucosas (n, %) | 12 | 29,27 |
| Compromiso ocular (n, %) | 7 | 17,07 |
| Fiebred(N, %) | 15 | 36,59 |
| Parámetros de laboratorioe | ||
| Anemia (n, %) | 10 | 24,39 |
| Leucocitosis (n, %) | 6 | 14,63 |
| Leucopenia (n, %) | 13 | 31,71 |
| Trombocitopenia (n, %) | 23 | 56,10 |
| Leve (100.000-150.000/cc) | 12 | 29,27 |
| Moderada (100.000-50.000/cc) | 8 | 19,51 |
| Severa (<50.000/cc) | 3 | 7,32 |
| Trombocitosis (n, %) | 1 | 2,44 |
| Alteraciones en hepatograma (n, %) | 8 | 19,51 |
| Alteraciones en función renal (n, %) | 5 | 12, 20 |
| Complicaciones específicas | ||
| Sin complicaciones (n, %) | 18 | 43,90 |
| Con complicaciones (n, %) | 23 | 56,10 |
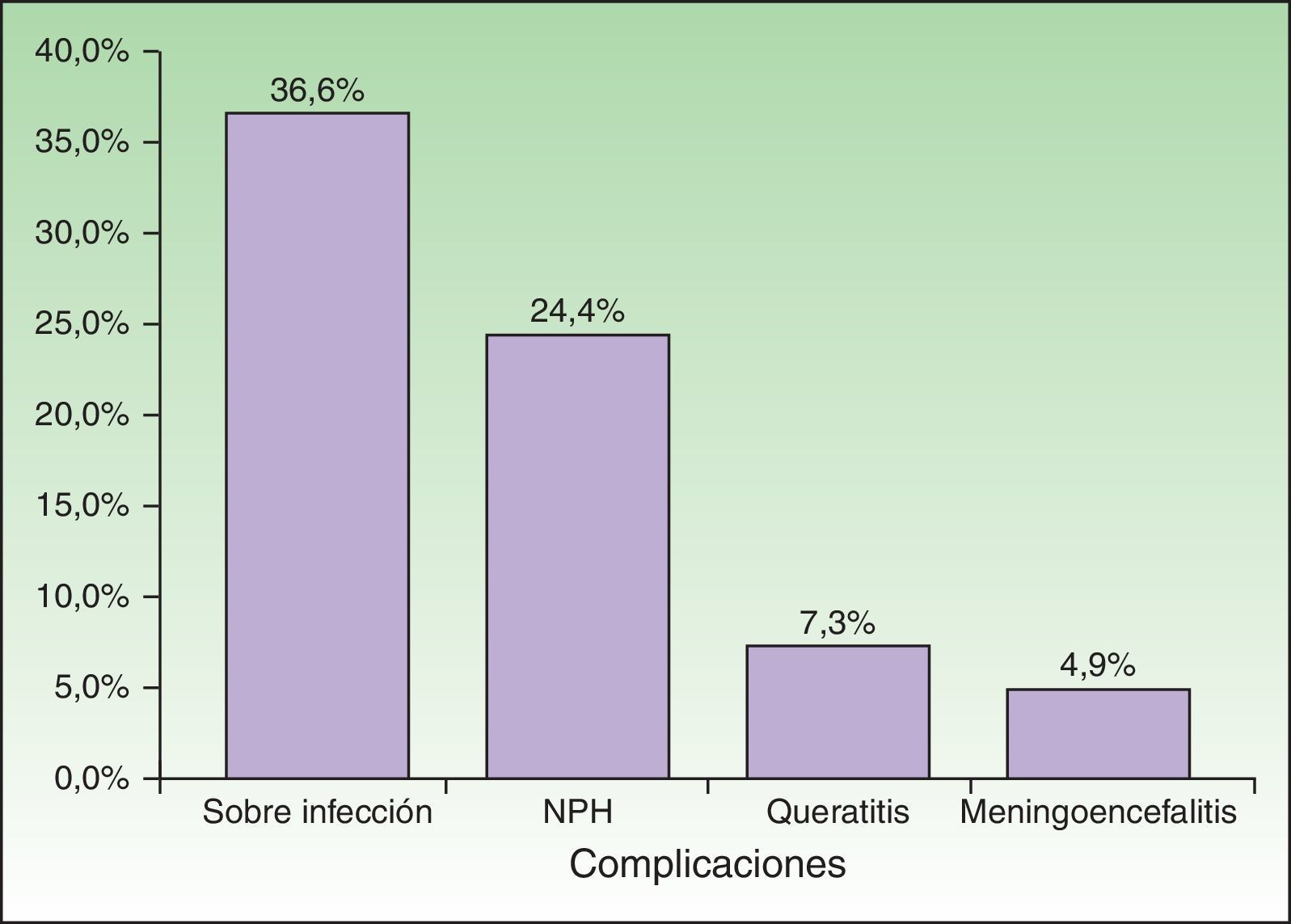
| Sobreinfección bacteriana | 15 | 36,59 |
| Neuralgia postherpética | 10 | 24,39 |
| Meningoencefalitis | 2 | 4,88 |
| Queratitis | 3 | 7,32 |
| Desenlace | ||
| Curación | 35 | 85,37 |
| Óbito | 6 | 14,63 |
HIV: virus de la inmunodeficiencia humana; HZD: herpes zoster diseminado; RIC: rango intercuartílico.
Se entiende como factores predisponentes a enfermedades preexistentes causantes de inmunodepresión por sí mismas o por el tratamiento instaurado.
Se entiende como factor de estrés cualquier causa médica, quirúrgica o traumática que pudiera generar una tensión en el organismo desencadenante de la reactivación del VVZ.
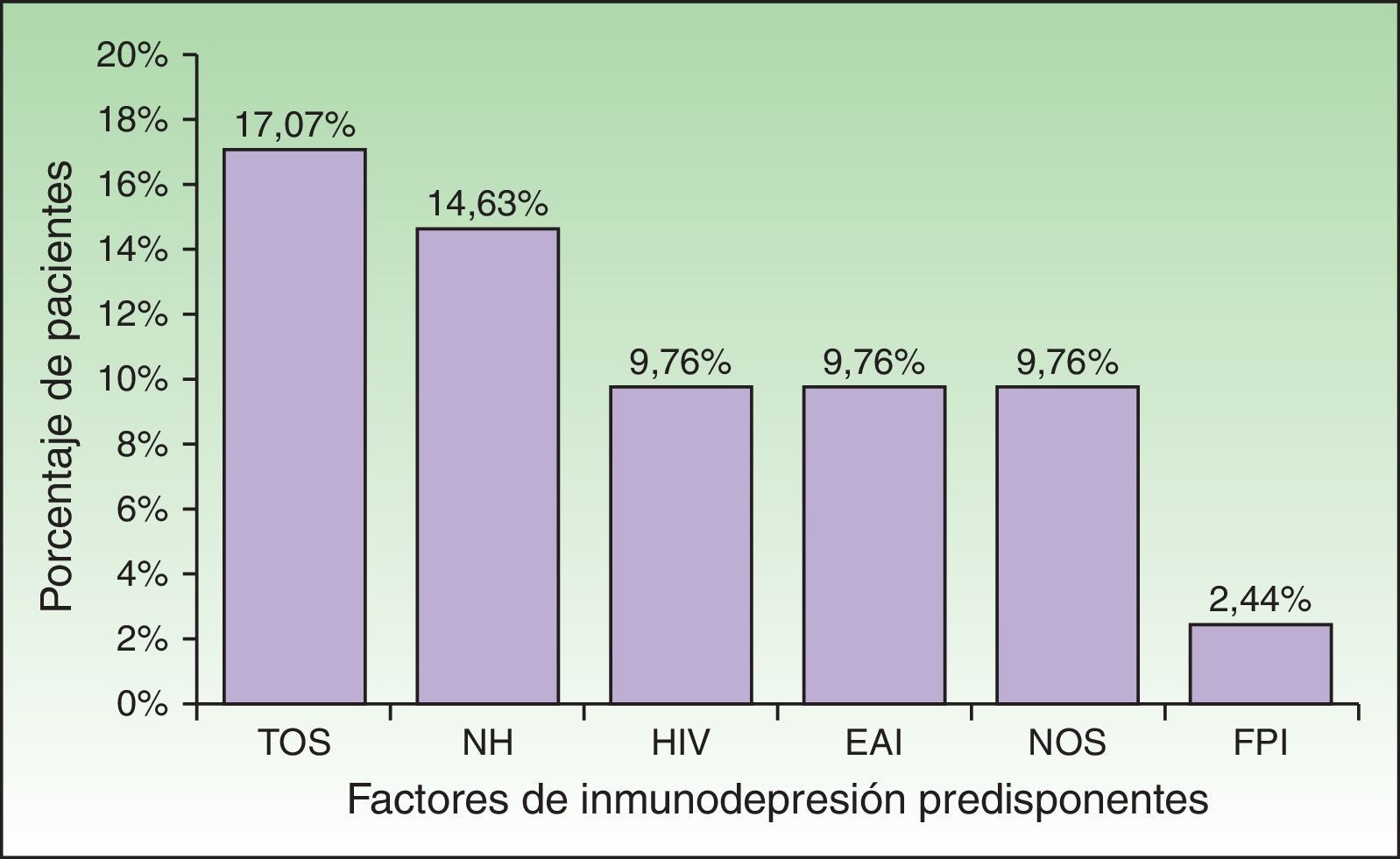
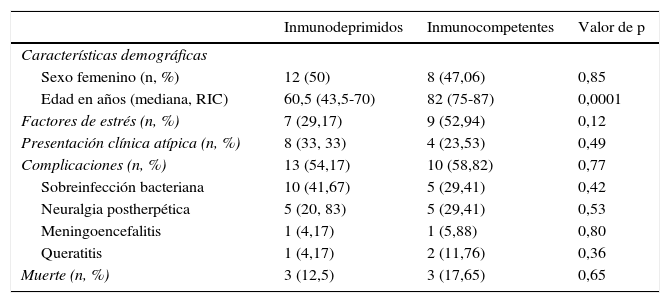
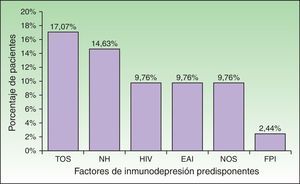
Se hallaron condiciones de inmunosupresión en el 58,54% (n=24) de la población. Algunos pacientes presentaban más de una comorbilidad que alteraba su respuesta inmunológica (fig. 2). El trasplante de órganos sólidos (17,07%, n=7) y las enfermedades oncohematológicas (14,63%, n=6) fueron las causas más frecuentes, mientras que las enfermedades autoinmunes y las neoplasias de órganos sólidos bajo tratamiento, así como el HIV se presentaron en igual número de pacientes (9,76%, n=4). Un paciente se encontraba en tratamiento con corticoides por fibrosis pulmonar idiopática. En total, 17 pacientes (41,46%) se encontraban bajo tratamiento con corticoides o quimioterapia. La búsqueda de condiciones de ID a partir del HZD permitió diagnosticar un caso de HIV, uno de tumor neuroendocrino de íleon y otro de linfoma linfoplasmocítico. Se detectaron factores de estrés desencadenantes (infecciones graves, cirugía mayor o traumatismo) en el 39,02% (n=16) del total de casos. Los pacientes ID fueron más jóvenes que los IC, con una mediana de edad de 60,5 años (RIC: 43,5-70), en comparación con 82 años (RIC, 75-87), y esta diferencia resultó estadísticamente significativa (p<0,01) (tabla 2). Si bien la presencia de factores desencadenantes fue hallada con menor frecuencia en ID (29,17%, n=7) que en IC (52,94%, n=9), la diferencia no fue significativa. En 8 casos (19,51%) no se detectó inmunosupresión evidente ni factores de estrés desencadenantes, pero se evidenció una mediana de edad mayor (85 años) que en pacientes IC con factores de estrés (77 años).
Factores predisponentes hallados en los pacientes considerados inmunodeprimidos (n=24).
EAI: enfermedades autoinmunes; FPI: fibrosis pulmonar idiopática; HIV: virus de la inmunodeficiencia humana; NH: neoplasias hematológicas; NOS: neoplasia de órganos sólidos; TOS: trasplante de órganos sólidos.
Comparación entre pacientes inmunodeprimidos e inmunocompetentes
| Inmunodeprimidos | Inmunocompetentes | Valor de p | |
|---|---|---|---|
| Características demográficas | |||
| Sexo femenino (n, %) | 12 (50) | 8 (47,06) | 0,85 |
| Edad en años (mediana, RIC) | 60,5 (43,5-70) | 82 (75-87) | 0,0001 |
| Factores de estrés (n, %) | 7 (29,17) | 9 (52,94) | 0,12 |
| Presentación clínica atípica (n, %) | 8 (33, 33) | 4 (23,53) | 0,49 |
| Complicaciones (n, %) | 13 (54,17) | 10 (58,82) | 0,77 |
| Sobreinfección bacteriana | 10 (41,67) | 5 (29,41) | 0,42 |
| Neuralgia postherpética | 5 (20, 83) | 5 (29,41) | 0,53 |
| Meningoencefalitis | 1 (4,17) | 1 (5,88) | 0,80 |
| Queratitis | 1 (4,17) | 2 (11,76) | 0,36 |
| Muerte (n, %) | 3 (12,5) | 3 (17,65) | 0,65 |
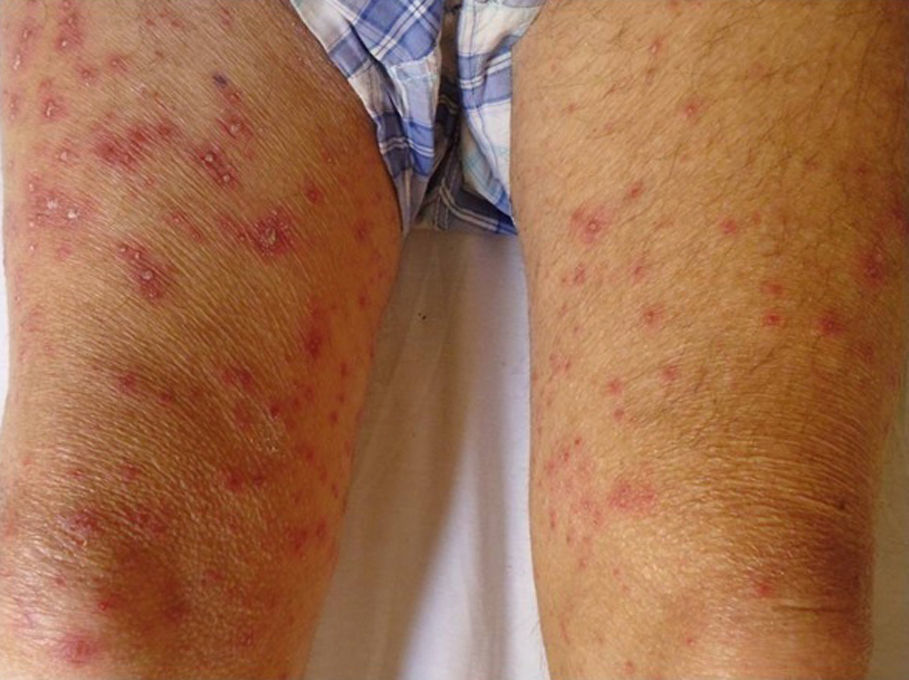
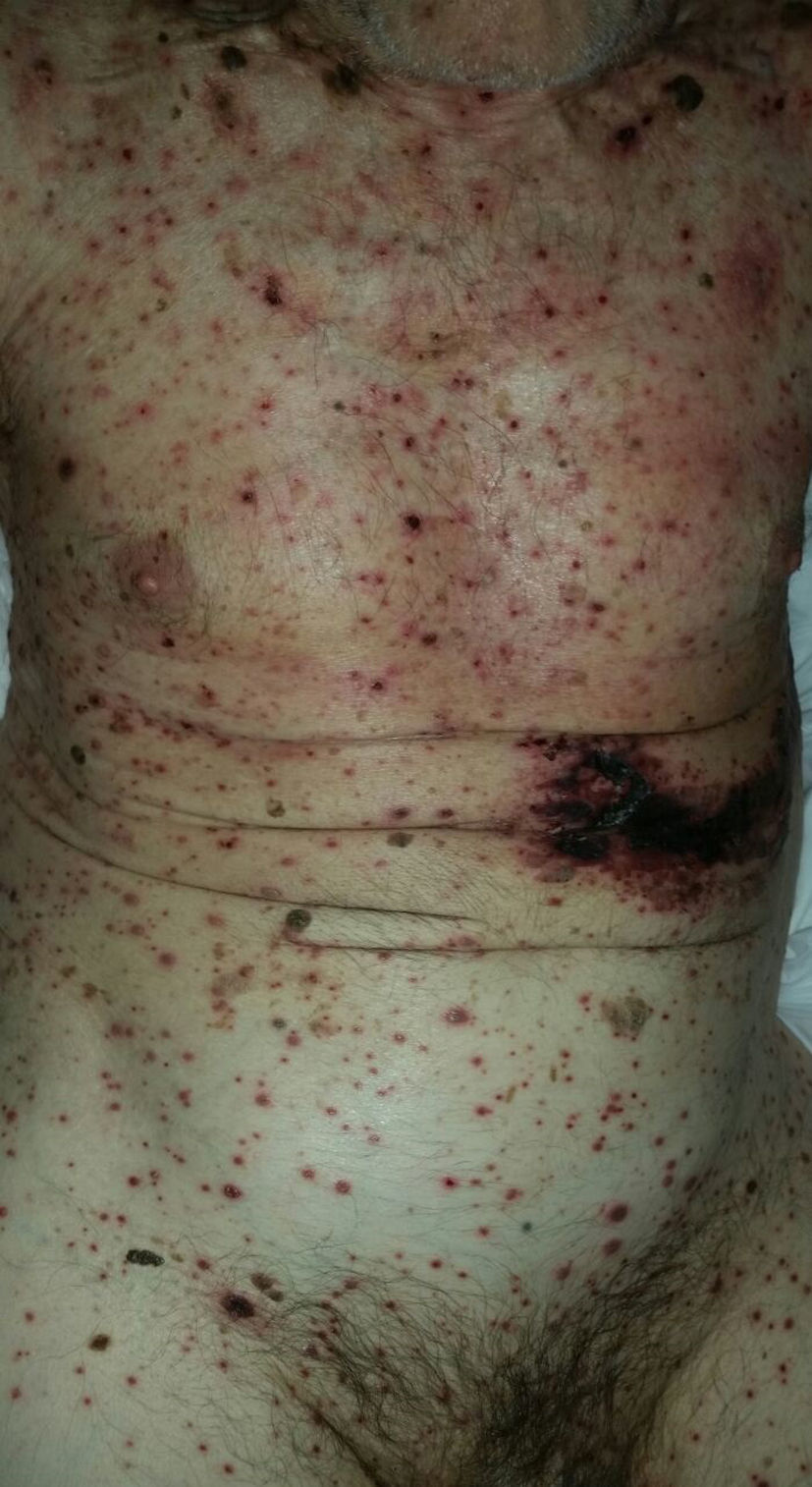
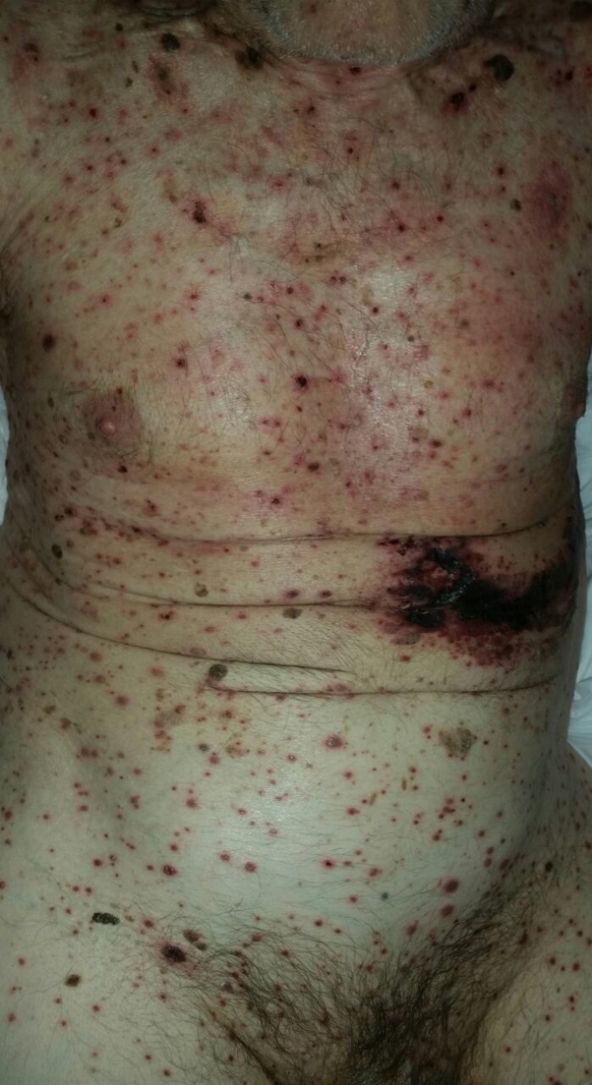
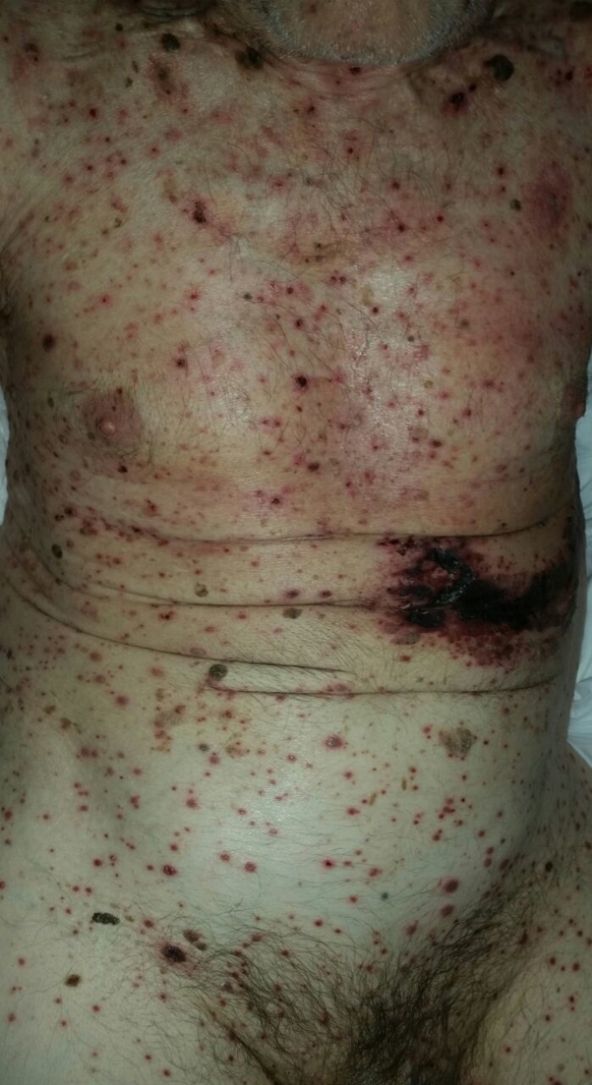
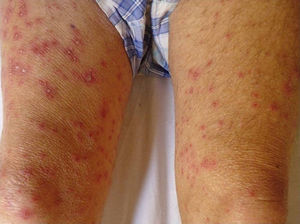
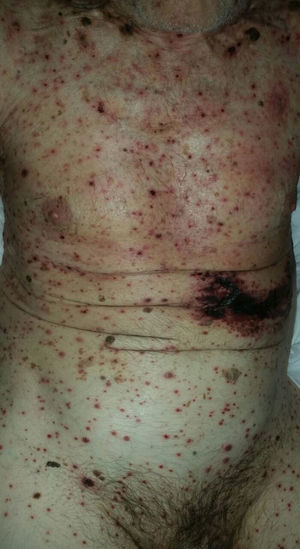
Con respecto a la evolución clínica (fig. 3) en 2 pacientes las manifestaciones clínicas iniciales fueron vesículas distribuidas de forma generalizada en todo el cuerpo, mientras que en el 95,12% (n=39) el HZD comenzó en dermatomas definidos y luego se extendió a contiguos en 25 casos y de forma generalizada en 14. El 63,41% (n=26) presentó síntomas asociados. El dolor fue el más frecuente y afectó a la mitad de los casos. Con menor frecuencia el cuadro se asoció a ardor, parestesias y prurito. La presentación clínica clásica consistente en placas eritematosas donde asientan vesículas agrupadas de contenido seroso que evolucionan a la rotura, y dejan erosiones o costras serohemáticas, se evidenció en el 70,73% (n=29) de los pacientes. En cambio, en 12 pacientes —23,53% IC (n=4) y 33,33% ID (n=8)— se observó la presencia de manifestaciones atípicas como vesículas de contenido purulento o hemorrágico. Solo un paciente ID presentó necrosis cutánea en su evolución clínica y tuvo evolución fatal (fig. 4). Sin embargo, al comparar la frecuencia de presentación clínica atípica no hubo diferencia estadísticamente significativa entre ambos grupos (p>0,01). El 29,27% (n=12) tuvo compromiso mucoso y el 17,07% (n=7) ocular. En 15 pacientes (36,59%) se constataron registros febriles, no atribuibles a sobreinfección bacteriana u otros focos sépticos.
Entre los hallazgos de laboratorio cuya única causa atribuible fue el HZD, se destacó la trombocitopenia presente en el 56,10% (n=23). De estos pacientes, en casi la mitad (47%, n=11) la misma llegó a valores moderados o graves (menos de 100.000 y 50.000 plaquetas/mm3 respectivamente), si bien ningún paciente presentó manifestaciones hemorrágicas. Otros hallazgos fueron leucopenia (31,71%, n=13), anemia (24,39%, n=10) y alteraciones asintomáticas en la bioquímica hepática (19,51%, n=8).
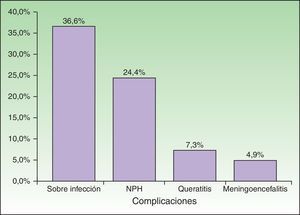
El 56,10% (n=23) de los pacientes presentó complicaciones (fig. 5), que afectaron por igual a ID e IC (54,17% vs 58,82%). Se detectaron diferencias mínimas y estadísticamente no significativas al comparar ambos grupos. La complicación más frecuente fue la sobreinfección bacteriana, que se observó en el 36,59% (n=15) de la población estudiada, en un mayor número de casos en ID (41,67%, n=10) que en IC (29,41%, n=5). La segunda complicación más frecuente fue la NPH, en el 24,39% de los pacientes (n=10), que se halló en mayor porcentaje en pacientes IC (29,41%, n=5) que en ID (20,83%, n=5). Tres pacientes presentaron queratitis y 2 pacientes meningoencefalitis con aislamiento de VVZ en el LCR por PCR. Con respecto a la evolución, el 85,37% (n=35) de los pacientes se curaron con el tratamiento antiviral sistémico instaurado.
El tratamiento indicado en todos los casos fue aciclovir 10 a 15mg/kg cada 8 horas por vía endovenosa o ajustado a función renal, como mínimo hasta el cese de la aparición de nuevas lesiones, y posteriormente se pasó a la vía oral. El 85,37% (n=35) de los pacientes presentó remisión clínica con el tratamiento instaurado. Fallecieron 6 individuos (14,63%). Los 2 pacientes con meningoencefalitis mencionados fallecieron (uno IC y otro ID). Un paciente ID murió con sospecha de compromiso neurológico, sin confirmación por imposibilidad de realizar punción lumbar, y otros 3 lo hicieron por múltiples intercurrencias. No se evidenciaron diferencias significativas al comparar la mortalidad entre IC e ID (17,65% vs 12,50%).
DiscusiónNuestro estudio contempla de forma exclusiva pacientes con HZD y comprende la población más numerosa con este diagnóstico comunicada hasta la fecha. Nos permitió conocer la epidemiología, las manifestaciones clínicas y evolutivas de pacientes con HZD y comparar las características de las mismas en pacientes IC e ID.
En el análisis de los datos epidemiológicos no encontramos diferencias en la frecuencia de presentación del HZD entre ambos sexos, en coincidencia con algunas publicaciones10–12. Se ha demostrado que el HZ clásico, confinado a un dermatoma, aumenta su incidencia con la edad y más del 66% de los pacientes que lo presentan tienen más de 50 años. Esto mismo constatamos en nuestra población con HZD1,3–5,7,10,11,13–16. Esta relación parece estar ligada a la senescencia o envejecimiento del sistema inmunológico. Diversos trabajos han demostrado que la respuesta inmune celular de los linfocitos, al ser estimulados in vitro mediante la exposición al VVZ, disminuye con la edad. Este fenómeno se conoce como «inmunosenescencia»2,3,17.
En un trabajo realizado por Merselis et al. entre 1932 y 1962, única publicación que contempla casos de HZD tanto en ID como en IC, de los 17 pacientes estudiados el 65% (n=11) fueron considerados ID para enfermedades conocidas en esa época12. Nosotros hallamos condiciones de ID en el 58,54% (n=24) de la población. En coincidencia con la literatura las causas de inmunodepresión que encontramos en nuestros pacientes comprometen a la inmunidad celular, sin casos que presenten alteraciones de la inmunidad humoral2–4,6,12,16,18–24. El HZD fue la primera manifestación de una enfermedad sistémica inmunodepresora subyacente en 3 pacientes. Esto destaca la importancia del estudio de comorbilidades predisponentes en los casos de HZD.
Los casos de HZD en pacientes IC comunicados en la literatura son aislados, y no existen estudios que evalúen el riesgo de diseminación de HZ en esta población13–15,25–27. El alto porcentaje de casos de HZD en IC que encontramos en nuestro estudio sugiere la posibilidad de diseminación en cualquier paciente con HZ. La diferencia estadísticamente significativa encontrada en la edad de IC e ID sugiere que la edad por sí misma podría ser un factor de riesgo para HZD11,28.
En la mayor parte de los casos con HZD comunicados en la literatura, así como en el 95% de nuestros pacientes, la enfermedad comienza en un dermatoma definido y luego se extiende hacia dermatomas adyacentes o se generaliza28. Las vesículas típicas de esta enfermedad pueden evolucionar con supuración, contenido hemorrágico o necrosis. Contrario a lo observado con la edad de los pacientes, no encontramos diferencias significativas en las manifestaciones clínicas entre IC e ID. Solo un paciente ID presentó necrosis de las lesiones cutáneas y se asoció a mal pronóstico por evolución fatal11,20,21,24.
Las alteraciones de laboratorio por VVZ han sido descritas durante la primoinfección, y en nuestro trabajo hemos podido observar que asimismo son frecuentes en el HZD. La trombocitopenia afectó a más de la mitad de los pacientes, incluso con valores críticos. La leucopenia, la anemia y las alteraciones en la bioquímica hepática fueron frecuentes. Por lo tanto, es importante monitorizar estos parámetros de laboratorio y evaluar los mecanismos subyacentes a las alteraciones de los mismos, debido a las consecuencias clínicas que podrían traer aparejadas2,3.
En un estudio realizado en 1.669 pacientes con HZ clásico sin diseminación, el desarrollo de complicaciones afectó al 28% de los casos, con una diferencia significativa entre ID e IC (20% vs 9%)5. En cambio, en nuestros pacientes con HZD, en donde ya el VVZ se ha extendido en el tegumento, el porcentaje de pacientes que presentaron otras complicaciones sobreagregadas fue mucho mayor, y afectaron por igual a ID e IC. La incidencia de NPH descrita en HZ es del 10-20% y aumenta con la edad. Nuestros hallazgos revelaron datos similares en HZD5,10. La NPH se produce por inflamación y necrosis en el ganglio sensitivo, lo que explicaría el mayor número de casos de esta complicación en pacientes IC, que conservan la posibilidad de desarrollar una respuesta inmune más intensa; si bien la diferencia entre IC e ID no fue significativa. La complicación más grave que observamos fue la meningoencefalitis, la cual produjo el fallecimiento de 2 pacientes, uno IC y otro ID. A diferencia de lo hallado en la literatura, no se encontraron otras complicaciones como compromiso motor, síndrome de Ramsay-Hunt o vasculitis22,23,26,28.
Todos los pacientes con HZD recibieron tratamiento con aciclovir intravenoso. Estudios en pacientes ID demuestran que el principal factor de riesgo para la diseminación del VVZ es el tiempo transcurrido entre el inicio de los síntomas y el tratamiento, siendo mayor el riesgo cuanto mayor es la demora hasta la instauración del mismo11,25,29. Por esto, en estos casos es necesario iniciar de forma precoz el tratamiento antiviral por vía intravenosa.
En la bibliografía consultada se describe que el HZD tiene una mortalidad del 5% a 15% en ID no HIV, y del 26% en pacientes con HIV, similar a nuestros hallazgos28. Es importante destacar que no se hallaron diferencias en la mortalidad entre IC e ID, lo que alerta sobre la posibilidad de este desenlace en todos los pacientes.
En conclusión, este estudio aporta información sobre las características demográficas, las condiciones de inmunosupresión subyacente, los factores desencadenantes, las manifestaciones clínicas, las alteraciones de laboratorio y la evolución de pacientes con HZD. Destacamos que en nuestra población esta virosis afectó en igual proporción a IC y a ID, y al comparar los hallazgos en ambos grupos se encontraron diferencias significativas en la edad de los pacientes, pero no se hallaron en las manifestaciones clínicas, la evolución y la mortalidad. Esto pone énfasis en que en pacientes IC la edad podría desempeñar un papel importante en la aparición de esta enfermedad debido a la inmunosenescencia y, en que tanto en IC como en ID, el HZ puede presentarse con un cuadro diseminado. Por esto, es esencial sospechar esta entidad en todos los pacientes más allá de su estado inmunológico y realizar un diagnóstico y tratamiento oportunos. Quizás en futuros trabajos se pueda evaluar si la vacuna que ha demostrado prevenir la reactivación del VVZ y sus posibles complicaciones, al aumentar la inmunidad específica celular, puede disminuir también el riesgo de diseminación3,14,22,24,30.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.