La inmunoterapia en el cáncer emerge como un tratamiento novedoso y prometedor en una gran variedad de tumores, incluido el cáncer cutáneo no melanoma. Los anticuerpos inhibidores de proteínas de control inmunitario están dirigidos fundamentalmente a las moléculas de superficie CTLA-4 (antígeno citotóxico de los linfocitos T) y PD-1 (molécula de muerte programada 1). En el presente artículo se revisan las vías de CTLA-4 y PD-1/PD-L1 (PD-1/ligando de la PD-1) y las evidencias actuales de tratamiento con inhibidores de puntos de control inmunitario en los principales tipos de cáncer cutáneo no melanoma.
Immunotherapy is emerging as a new and promising treatment for a great variety of tumors, including nonmelanoma skin cancer. Checkpoint inhibitors —antibodies that block proteins that regulate the immune system— mainly target the surface protein CTLA-4 (cytotoxic T-lymphocyte-associated antigen 4) and the PD-1/PD-L1 (programmed cell death protein 1/PD-ligand 1) axis. We review the CTLA-4 and PD-1/PD-L1 pathways and current evidence supporting checkpoint inhibitor therapy in the main types of nonmelanoma skin cancer.
La interacción entre las estrategias que pone en marcha un tumor para iniciarse y progresar y los mecanismos antitumorales del huésped es clave en el desarrollo del cáncer. El concepto de «vigilancia inmunológica» hace referencia al mecanismo por el cual el sistema inmunitario es capaz de reconocer y eliminar células tumorales. Sin embargo, los tumores emplean diversos mecanismos que les permiten evadir esta respuesta inmune y persistir.
La actividad inmunológica antitumoral más importante está mediada por la respuesta celular. El proceso de activación de los linfocitos T (LT) precisa de dos señales: una inicial, mediada por el reconocimiento de un antígeno presentado por el complejo mayor de histocompatibilidad (CMH) al receptor del LT (RLT); y una segunda señal, o señal correguladora, que modula la expansión clonal y una respuesta efectora específica. Las moléculas correguladoras son glicoproteínas esenciales para la comunicación entre los LT y el resto de células del sistema inmune; hay moléculas coestimuladoras, que ponen en marcha la activación de los LT, y otras coinhibidoras, que frenan la respuesta inmune, minimizando el daño de los tejidos sanos (mecanismo de tolerancia periférica)1. Entre estas moléculas coinhibidoras destacan el antígeno citotóxico de los LT (CTLA-4), la molécula de muerte programada 1 (PD-1) y el ligando de la molécula de muerte programada 1 (PD-L1).
Entre los mecanismos de actuación de los tratamientos inmunológicos para el cáncer se encuentran el reclutamiento de células inmunes en el microambiente tumoral y/o el bloqueo de moléculas coinhibidoras, potenciando así la respuesta celular antitumoral. En esta línea, los fármacos dirigidos frente a los ejes CTLA-4 y PD-1/PD-L1 están cobrando protagonismo en el tratamiento de diversos tumores cutáneos como el melanoma maligno (MM), el carcinoma de células de Merkel (CCM) y, más recientemente, el carcinoma escamoso cutáneo (CEC) y basocelular (CBC).
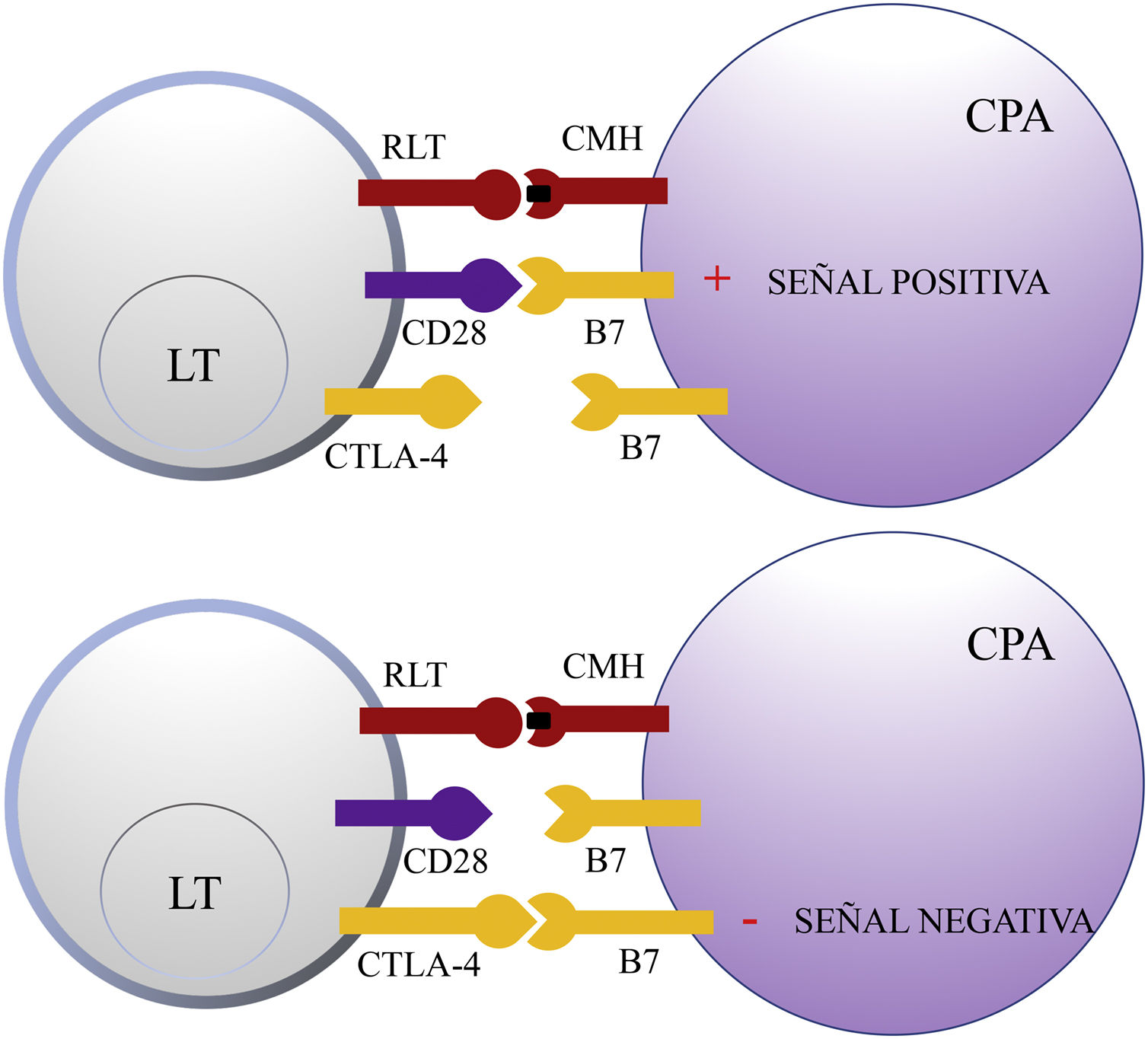
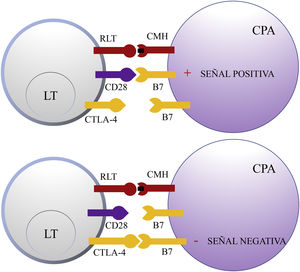
Antígeno citotóxico de los linfocitos TCTLA-4 es una molécula que pertenece al grupo de los receptores coinhibidores de la superfamilia de las inmunoglobulinas. Se expresa en la superficie de los LT entre 24-48h tras su activación. En una primera fase de la respuesta inmune, las células presentadoras de antígenos (CPA) exponen los antígenos tumorales a los LT en los tejidos linfoides. Los receptores del LT, CTLA-4 (molécula inhibidora) y CD28 (molécula estimuladora) compiten para unirse con las moléculas B7-1 (CD80) y B7-2 (CD86) de la CPA. La unión de CTLA-4 a su ligando B7 provoca una señal inhibidora que bloquea la respuesta de los LT en fases precoces de su cebado en los ganglios linfáticos2,3 (fig. 1).
Esquema de la activación del linfocito T tras la interacción entre el receptor del linfocito T y el complejo mayor de histocompatibilidad y entre las moléculas coestimuladoras B7 y CD28 (superior). Inhibición de la respuesta tras la unión del antígeno citotóxico de los linfocitos T a B7 (inferior).
CD28: cluster of differentiation 28; CMH: complejo mayor de histocompatibilidad; CPA: célula presentadora de antígeno; CTLA-4: antígeno citotóxico de los linfocitos T; LT: linfocito T; RLT: receptor del linfocito T.
CTLA-4 también está implicada en otros procesos de la inmunovigilancia. Los LT reguladores (LTreg) son una subpoblación de LT que desempeñan un papel clave en la prevención de la autoinmunidad fomentando la tolerancia inmunológica frente a antígenos propios. Expresan CTLA-4 de forma constitutiva y ejercen su función supresora en los LT CD4+ y CD8+ autorreactivos mediante diversos mecanismos, entre los que se incluye la secreción de citocinas reguladoras2. Sin embargo, su presencia en el infiltrado inflamatorio peritumoral e intratumoral puede suprimir la función efectora de los LT CD4+ y CD8+ específicos del tumor, promoviendo su desarrollo.
Ipilimumab (Yervoy®) y tremelimumab fueron los primeros anticuerpos empleados, en el año 2000, para bloquear el receptor CTLA-4 y mantener la actividad de los LT específicos en pacientes con cánceres avanzados, incluido el MM4. El bloqueo de CTLA-4 en pacientes con MM metastásico obtuvo tasas de respuesta radiológica del 15% y en algunos pacientes una duración de respuesta de más de 10 años desde la interrupción del fármaco4,5. Más adelante, ipilimumab demostró prolongar la supervivencia en estos pacientes respecto a la quimioterapia convencional con dacarbacina y la vacuna peptídica de glicoproteína 100 en dos ensayos en fase 36,7. Fue aprobado por la Food and Drug Administration (FDA) en 2011 para el tratamiento de MM avanzado y pocos meses después por la Agencia Europea del Medicamento (EMA). En el ensayo en fase 3 tremelimumab no demostró diferencias significativas respecto a la quimioterapia, por lo que no está disponible para su uso en MM, pero se está investigando su utilidad en otros tipos de tumores.
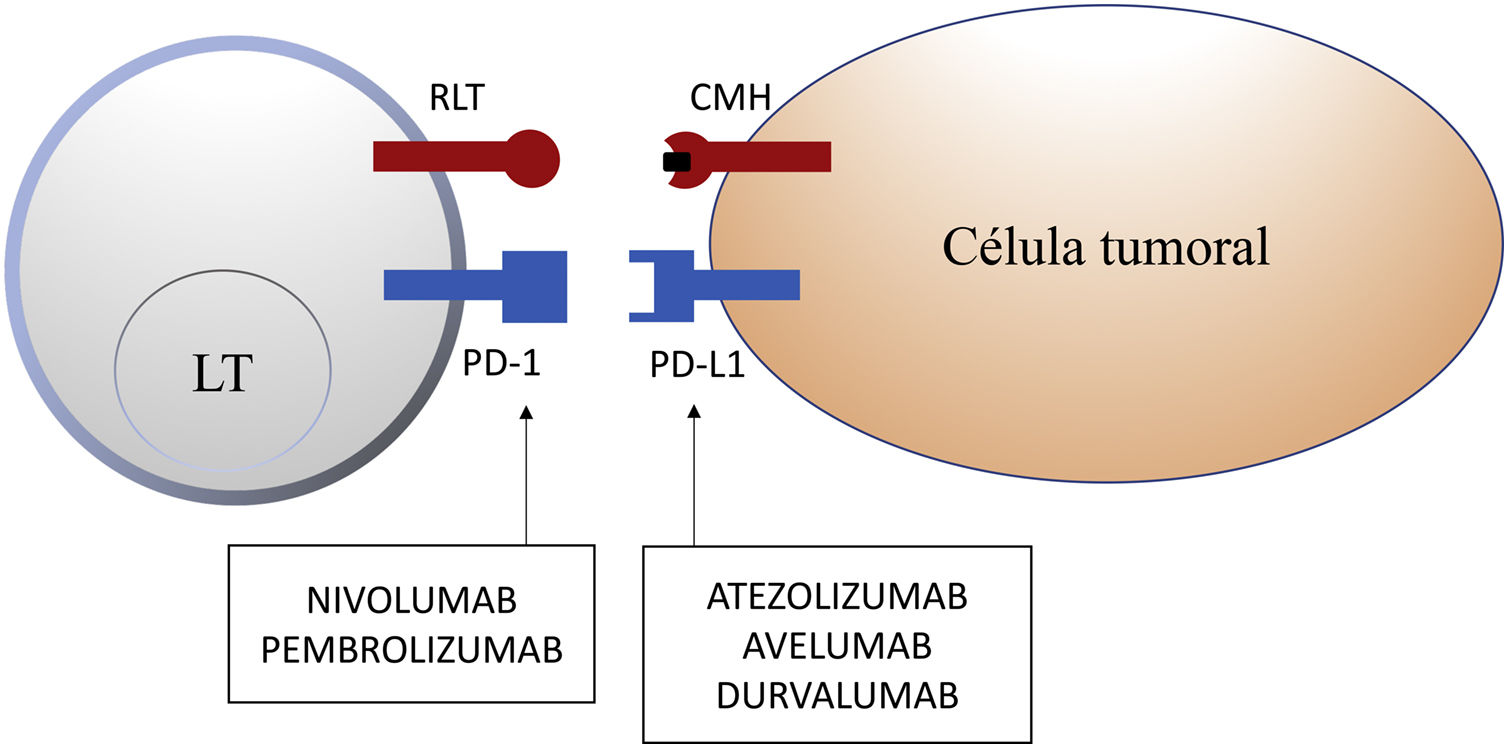
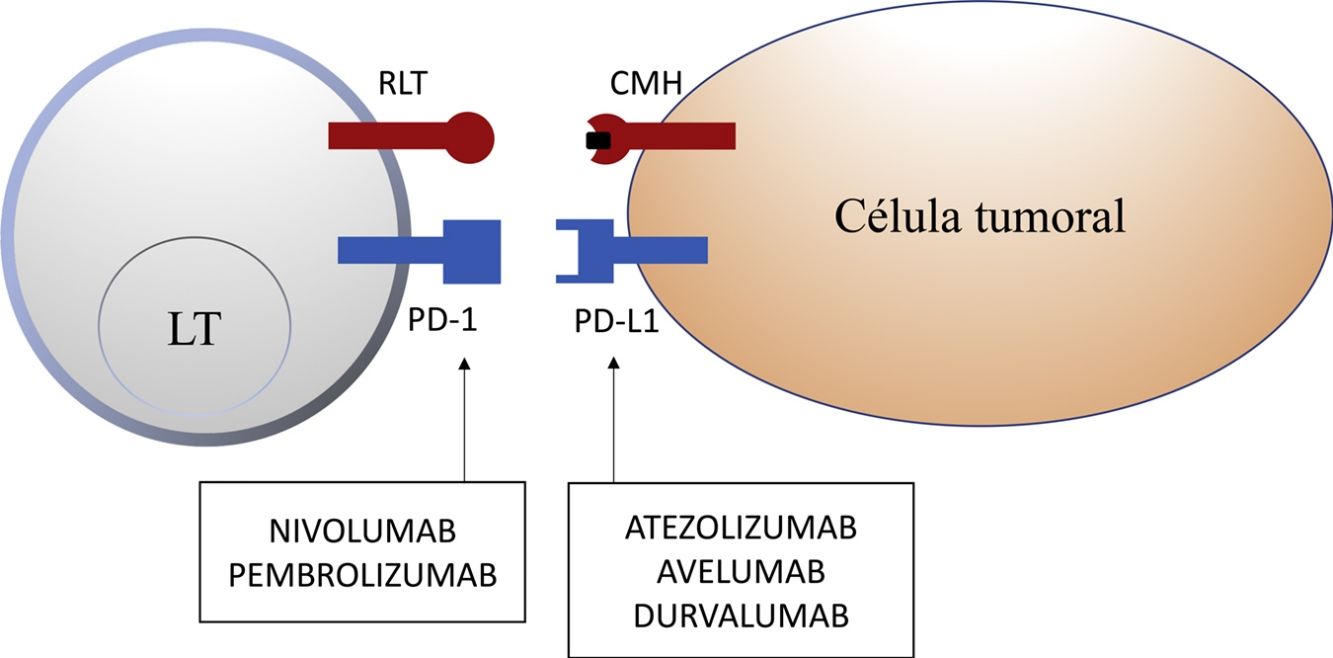
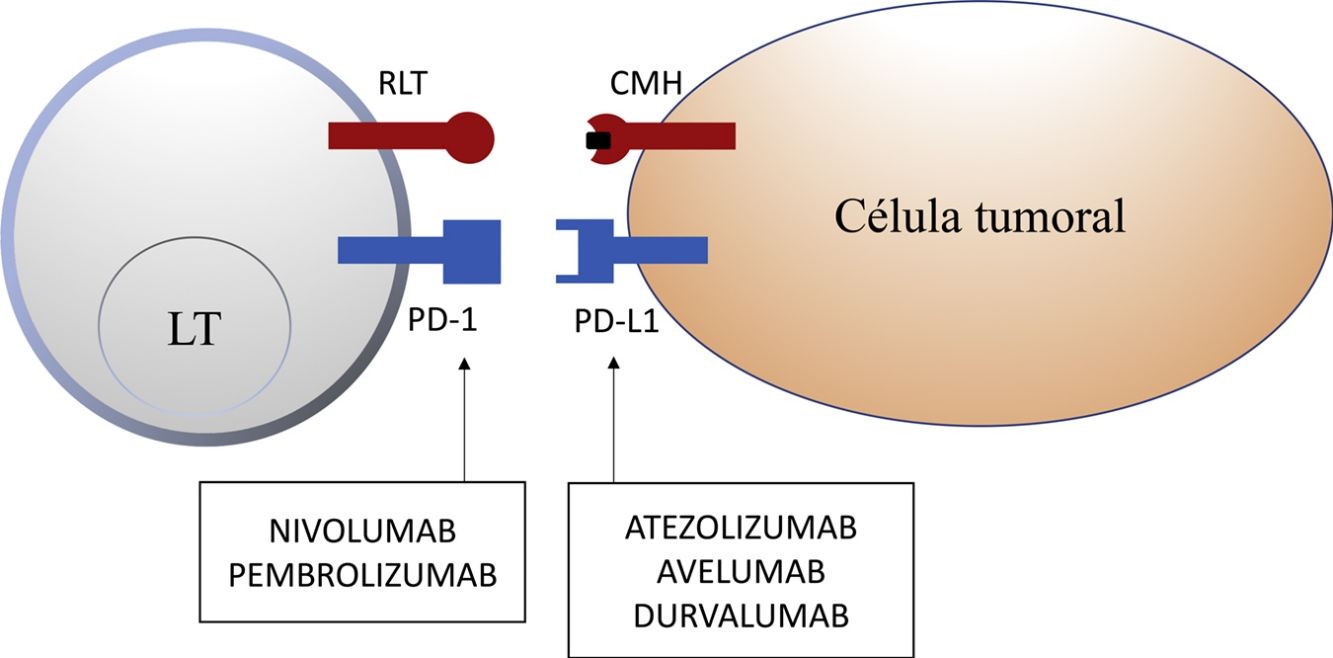
Molécula de muerte programada 1 y ligando de la molécula de muerte programada 1En tejidos sanos, la vía de PD-1 en el LT regula la respuesta inmune para minimizar el daño al tejido adyacente y evitar el desarrollo de autoinmunidad, promoviendo la tolerancia de autoantígenos. PD-1 (o CD279) es un receptor inmune coseñalizador expresado por los LT activados. Funciona principalmente en tejidos periféricos donde los LT pueden encontrar sus ligandos inmunosupresores, PD-L1 (o B7-H1 o CD274) y PD-L2 (ligando de muerte programada 2 o B7-DC). PD-L2 es expresado por CPA y células epiteliales, mientras que PD-L1 es expresado por una amplia variedad de células inmunes y no inmunes, incluyendo algunas células tumorales, como respuesta a determinadas citocinas proinflamatorias (IFN-γ) o por procesos oncogénicos secundarios a mutaciones activadoras. La unión de PD-1 a PD-L1 inhibe la producción de numerosas citocinas (IFN-γ, TNF-α, IL-2), la proliferación linfocitaria y promueve la apoptosis del LT2,8-11.
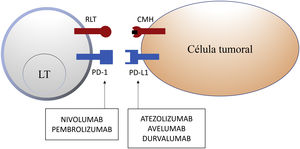
La inhibición de esta vía se puede realizar mediante el bloqueo de PD-1, de forma que se inhibe su unión a ambos PD-L1 y PD-L2, o mediante el bloqueo de PD-L1, que únicamente bloquearía su interacción con PD-1. En la actualidad hay 5 anticuerpos anti-PD-1 o anti-PD-L1 aprobados por la FDA para el tratamiento de 11 tipos de cáncer: nivolumab (Opdivo®), pembrolizumab (Keytruda®), atezolizumab (Tecentriq®), durvalumab (Imfinzi®) y avelumab (Bavencio®). Los primeros en ser aprobados en 2014 fueron nivolumab y pembrolizumab, para el tratamiento de pacientes con MM avanzado (irresecable o metastásico). En 2017 se aprobó avelumab para el tratamiento de pacientes con CCM metastásico (tabla 1, fig. 2).
Anticuerpos anti-PD-1 o PD-L1 aprobados por la EMA
| Anticuerpo | Especificidad | Indicación |
|---|---|---|
| Nivolumab | Anti-PD-1 | Linfoma de Hodgkin clásico, MM, CPNM, CCECC, CCR, carcinoma urotelial |
| Pembrolizumab | Anti-PD-1 | CPNM, MM, linfoma de Hodgkin clásico, carcinoma urotelial |
| Atezolizumab | Anti-PD-L1 | CPNM, carcinoma urotelial |
| Avelumab | Anti-PD-L1 | CCM |
| Durvalumab | Anti-PD-L1 | CPNM (pendiente de aprobación definitiva) |
CCECC: cáncer de células escamosas de cabeza y cuello; CCM: carcinoma de células de Merkel; CCR: carcinoma de células renales; CPNM: cáncer de pulmón no microcítico; EMA: Agencia Europea del Medicamento; MM: melanoma maligno; PD-1: molécula de muerte programada 1; PD-L1: ligando de la molécula de muerte programada 1.
Esquema de la inhibición de los linfocitos T mediada por el ligando de la molécula de muerte programada 1. La unión de la molécula de muerte programada 1 al ligando de la molécula de muerte programada 1 inhibe la señal positiva mediada por la interacción entre el receptor del linfocito T y el complejo mayor de histocompatibilidad.
Nivolumab y pembrolizumab se unen a PD-1. Atezolizumab, avelumab y durvalumab se unen a PD-L1.
CMH: complejo mayor de histocompatibilidad; LT: linfocito T; PD-1: molécula de muerte programada 1; PD-L1: ligando de la molécula de muerte programada 1; RLT: receptor del linfocito T.
A pesar de que estos tratamientos emergen con optimismo para pacientes con tumores avanzados, muchos no responden. Se están diseñando estrategias para mejorar las respuestas e incrementar la supervivencia libre de enfermedad ensayando combinaciones de fármacos12-14. El bloqueo del eje PD-1/PD-L1 tiene mayor efecto antitumoral y menor toxicidad que el bloqueo del eje CTLA-4, dado que este último se produce en una primera fase de la respuesta inmune. Dentro de los efectos secundarios más frecuentes destacan los relacionados con la autoinmunidad frente a células no tumorales. La mayoría son autolimitados o se resuelven con inmunosupresores como los corticoides. Parece ser que el tipo de tumor, las enfermedades asociadas y los tratamientos previos realizados influyen en el perfil de efectos secundarios que aparecen con estas terapias15. La combinación de tratamientos inhibidores de puntos de control inmunitario para así potenciar su efecto antitumoral conlleva un mayor número de efectos adversos inmunomediados y potencialmente graves12. Actualmente la combinación de nivolumab e ipilimumab está aprobada por la EMA para el tratamiento del MM avanzado en adultos.
Inmunoterapia en el cáncer cutáneo no melanomaLa inmunoterapia del cáncer cutáneo no melanoma (CCNM) emerge como una nueva y prometedora herramienta terapéutica. Se está empleando en el tratamiento del CCM, CEC, CBC localmente avanzado y metastásico y de forma anecdótica en el angiosarcoma cutáneo16.
Inmunoterapia en el carcinoma de células de MerkelEl CCM es un tumor neuroendocrino poco frecuente y agresivo, con un índice de mortalidad más elevado que el del MM, alcanzando el 30%17. El 80% se asocia a un poliomavirus y tiene una baja carga mutacional, al contrario de los CCM inducidos por la radiación ultravioleta (RUV) y sin relación con el poliomavirus, que contienen muchas más alteraciones genéticas18. El tratamiento clásico de pacientes con enfermedad diseminada es la quimioterapia. Nivolumab, avelumab y pembrolizumab son actualmente alternativas preferibles en pacientes con enfermedad metastásica en base a los resultados publicados, que demuestran tasas de respuestas más duraderas que las que ofrece la quimioterapia convencional (que solo es de 3 meses de supervivencia libre de progresión)18-20.
Pembrolizumab fue el primer inhibidor de punto de control inmunitario que demostró regresión objetiva del tumor en pacientes con CCM avanzado en un estudio multicéntrico en fase 2, no controlado, que incluía 26 pacientes que no habían recibido quimioterapia. La tasa de respuesta objetiva fue del 56% y se obtuvieron un 16% de respuestas completas. De los pacientes respondedores, la duración de la respuesta fue variable, oscilando entre 2,2 y 9,7 meses y la supervivencia libre de progresión fue del 67% a los 6 meses. Curiosamente, fue eficaz en tumores poliomavirus positivos y negativos y la expresión inmunohistoquímica de PD-L1 no se correlacionó con una mayor probabilidad de respuesta al tratamiento18. Según los resultados de un estudio retrospectivo presentado en la Asociación Americana de Oncología (ASCO) este año, la presencia de una carga mutacional elevada y la exposición prolongada a la RUV se asocian con una mayor tasa de respuesta a la inmunoterapia, no así la presencia o ausencia del poliomavirus de células de Merkel21.
En marzo de 2017 la FDA aprobó el primer anticuerpo monoclonal anti-PD-L1, avelumab (Bavencio®), para el tratamiento de pacientes con CCM metastásico, en base a los resultados del estudio clínico JAVELIN Merkel 20019.
Inmunoterapia en el carcinoma escamoso cutáneoComo ocurre con el CCM, el CEC también es un tumor inmunogénico que se considera un buen candidato para el tratamiento con inmunoterapia. Hay evidencias de que PD-L1 y PD-L2 desempeñan un papel importante en la progresión del tumor, por lo que se perfilan como posibles dianas terapéuticas22,23. La experiencia sobre el uso de la oncoinmunoterapia en este tumor se reduce a observaciones puntuales y a los resultados preliminares de algunos estudios clínicos. Todo ello justifica futuras investigaciones24,25.
Cabe resaltar un artículo publicado en abril de 2017, en el que se evaluaba 38 biopsias de CEC de 24 pacientes mediante tecnología NanoString. Esta tecnología permite estudiar la expresión de ARN mensajero (ARNm) en muestras tumorales parafinadas. Se seleccionaron 10 CEC con invasión perineural, 12 infiltrantes, 6 superficiales, 10 tumores de pacientes receptores de trasplantes de órganos sólidos (RTOS) y 7 muestras de piel normal como control. De todos los subgrupos, los que presentaron mayor expresión de PD-1 y PD-L2 en comparación con los controles fueron los CEC con invasión perineural. También se observó mayor expresión de PD-1 en los CEC con estadios 2B (de 2 a 3 factores de alto riesgo de metástasis, recurrencia y muerte) y 3 (4 o más factores de alto riesgo de metástasis, recurrencia y muerte) según la clasificación de Brigham and Women's Hospital tumor Staging. Los hallazgos del estudio de ARNm codificador de PD-1 y PD-L2 se correlacionaron con su expresión inmunohistoquímica en las muestras tumorales. Los autores concluyeron que los CEC expresan niveles superiores de PD-1 y sus ligandos (PD-L1 y PD-L2) que las muestras de piel normal. Quizás el bloqueo de PD-L1 con anticuerpos monoclonales resulte útil para activar la respuesta inmunológica del huésped frente al tumor y ofrece una alternativa terapéutica a pacientes con CEC avanzados y/o metastásicos sin más opciones de tratamiento. Con estas expectativas, la expresión inmunohistoquímica de PD-L1 podría ser un biomarcador para identificar aquellos pacientes que potencialmente se beneficiarían de estos fármacos26.
En la reunión de este año de la ASCO se han presentado los resultados preliminares de un estudio fase 2 en el que se han tratado 59 pacientes con CEC metastásico con cemiplimab (anti-PD-1). La tasa de respuesta objetiva es del 47,5% (28/59), con una duración de respuesta de más de 6 meses en el 57% de los pacientes respondedores y un perfil de seguridad aceptable27. Estos resultados han sido publicados recientemente28.
Inmunoterapia en el carcinoma basocelularA pesar de que los diferentes subtipos de CBC comparten la activación aberrante de la vía de señalización Hedgehog, posiblemente el sistema inmune desempeña un papel importante en el desarrollo de algunos de estos tumores. Hay varios hechos que apoyan la relevancia de la inmunidad antitumoral en el CBC. Primero, la RUV-B, uno de los factores patogénicos principales, tiene efectos inmunosupresores a largo plazo afectando, principalmente, las reacciones inmunitarias mediadas por los LT29. También induce la aparición de LT reguladores CD4/CD25+, capaces de inhibir funciones efectoras antitumorales y favorecer un microambiente inmunosupresor29-31. Segundo, los pacientes RTOS tienen ente 10 y 16 veces más riesgo de desarrollar un CBC que la población general, cifras que se incrementan conforme aumenta la intensidad y la duración de la inmunosupresión. Estos son más agresivos, invasivos y recurrentes29,32. Tercero, la regresión espontánea parcial es un fenómeno relativamente común en el CBC, pero poco estudiado; parece ser que la secreción de determinadas citocinas por los LT CD4+ activados podría inducir una respuesta antitumoral33-35. Cuarto, con frecuencia hallamos un infiltrado inflamatorio peritumoral acompañante, principalmente formado por LT, si bien se conoce poco sobre su trascendencia. Por último, los inmunomoduladores tópicos son opciones terapéuticas curativas en algunos CBC.
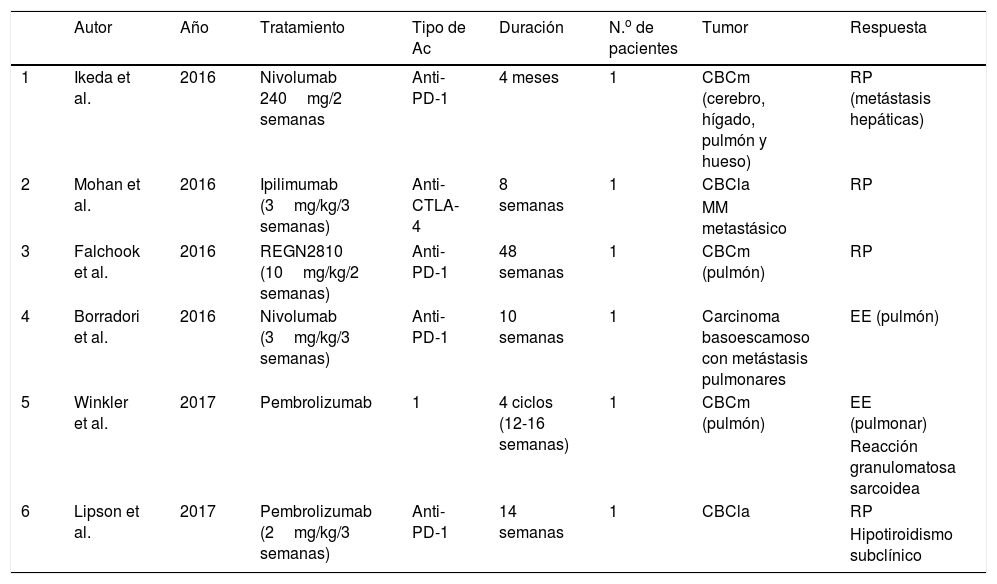
Hay pocas publicaciones sobre el papel de los anticuerpos dirigidos frente a dianas moleculares inmunológicas para el tratamiento de pacientes con CBC localmente avanzados y metastásicos. En enero de 2016, Mohan et al. describieron el caso de un paciente con un MM metastásico tratado con ipilimumab en el que se observó la regresión incidental de un CBC localmente avanzado36. Más adelante, Ikeda et al. publicaron otro caso similar: se trataba de varón de 58 años con un CBC metastásico, con afectación ósea, pulmonar, cerebral y hepática, que había recibido varios tratamientos (vismodegib, cisplatino, paclitaxel, sonidegib y buparlisib), suspendidos por progresión de la enfermedad o por toxicidad. Administraron nivolumab intravenoso cada 2 semanas y a los 4 meses se evidenció una resolución casi completa de las metástasis hepáticas37. En otro paciente con un CBC metastásico en tratamiento con pembrolizumab, la enfermedad permaneció estable durante meses38. En noviembre de 2016, Falchook et al. publicaron el caso de otro CBC metastásico tratado con REGN2810, un anticuerpo monoclonal anti-PD-1 en un estudio fase 1 (NCT02383212), con respuesta parcial y mantenida39. Poco después, Borradori y colaboradores presentaron un paciente con un carcinoma basoescamoso con metástasis pulmonares tratado con nivolumab que se mantuvo con enfermedad estable durante pocos meses40. Por último, Lipson et al. publicaron una paciente con un CBC localmente avanzado, no candidata a cirugía, tratada previamente con RT y un inhibidor de la vía Hedgehog, que inició pembrolizumab intravenoso 2mg/kg cada 3 semanas durante 14 semanas, obteniendo una respuesta parcial mantenida. Vale la pena señalar que el estudio inmunohistoquímico antes de iniciar el tratamiento solo demostró expresión de PD-L1 en las células inmunológicas, no en las tumorales, y que aproximadamente el 50% de los LT expresaban PD-141 (tabla 2).
Resumen de los CBC tratados con inhibidores de proteínas de control inmunitario
| Autor | Año | Tratamiento | Tipo de Ac | Duración | N.o de pacientes | Tumor | Respuesta | |
|---|---|---|---|---|---|---|---|---|
| 1 | Ikeda et al. | 2016 | Nivolumab 240mg/2 semanas | Anti-PD-1 | 4 meses | 1 | CBCm (cerebro, hígado, pulmón y hueso) | RP (metástasis hepáticas) |
| 2 | Mohan et al. | 2016 | Ipilimumab (3mg/kg/3 semanas) | Anti-CTLA-4 | 8 semanas | 1 | CBCla | RP |
| MM metastásico | ||||||||
| 3 | Falchook et al. | 2016 | REGN2810 (10mg/kg/2 semanas) | Anti-PD-1 | 48 semanas | 1 | CBCm (pulmón) | RP |
| 4 | Borradori et al. | 2016 | Nivolumab (3mg/kg/3 semanas) | Anti-PD-1 | 10 semanas | 1 | Carcinoma basoescamoso con metástasis pulmonares | EE (pulmón) |
| 5 | Winkler et al. | 2017 | Pembrolizumab | 1 | 4 ciclos (12-16 semanas) | 1 | CBCm (pulmón) | EE (pulmonar) |
| Reacción granulomatosa sarcoidea | ||||||||
| 6 | Lipson et al. | 2017 | Pembrolizumab (2mg/kg/3 semanas) | Anti-PD-1 | 14 semanas | 1 | CBCla | RP |
| Hipotiroidismo subclínico |
CBC: carcinoma basocelular; CBCm: carcinoma basocelular metastásico; CBCla: carcinoma basocelular localmente avanzado; CTLA-4: antígeno citotóxico de los linfocitos T; EE: enfermedad estable; MM: melanoma maligno; PD-1: molécula de muerte programada 1; RP: respuesta parcial.
Actualmente hay dos estudios con inhibidores de proteínas de control inmunitario en CBC; en el primero se emplea un inhibidor de PD-1 (REGN2810) en pacientes con CBC localmente avanzado o metastásico no tributarios o refractarios a inhibidores de la vía de señalización Hedgehog; y en el segundo se emplea nivolumab en monoterapia o asociado a ipilimumab en pacientes con CBC localmente avanzado no tributario de cirugía o metastásico42,43.
ConclusionesLa potenciación del sistema inmunológico en el tratamiento del cáncer se perfila como una alternativa eficaz y prometedora. Los dermatólogos tenemos experiencia con estas terapias en pacientes con MM avanzado y recientemente en el CCM. Vale la pena invertir esfuerzos en tumores frecuentes como el CBC y el CEC y realizar estudios controlados para determinar su eficacia, que supondría una alternativa terapéutica para algunos pacientes. Además, hay que tratar de identificar biomarcadores que nos permitan seleccionar aquellos pacientes que puedan beneficiarse de estos tratamientos, en monoterapia o combinados, y así evitar efectos secundarios en los previsiblemente no respondedores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.